外泌体蛋白质组学分析白念珠菌感染小鼠的标志物
王泽田, 吴春荣, 齐 越, 徐 丹, 孙科远, 唐建国
(复旦大学附属上海市第五人民医院创伤急救危重症医学中心,上海 200240)
白念珠菌是人类肠道的常见条件致病菌,正常情况下与宿主之间维持平衡状态。然而,当肠道屏障受损,如休克肠道缺血、消化道穿孔、肠梗阻、肠道手术等情况下,白念珠菌可入侵肠上皮屏障,进入无菌体腔,如胸腹腔等,甚至进入血流,导致侵袭性白念珠菌感染[1-2]。临床诊断白念珠菌感染主要依靠微生物涂片和培养,但周期较长,阳性率不高。因此,寻找白念珠菌感染的生物标志物是急需解决的难题。
外泌体包含许多信号分子、脂类、蛋白质、DNA、mRNA、miRNA和siRNA等,能在细胞间传递重要的介质,并顺利通过体液循环而不受体内各种酶的降解[3-5]。因外泌体具有特异性生物标志物,能为白念珠菌感染提供有价值的诊断,所以笔者尝试分析血清外泌体蛋白质组学,寻找侵袭性白念珠菌感染的特异性标志物。
材料和方法
一、菌株和实验动物
白念珠菌标准菌株ATCC10231、金黄色葡萄球菌标准菌株ATCC29213和大肠埃希菌标准菌株ATCC25922购于上海鲁微科技有限公司;SPF级别雄性Wistar小鼠60只,购于上海斯莱克实验动物有限公司。上海交通大学生命科学院动物房饲养,实验前适应喂养2周,其中8只用于白念珠菌感染的外泌体蛋白组学实验,其余用于差异蛋白鉴定实验。
二、菌液配置和模型构造
国内、外研究显示,尾静脉注射LD50菌液浓度2.5×108CFU(colony forming units)1mL建立小鼠白念珠菌侵袭感染模型。本课题组前期研究证明该浓度的有效性[6]。取8只小鼠分为白念珠菌组4只,正常对照组4只。白念珠菌组尾静脉注射2.5×108CFU1mL的白念珠菌菌液,正常对照组注射无菌生理盐水,注射量均为0.1 mL110 g。注射后24 h采用心脏采血法采集血液。注入乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝管,4℃,1 600 r1min离心10 min。上清液分离成血清,-80℃保存。
三、分离富集血清外泌体
取出-80℃血样品(1 mL1等份),快速解冻,3 500 r1min离心30 min。4℃下清除细胞碎片和杂质。每管上清液用1×PBS(中国生工生物)预冷稀释至7 mL,用0.22 mm(美国密理博)过滤。超离心法分为萃取和洗涤两步进行。所有的超离心法均在160 000 r1min,4℃,使用SW41转子(Beckman Coulter,USA)进行。第一步离心后,取出上清液,用1 mL 1×PBS重悬托盘行第二步。在试管底部收集外泌体,最后用200 mL 1×PBS重悬。
四、外泌体纳米粒径分析
将富集的外泌体悬浮于100 μL PBS溶液,充分震荡混合。将10 μL样品,用超纯水稀释至1 mL,注入Nano-Sight S300纳米粒度仪,按标准程序测定粒径分布和浓度。每个样本的采样分析为3次。采用Nano-Sight NTA(V3.2)软件分析结果,拟合3次结果。将分离富集的外泌体重悬于100 μL PBS溶液中。取10 μL滴在电镜测试铜网上,室温下静置5 min,用滤纸吸去浮液,用超纯水洗3次。待风干后加10 μL磷钨酸溶液于铜网上,静置染色2 min。用无尘滤纸吸去残液,室温静置风干,制成电镜测试样本,上机分析。采用透射电镜(Tecnai G2 Spirit Bio TWIN,USA)80~120 kV下观察血清外泌体的形态。采用蛋白质免疫印迹检查血清外泌体的标志性蛋白质CD63。简要实验步骤为:用10%分离胶和5%浓缩胶。浓缩胶用80 V、分离胶用120 V进行电泳。根据预染Marker指示,转移相应蛋白质到PVDF膜。用5%脱脂牛奶封闭液封闭,室温1 h。封闭后分别用抗 CD63抗体 1∶1 000、β-actin抗体1∶1 000 保温过夜,TBST 洗涤 3 次,每次 15 min,保温二抗辣根过氧化物酶标志山羊抗兔IgG 1∶20 000,室温1 h,TBST洗涤3次,每次15 min。用增强化学发光曝光、显影,用Image J软件分析测定其灰度值。
五、蛋白质酶解
首先,外泌体蛋白质和50%乙醇组成有机溶液,50%丙酮和0.1%醋酸的5倍体积完全混合,与获得的蛋白质沉淀溶解在6 mol1L盐酸胍溶液,-20℃过夜。加入dl-硫苏糖 2 μL,60℃下还原60 min。然后加入10 μL吲哚-3-乙酸、烷基化液避光40 min。将得到的蛋白质溶液转移到10 kDa的滤管中,4℃,130 00 r1min,离心20 min浓缩蛋白质。以酶∶蛋白质 1∶20的比例加入胰蛋白酶 (美国Promega)。酶解后用C18滤芯脱盐,冷冻干燥,加入40 μL溶解缓冲液复溶,肽段定量光密度(optical density,OD)280。
六、LC-MS1MS 数据采集
用0.1%甲酸重新悬浮干燥的肽至最终浓度为0.5 g1L,每个样品用简单的nano-UPLC 1000与轨道阱质谱仪+质谱联用仪(Thermo Scientific,USA)分析2 mL。肽用缓冲液B(0.1%TFA在乙腈中)梯度洗脱:0~65 min,3%~35%缓冲液 B;66~68 min,35%~80%缓冲液 B;69~75 min,80%缓冲液 B,流速300 nL1min。质谱数据文件以数据依赖方式获取。全扫描MS谱质荷比(mass-to-charge ratio,m1z,300~1 500),分辨率为 70 000(m1z,200),自动增益控制(AGC)2×105,最大进样时间 100 ms,前驱电荷2~6。从全扫描中选取前20个丰富的前体,隔离窗为2.0 m1z,在归一化能量为35%的情况下,被更高能量的碰撞诱导离解碎片化。AGC为1×104,最大注射时间为35 ms。动态排除时间为60 s。
七、蛋白质鉴定和定量分析
质谱测试原始文件(Raw File)用Maxquant软件(1.5.5.1版本)检索相应数据库,最后得到蛋白质鉴定及定量分析结果。搜索条件设置为:最多允许2个胰蛋白酶漏切位点,氧化修饰和乙酰化修饰设为可变修饰,前体和碎片离子的质量误差分别为6×10-6和 0.5 Da。蛋白质鉴定的标准为:至少检测到2个特征肽段,P<0.05,假阳率<1%。通过在Maxquant中使用基于强度的绝对定量(intensitybased absolute protein-quantification,iBAQ)对鉴定的肽段进行定量分析。将每种蛋白质的iBAQ对其所在样品总iBAQ值的贡献进行归一化处理,且至少根据该蛋白质的两个特征肽段iBAQ值来确定其相对丰度。计算差异蛋白质的变化倍数和P值,P<0.01为差异有统计学意义,变化倍数>2为显著上调,<0.5为显著下调。
八、差异蛋白鉴定
为验证上述差异蛋白在不同病原菌感染中的表达差异,笔者取30只小鼠再次构建白念珠菌感染模型,分别在感染12、24、36 h每组依次处死10只小鼠。取20只小鼠构建金黄色葡萄球菌感染模型和大肠埃希菌感染模型,每组10只。金黄色葡萄球菌感染组尾静脉注射LD50浓度为4.5×108CFU1mL的菌液[7]。大肠埃希菌感染组尾静脉注射LD50浓度为 2×109CFU1mL的菌液[8],在感染12 h后处死小鼠。采用心脏采血法采集各组小鼠血液,置入EDTA抗凝管,4℃,1 600 r1min离心10 min,将上清液分离成血浆,-80℃保存。
使用ELISA法检测血浆中差异蛋白含量。分别取上述小鼠的部分血浆加入ELSIA试剂盒中,严格按照ELISA试剂盒说明进行操作。各孔用酶标仪在450 nm处测定吸光度值。用标准品的浓度与吸光度值制作标准曲线。根据线性回归方程和样品的吸光值计算获得对应的浓度。样品最终浓度=所测浓度×稀释倍数。同时取部分血浆送至本院检验科,检测白细胞、C反应蛋白、白介素6的表达水平。
为在感染早期鉴定差异蛋白的诊断价值,在各组小鼠感染12 h后,根据差异蛋白在白念珠菌感染组、金黄色葡萄球菌感染组和大肠埃希菌感染组中的表达水平建立受试者工作特征曲线(receiver operating characteristic curve,ROC),计算曲线下面积(area under curve,AUC)及 95%CI。
结 果
一、血清外泌体的分离富集
提取白念珠菌感染的小鼠血清进行外泌体分离后,笔者观察到小鼠血清外泌体的粒径为100~150 nm(见图1A),与外泌体的形态特征一致。透射电镜验证获得的外泌体,显示出粒径为100~150 nm的典型外泌体,具有双层杯状结构(见图1B)。用已知外泌体标记CD63的免疫印迹分析,检测外泌体制备的效率(见图1C)。以上结果表明,血清外泌体已成功富集,可用于实验。

图1 血清外泌体表征
二、差异蛋白质筛选和聚类分析
正常对照组小鼠血清(n=4)和白念珠菌组小鼠血清(n=4)经LC-MS技术分析,共鉴定到4 055个不同肽段,对应到418个蛋白质。对418个蛋白质进行统计学分析,以符合白念珠菌组1正常对照组差异变化<0.7倍至>1.5倍,同时P<0.05为标准,共得到差异蛋白91个(见图2A)。根据白念珠菌组1正常对照组差异变化<0.5倍至>2.0倍,同时P<0.05为标准,筛查出蛋白质10个(见表1)。应用Omicsbean生物信息学分析软件对91个差异蛋白进行基因本体分析和KEGG通路分析。在生物学过程、分子功能、细胞组成方面进行基因本体分析。结果显示,这些差异蛋白主要涉及的生物学过程包括:蛋白质活化级联、免疫反应、防御应答、补体激活、经典激活途径。涉及的分子功能包括:免疫球蛋白受体结合、抗原结合、丝氨酸型内肽酶抑制剂活性、肽酶调节活性、受体结合、内肽酶抑制剂活性。涉及的细胞组成包括细胞间隙、血液微粒、免疫球蛋白复合物、外泌体(见图2B)。KEGG通路分析显示,这些差异蛋白主要涉及补体系统、黏着斑、血小板激活、PPAR信号通路、细胞外基质受体相互作用、吞噬体、氮素代谢、维生素的消化与吸收、集合管酸分泌、溶酶体、细胞凋亡(见图2C)。研究蛋白质之间的相互作用及其形成的网络对揭示蛋白质的功能具有重要意义。同时,结合蛋白-蛋白相互作用网络分析和pathway注释的结果,可在分子水平上获得更全面、系统的细胞活性模型(见图2D)。
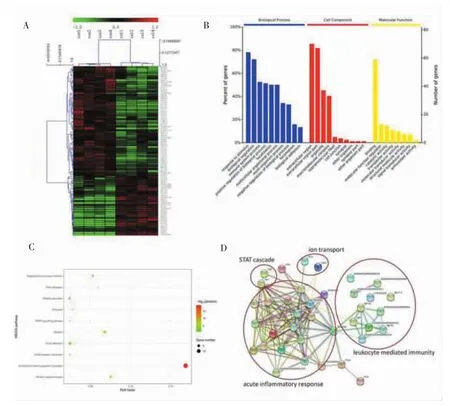
图2 外泌体蛋白生物信息分析
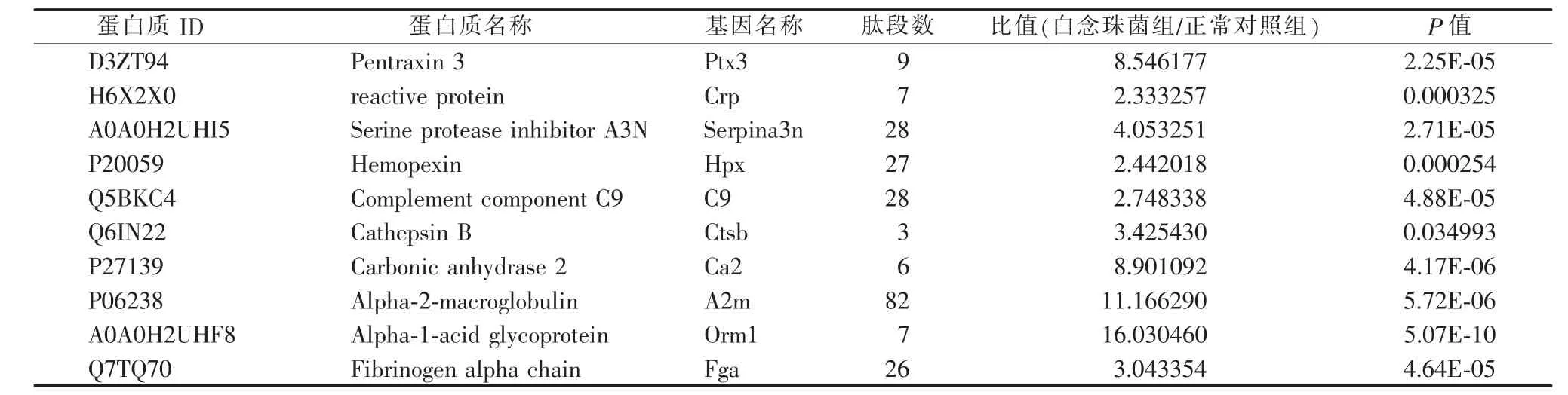
表1 在白念珠菌感染中变化显著的10个候选蛋白质
三、差异蛋白的验证
在白念珠菌组的特异表达蛋白质中,找出与白念珠菌密切相关的2个蛋白质,Cathepsin B和Pentraxin 3。在白念珠菌感染 12、24、36 h后,观察上述差异蛋白和感染标志物白细胞、C反应蛋白和白介素6表达变化趋势,发现随着感染时间延长,差异蛋白的表达量逐渐升高,并与上述感染标志物变化一致。而且小鼠活动下降、食欲减退、尾巴潮湿等症状随着感染时间延长而加重(见图3A)。在感染12 h后采用GraphpadPrim 6.0软件建立ROC诊断模型,比较 Cathepsin B AUC为 0.9587,95%CI为0.885~1.032,灵敏度80.0%,特异度90.0%。Pentraxin 3 的 AUC 为 0.97,95%CI为 0.907~1.033,灵敏度81.8%,特异度90.9%(见图3B)。构建大肠埃希菌感染的动物模型(n=10只)和金黄色葡萄球菌感染的动物模型(n=10只)。金黄色葡萄球菌感染组尾静脉注射LD50浓度为4.5×108CFU1mL的菌液[7]。大肠埃希菌感染组尾静脉注射LD50浓度2×109CFU1mL的菌液[8]。分别使用ELISA,验证上述蛋白质在白念珠菌感染组、大肠埃希菌感染组和金黄色葡萄球菌感染组的表达差异。结果发现Cathepsin B、Pentraxin 3在白念珠菌感染组中大量表达,在正常对照组、金黄色葡萄球菌感染组、大肠埃希菌感染组少量表达,差异有统计学意义(P<0.05)(见图3 C、D)。
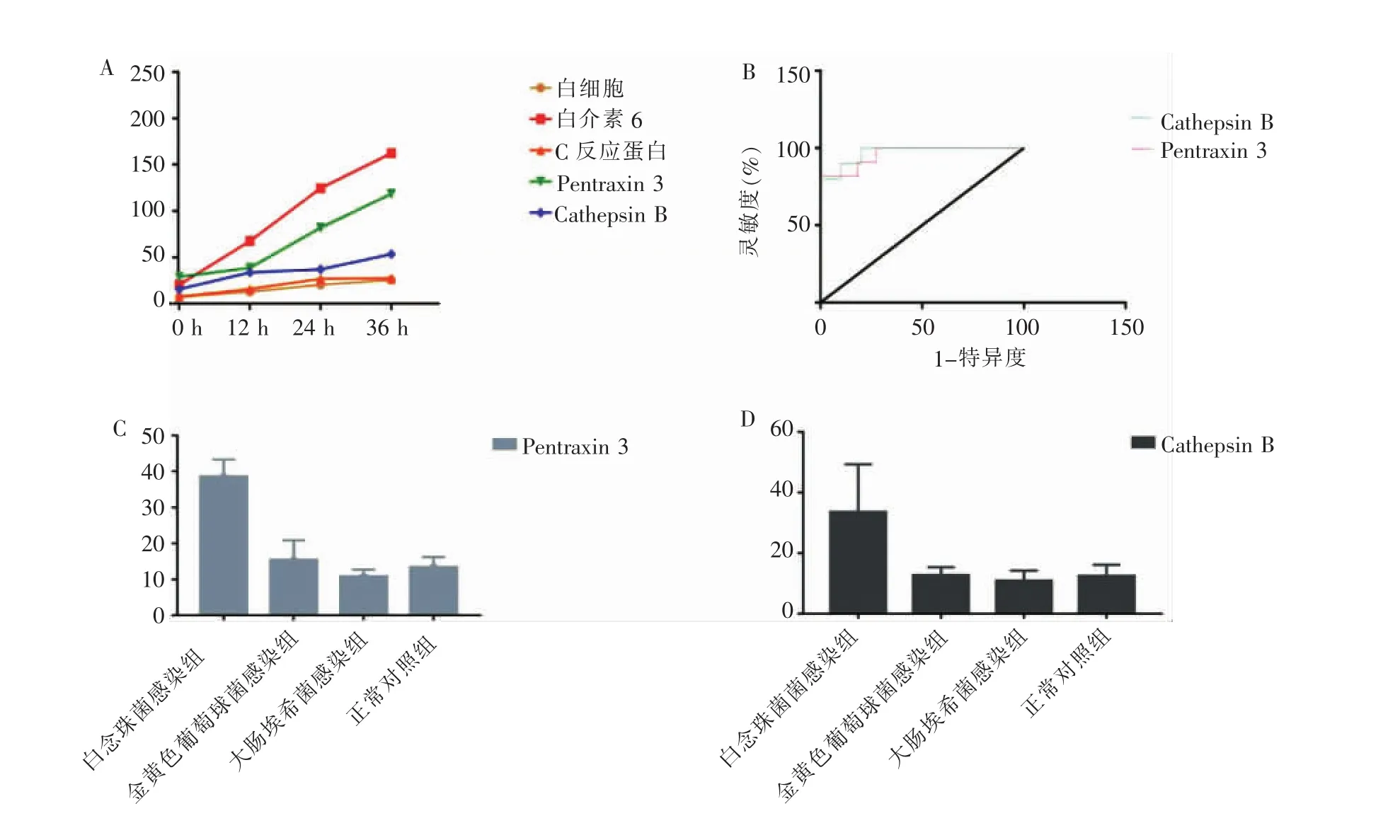
图3 差异蛋白的验证
讨 论
白念珠菌是一种常见的条件致病真菌,常寄生于人体肠道黏膜表面。因肠道的物理屏障、化学屏障、生物屏障和免疫屏障等保护作用,通常白念珠菌不引起致病[9-11]。当机体处于手术等高度应激或肠道功能紊乱时,肠道屏障受损,白念珠菌可致病,严重时危及生命[12-13]。对于围术期病人,早期诊断白念珠菌感染具有重要的临床意义。
目前已确定具有多种亚型的多功能循环外泌体存在于多类疾病,如心血管疾病、感染性疾病和自身免疫性疾病等。此外,外泌体还具有调节免疫、抗原呈递的功能,对适应性免疫应答具有重要的作用[14-16]。外泌体也作为一种可调控的新型药物,用于脓毒症的诊断和治疗[17-18]。本研究发现,白念珠菌组小鼠与正常对照组小鼠的血浆外分泌蛋白存在差异。共筛选出10个在白念珠菌组中表达显著增加的血浆外泌体蛋白。筛选出Cathepsin B、Pentraxin 3与白念珠菌密切相关。Cathepsin B是木瓜蛋白酶家族中的半胱氨酸蛋白水解酶,广泛分布于各种组织细胞中,是溶酶体中重要的蛋白水解酶[19]。有研究报道,吞噬细胞外细菌导致溶酶体失稳和Cathepsin B的释放,调控白念珠菌诱导的核苷酸结合寡聚化结构域样受体家族pyrin结构域蛋白3炎症小体激活[20]。Cathepsin B增强表达与结肠直肠癌浸润转移有关,但在肠道损伤及炎症反应中无研究报道,因此可进一步研究,验证其在白念珠菌侵袭导致肠道损伤中的作用及意义[21]。Pentraxin 3是一种可溶性的体液先天免疫模式识别受体,被称为“抗体前体”。其能识别外来微生物,并作为调节炎症反应的调节剂[22]。Pentraxin 3由血管内皮细胞和巨噬细胞产生,由中性粒细胞储存,并在介导真菌病原体的抵抗中发挥作用,其水平可直接反映炎症状态。因其肝外合成,与C反应蛋白相反;Pentraxin 3水平被认为是疾病活动性的一个真正独立指标[23]。
为进一步验证差异蛋白与白念珠菌感染的相关性,再次构建白念珠菌感染的小鼠模型。通过ELISA定量分析Cathepsin B、Pentraxin3,随着白念珠菌感染时间的延长,及炎症介质的进行性加重,差异蛋白的表达水平进行性升高,而且建立ROC诊断模型。实验证明上述差异蛋白与白念珠菌感染的严重程度密切相关。为验证Cathepsin B、Pentraxin3是否在其他菌株感染中表达,再次建立金黄色葡萄球菌感染和大肠埃希菌感染的小鼠模型,在感染12 h后经小鼠眼眶取血提取血浆。ELISA检测发现,Cathepsin B、Pentraxin 3仅在白念珠菌感染中大量表达,在正常对照组、金黄色葡萄球菌感染组和大肠埃希菌感染组中少量表达,且差异有统计学意义。因此,上述差异蛋白可作为白念珠菌感染的标志物。
外泌体蛋白组学在临床研究中已广泛应用。有研究者发现,乳腺癌病人血清外泌体膜蛋白GPC-1表达水平高于健康对照和乳腺良性病组,含量与肿瘤分期正相关。GPC-1阳性病人较阴性病人易出现淋巴结转移,临床分期较晚,肿瘤细胞增殖程度较高,对乳腺癌的诊断有潜在应用价值[24]。抽提骨巨细胞瘤病人和非肿瘤病人的血清外泌体,采用LC-MS1MS分析鉴定外泌体的蛋白质组学特征,对检测蛋白质进行生物信息学分析,寻找骨巨细胞瘤的血浆标志物[25]。Cathepsin B、Pentraxin 3目前仅有动物实验验证,尚需进一步的临床试验,研究Cathepsin B、Pentraxin 3在白念珠菌感染中的应用价值,为早期预防和治疗白念珠菌感染提供帮助。

