毛细管电泳法结合化学计量学分析评价云芝胞内糖肽的质量
孙玉娣,张圆,王文涛,石蓓佳,,陆益红,*,李志裕*(.中国药科大学药学院,南京 0000;.江苏省食品药品监督检验研究院生物技术药品检验一室,南京 009;.SCIEX中国,上海 00000)
云芝胞内糖肽是运用现代生物工程技术,杂色云芝菌[Polystictus versicolor(L).Fr.,又名Trametes versicolor]经深层培养后,菌体提取获得的糖肽类物质,其具有增强机体免疫的功效,在临床可用于慢性乙型肝炎、肝癌及老年免疫功能低下者的辅助治疗。由于云芝胞内糖肽为大分子混合物,组成复杂,含有蛋白质、脂肪、多糖、葡聚糖、糖肽、氨基酸和无机盐等物质[1],因此对云芝胞内糖肽的分离分析具有一定难度。有文献报道糖类结构中的邻二羟基与硼酸根离子可结合形成带负电荷的络合物,根据络合物淌度的不同可实现毛细管电泳(CE)的有效分离[2]。除此之外,CE不受色谱填料对分子量的制约,在不破坏糖肽结构的前提下,通过特征的糖肽指纹图谱体现其组成,对确保云芝胞内糖肽制剂的工艺稳定性具有积极作用。本试验采用CE法,分离检测云芝胞内糖肽原料及制剂特征色谱峰,用ChemPattern软件建立指纹图谱,对结果进行主成分分析(PCA)和系统聚类分析(HCA),为云芝胞内糖肽胶囊(片)的质量评价提供参考。
1 材料
SCIEX PA 800 Plus 毛细管电泳分析仪,二极管阵列检测器(DAD);ChemPattern 2020版(科迈恩科技)。云芝胞内糖肽胶囊(片)(共计18批,原料均来自于A厂家,具体见表1),菌丝体水提醇沉产物1,培养液滤液醇沉产物2(以下简称产物1、产物2,A厂家),云芝胞内糖肽原料(Q厂家,批号:S-30200601),云芝胞内糖肽对照品(批号:140692-200301,原料来自Q厂家)。由于生产工艺的差异,A厂家原料中含有产物1和产物2,Q厂家原料中仅含有产物1。
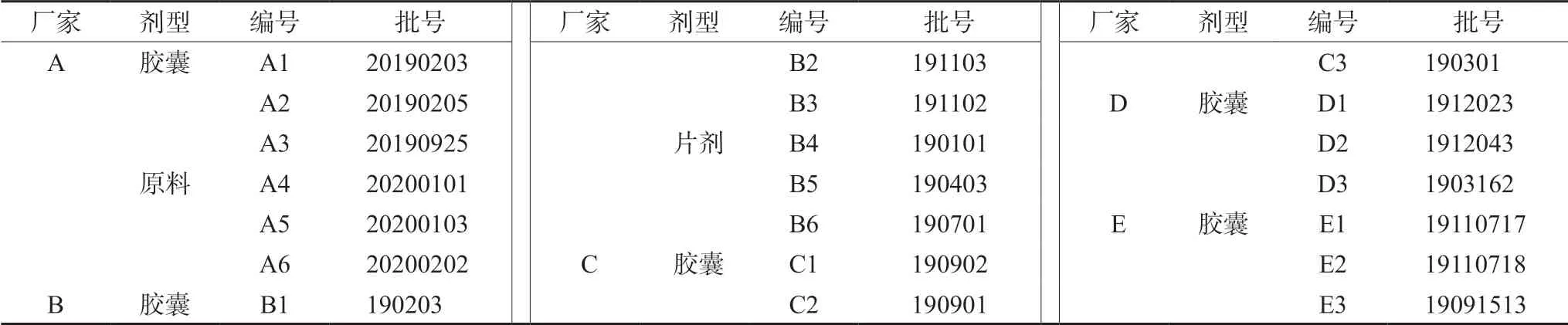
表1 云芝胞内糖肽来源Tab 1 Source of coriolus versicolor intracellular glycopeptide
2 方法与结果
2.1 供试品溶液的制备
取云芝胞内糖肽胶囊内容物、云芝胞内糖肽片样品研细,精密称取10 mg,对照品、原料药、产物1与产物2直接精密称取10 mg,置于1.5 mL离心管中,加入1 mL去离子水,涡旋混匀后,3000 r·min-1离心5 min,取上清液进行分析。
2.2 电泳条件
石英毛细管(60.2 cm×75 μm,有效长度 50 cm);运行电压15 kV;紫外检测波长200 nm;背景电解质溶液(BGE)为50 mmol·L-1四硼酸钠,pH 9.18;样品缓冲液H2O;毛细管温度25℃;样品室温度25℃;进样条件0.5 psi 5 s;熔融石英毛细管初次使用时,依次用0.1 mol·L-1氢氧化钠溶液、0.1 mol·L-1盐酸溶液和二次去离子水在20 psi下各冲洗5 min,最后用BGE在20 psi下冲洗5 min,并在15 kV电压下平衡10 min。在每针运行之间依次用0.1 mol·L-1氢氧化钠溶液、0.1 mol·L-1盐酸溶液和水在20 psi条件下各冲洗3 min,最后用BGE在20 psi下冲洗5 min。数据处理采用32 Karat软件[3-4]。
2.3 数据分析
采用ChemPattern软件,以A厂家制剂样品中6个特征峰(保留时间分别为8.9、12.8、14.4、17.2、17.8、24.9 min)的峰面积建立共有模式,对样本进行PCA和HCA分析[5-6]。
2.4 方法学验证
2.4.1 进样精密度试验 取A企业原料(批号:20200101),按“2.1”项下方法制备供试品溶液,按“2.2”项下条件连续进样6次,计算各峰峰面积的RSD(n=6)。结果显示,各峰峰面积的RSD均小于1.0%,各峰相对保留时间的RSD均小于1.5%,表明该仪器进样精密度良好。
2.4.2 稳定性试验 取A企业原料(批号:20200101),按“2.1”项下方法制备供试品溶液,分别在0、4、8、12、18、24 h按“2.2”项下条件进样分析,计算各峰峰面积的RSD(n=6)。结果显示,各峰峰面积的RSD均小于0.3%,各峰相对保留时间的RSD均小于1.7%,表明供试品溶液在24 h内稳定。
2.4.3 重复性试验 取A企业原料(批号:20200101),按“2.1”项下方法平行制备6份供试品溶液,按“2.2”项下条件进行分析,计算各峰峰面积的RSD(n=6)。结果显示,各峰峰面积的RSD均小于1.0%,各峰相对保留时间的RSD均小于1.8%,表明该方法重复性良好。
2.5 毛细管电泳指纹图谱的建立
2.5.1 样品叠加图谱的生成 取5个厂家云芝胞内糖肽胶囊(片)各1批,A厂家提供的产物1、产物2,Q厂家原料和对照品分别按“2.1”项下方法制成供试品溶液,按“2.2”项下条件进样分析,记录CE色谱图。采用ChemPattern软件,对图谱进行中值基线滤波去背景,使用保留时间校正进行全峰匹配建立指纹图谱,共有6个特征峰,见图1。
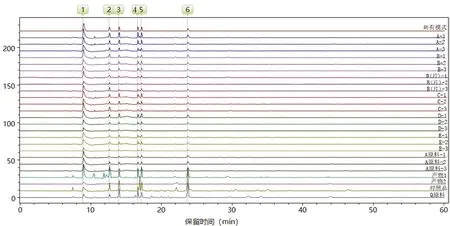
图1 云芝胞内糖肽样品的指纹图谱叠加图Fig 1 CE fingerprints of coriolus versicolor intracellular glycopeptide
2.5.2 共有模式图谱的建立 各厂家云芝胞内糖肽制剂的原料均来自于A厂家,因此以A厂家3批样品为代表性样品,以A厂家图谱的6个峰作为特征峰建立共有模式,见图2。

图2 云芝胞内糖肽共有模式图Fig 2 Common pattern of coriolus versicolor intracellular glycopeptide
2.6 毛细管电泳指纹图谱的化学计量学分析
2.6.1 相似度分析[7-8]将18批云芝胞内糖肽胶囊(片)、A厂家原料、产物1、产物2、Q厂家原料和对照品的CE图导入ChemPattern软件,以共有模式图谱为参照,计算夹角余弦相似度,结果见表2,相似度统计图见图3。表2结果显示,A厂家及使用A厂家原料各厂家的制剂与共有模式相似度在0.96以上,图3结果显示产物2、A厂家原料及使用A厂家原料各厂家的制剂与产物1、Q厂家原料和对照品呈明显区分。

图3 云芝胞内糖肽相似度结果统计图Fig 3 Statistical chart of similarity of coriolus versicolor intracellular glycopeptide

表2 相似度分析结果Tab 2 Similarity analysis
2.6.2 系统聚类分析[9-11]将所有CE图导入Chem Pattern软件,对图谱进行UV标度化处理,以共有模式图谱为参照,采用街区距离计算方法为测度,以最短距离法连接,进行HCA分析,结果见图4。样品间的分类距离值越大,差异性就越大。HCA树状图结果表明,共有模式与A厂家原料、使用A厂家原料各厂家的制剂及产物2为一类,Q厂家原料和对照品为一类。
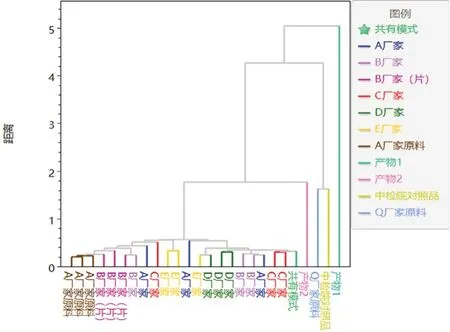
图4 云芝胞内糖肽HCA结果图Fig 4 HCA diagram of coriolus versicolor intracellular glycopeptide
2.6.3 主成分分析[12]使用ChemPattern软件对图谱进行UV标度化处理,用PCA程序分析样品组间差异性。当提取 6个主成分时,检验因变量个数P=6,χ2=146.56,自由度df=15,显著性P=0,按检验水平α=0.05,拒绝假设H0,差异有统计学意义。经PCA模型分析生成得分图、载荷图,分别见图5~6。

图5 云芝胞内糖肽PCA得分图Fig 5 PCA score diagram of coriolus versicolor intracellular glycopeptide
图6 云芝胞内糖肽PCA 载荷图Fig 6 PCA load diagram of coriolus versicolor intracellular glycopeptide
PCA得分图中各点聚集状态反映了样品批之间内的异同,由图5可知,产物2、A厂家原料及使用A厂家原料各厂家的制剂数据点与共有模式同群,说明同一原料厂家来源的制剂化学成分具有相似性。产物1、Q厂家原料和对照品与共有模式离群,说明不同生产厂家原料之间存在差异性,分类结果与HCA结果一致。结合PCA载荷图和自变量主成分累计解释方差表(见表3)可知,峰6为样本识别的主要因素。

表3 自变量主成分累计解释方差Tab 3 Principal component cumulative interpretation variance of independent variables
3 讨论
本试验采用CE法建立了5个生产厂家18批云芝胞内糖肽胶囊(片)、工艺中间产物1和产物2、对照品及两个厂家(A、Q厂家)云芝胞内糖肽原料的指纹图谱,采用ChemPattern软件分析,确定6个共有峰。结果同一原料及其使用同一原料不同厂家的制剂的相似度均大于 0.96,说明云芝胞内糖肽胶囊(片)质量稳定。HCA和PCA可将样品明显聚类和区分,A厂家原料、使用A厂家原料各厂家的制剂和产物2间具有相似性,可聚为一类,而Q厂家原料、对照品和产物1有明显差异,说明不同原料生产厂家之间共有峰存在差异。找到一个差异识别峰(峰6),可作为区分不同来源云芝胞内糖肽的手段。
A厂家原料生产工艺为:菌株Polystictus versicolor,28℃发酵培养40~50 h。发酵完成后,发酵液过滤分为菌丝与培养液两部分。菌丝部分经水煮提取滤液,与培养液滤液合并。合并的滤液经浓缩、醇沉,75℃ 减压干燥、粉碎过筛即得。制剂都是原料直接灌装或者加乙醇湿法制粒的,无辅料干扰。将工艺中菌丝体水提醇沉即得产物1,培养液滤液醇沉即得产物2。Q厂家原料生产工艺与A厂家基本相似,但是在最后没有与培养液滤液合并,因此没有产物2。指纹图谱显示,产物1的1~6号CE特征峰均呈现较高峰,且出现多个额外的色谱峰;产物2几乎没有特征峰检出。结合HCA和PCA可知,产物1因各峰面积显著高于其他样本而离群,对照品、Q厂家原料则因峰6峰面积高而离群。可以初步推测两原料生产厂家的生产工艺不同是造成差异的主要原因。
CE无法对特征峰进行定性,无法确定各特征峰组成,后期可采用CE与质谱联用技术对各未知峰进行定性分析[13-14],确定峰6的组成,针对峰6建立云芝胞内糖肽的质量控制体系,以提高产品的稳定性和一致性。
综上所述,本研究建立的云芝胞内糖肽胶囊(片)CE指纹图谱测定方法,经方法学验证,准确、简捷,具有较好的分析评价能力,可作为区分云芝胞内糖肽和质量评价的依据。

