神经阻滞联合中药热奄包治疗早中期强直性脊柱炎的疗效观察
周芬,杨婵婵,袁泉,陈星
(河南中医药大学第一附属医院,河南 郑州450002)
强直性脊柱炎(ankylosing spondylitis,AS)为骶髂关节、脊柱及其骨骼肌附着点炎症反应性疾病[1]。早中期表现为腰骶疼痛、脊柱晨僵、倦怠乏力,若治疗不及时,出现脊柱强直、畸形、关节融合,畸形肋缘可压迫脏器,危及患者生命。西医主要采用改善血液循环、防止血液凝固、抑制炎症因子、促进病灶的软化和吸收、延缓骨关节耗损等方法治疗,短期疗效尚可,但不良反应发生率高[2],患者常由于剧烈的不良反应无法坚持治疗,导致病情进一步发展。近年来,中医药因疗效稳定,不良反应发生率低,被应用于AS的治疗[3]。2019年1月—2020年8月,我们将神经阻滞联合中药热奄包用于早中期AS肾虚督寒证患者的治疗,取得了理想的效果。现报道如下。
1 资料和方法
1.1 一般资料 将我院收治的90例AS患者,按照随机数字表法随机分为对照组和观察组,每组45例。对照组男38例,女7例;年龄25~50岁,平均(38.26±4.37)岁;病程3.0~5.9个月,平均(4.31±0.51)个月;病情分期:早期11例,中期34例;合并疾病:糖尿病3例,高血压4例;高血脂2例。观察组男36例,女9例;年龄26~50岁,平均(38.71±4.41)岁;病程3.1~6.0个月,平均(4.29±0.47)个月;病情分期:早期13例,中期32例;合并疾病:糖尿病4例,高血压4例;高血脂1例。两组一般资料比较,差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准。
纳入标准:西医诊断符合《强直性脊柱炎/脊柱关节炎患者实践指南》[4];中医辨证符合《强直性脊柱炎家系流行病学调查和中医体质分析》[5];年龄25~50岁,病情为早中期;入组前4周未使用神经阻滞治疗;患者及家属签署知情同意书。排除标准:合并风湿性关节炎、关节肿瘤、严重感染、系统性红斑狼疮患者;合并严重心肝肾功能不全患者;妊娠期及哺乳期患者;对研究所用药物过敏者。
1.2 方法 对照组给予神经阻滞术。参照患者症状结合X线片确定病变区域对应的腰椎棘突,旁开2 cm定为穿刺点。穿刺操作:皮肤局部常规消毒,取7号穿刺针,沿穿刺点垂直刺入2~3 cm,使针触及骨样感。回抽无血及脑脊液后,注射含曲安奈德注射液5 mg(昆明积大制药有限公司,国药准字H53021605)及利多卡因注射液0.2 mg(上海禾丰制药有限公司,国药准字H20023777)混合液3 mL,每周1次。观察组在对照组基础上给予中药热奄包:药物组成:补骨脂、楮实、干姜各25 g,附子、熟地黄、牛膝各20 g,上述中药粉碎后,用蜂蜜调成糊状,摊平,厚度约2 cm,置于50~70℃中药热奄包加热箱中加热30 s,敷涂于患处,每日1次,每次4 h。两组连续治疗4周。
1.3 观察指标(1)临床症状评分:治疗前后分别观察两组巴氏强直性脊柱炎病情活动指数(BASDAI)及,活动度衡量指数(BASMI)[6];中医症状[5]:主症(腰骶冷痛,脊背僵硬不舒,腰膝酸软,畏寒喜暖),根据症状无、轻、重,每项分别计0、2、4分;次症(倦怠乏力,遇寒加重,男性阴囊寒冷/女性白带寒滑,肢末不温,大便清稀),根据症状无、轻、重,每项分别计0、1、2分。(2)炎性因子:采用酶联免疫吸附法检测血清炎性因子[肿瘤坏死因子α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-17(IL-17)],疼痛介质[环氧化酶-2(COX-2)、前列腺素E2(PGE2)、内皮素-1(ET-1)]。(3)并发症:比较两组消化不良、呕吐及皮疹的发生情况。(4)疗效 显效:疼痛消失,日常活动基本恢复正常,疗效指数>70%;有效:疼痛减轻,日常活动明显改善,20%≤疗效指数<70%;无效:未达到有效标准。疗效指数=(治疗前BASDAI积分-治疗后BASDAI积分)/治疗前BASDAI积分×100%。
1.4 统计学处理 采用SPSS20.0软件,计量资料以±s表示,行t检验;计数资料以百分率n(%)表示,行χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较 对照组45例,显效7例,有效30例,无效8例;观察组45例,显效29例,有效15例,无效1例。两组疗效比较,差异有统计学意义(P<0.05)。
2.2 两组患者治疗前后临床症状评分比较 见表1。
2.3 两组患者治疗前后炎性因子水平比较 见表2。
2.4 两组患者治疗前后疼痛介质水平比较 见表3。
2.5 两组并发症发生率比较 对照组45例,出现消化不良2例,呕吐1例,皮疹1例,不良反应发生率8.9%;观察组45例,出现消化不良1例,呕吐2例,不良反应发生率6.7%。两组不良反应发生率比较,差异无统计学意义(P>0.05)。
表1两组患者治疗前后临床症状评分比较(±s,分)

表1两组患者治疗前后临床症状评分比较(±s,分)
两组治疗前BASDAI、BASMI、中医症状积分比较,P>0.05;两组治疗后BASDAI、BASMI、中医症状积分比较,P<0.05。
组别 n BASDAI BASMI 中医证候对照组 治疗前 45 32.59±5.43 29.48±4.28 17.53±3.64治疗后 45 24.64±4.18 24.16±3.63 17.16±3.59观察组 治疗前 45 31.48±5.61 30.27±4.31 17.81±3.67治疗后 45 18.46±3.18 17.32±3.05 6.52±2.05
表2两组患者治疗前后炎性因子水平比较(±s,μg/L)
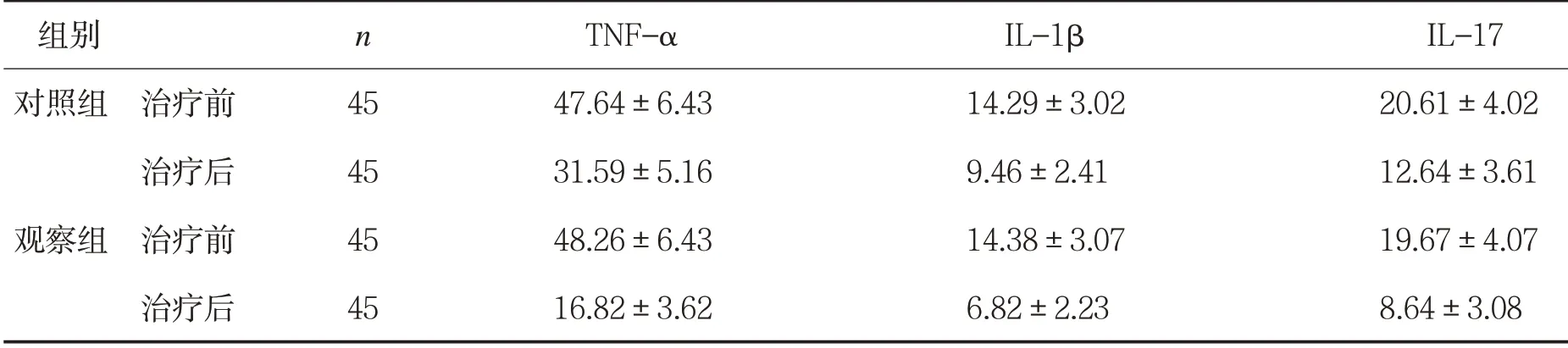
表2两组患者治疗前后炎性因子水平比较(±s,μg/L)
两组治疗前TNF-α、IL-1β、IL-17水平比较,P>0.05;两组治疗后TNF-α、IL-1β、IL-17水平比较,P<0.05。
组别 n TNF-α IL-1β IL-17对照组 治疗前 45 47.64±6.43 14.29±3.02 20.61±4.02治疗后 45 31.59±5.16 9.46±2.41 12.64±3.61观察组 治疗前 45 48.26±6.43 14.38±3.07 19.67±4.07治疗后 45 16.82±3.62 6.82±2.23 8.64±3.08
表3两组患者治疗前后血清疼痛介质水平比较(±s,ng/L)
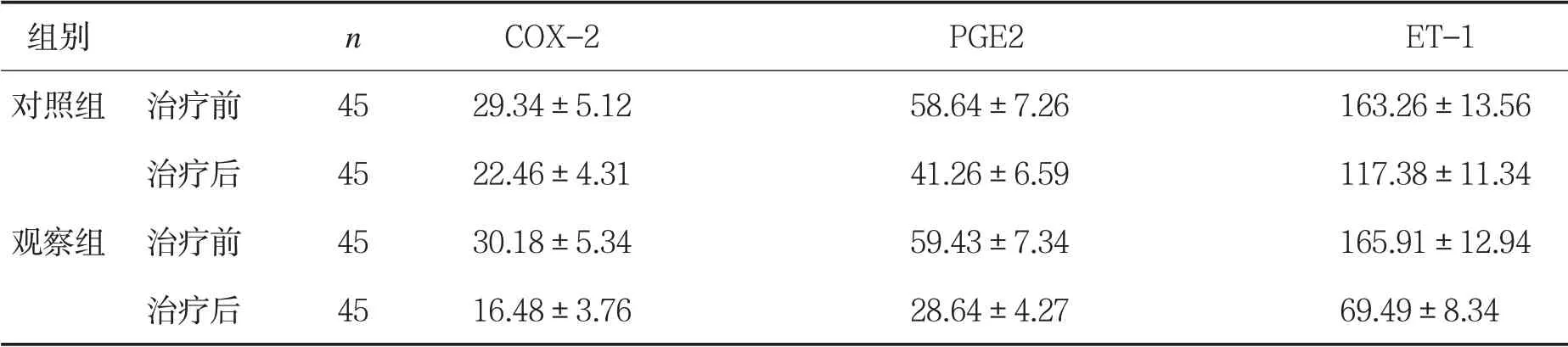
表3两组患者治疗前后血清疼痛介质水平比较(±s,ng/L)
两组治疗前COX-2、PGE2、ET-1水平比较,P>0.05;两组治疗后COX-2、PGE2、ET-1水平比较,P<0.05。
组别 n COX-2 PGE2 ET-1对照组 治疗前 45 29.34±5.12 58.64±7.26 163.26±13.56治疗后 45 22.46±4.31 41.26±6.59 117.38±11.34观察组 治疗前 45 30.18±5.34 59.43±7.34 165.91±12.94治疗后 45 16.48±3.76 28.64±4.27 69.49±8.34
3 讨论
流行病学显示,AS全球发病率为0.18%~0.26%,在我国为0.37%[7]。其发病与遗传因素、炎性反应、免疫调节、内分泌,环境因素有关。西医认为AS主要病理改变为关节组织滑膜的慢性炎症病变、血管翳、关节软骨与骨受损[1]。近年来神经阻滞通过病变区域局部注射,药物直达病灶,生物利用度高,被广泛应用于AS的治疗。中药热奄包中补骨脂温肾助阳,楮实补肾利湿,干姜温中散寒、回阳通脉,附子回阳救逆、补火助阳、散寒止痛,熟地黄益精填髓,牛膝补肝肾、强筋骨、活血通脉,诸药合用散寒强骨,益肾通络。
本文采用BASDA、BASMI和中医证候评价患者的临床症状,观察组患者治疗后临床症状积分降低,提示神经阻滞联合中药热奄包具有减轻早中期AS患者骶骨疼痛、晨僵、提高脊柱活动度等作用。AS的发生及病情进展与炎性反应密切相关,其中TNF-α为机体免疫炎性调节的启动因子,通过调节机体氧自由基酶的产生,诱导中性粒细胞与病原体黏附,干扰病原体核酸合成,当感受炎性刺激时,其合成增加,并可诱导IL-1β分泌[8]。IL-1β可促进间质细胞合成蛋白分解酶,引起关节外软骨降解,同时可刺激TNF-α的分泌,使炎症反应增强。IL-17为T细胞诱导的炎症反应的早期启动因子,其通过增强前炎性细胞活性以放大炎症反应。观察组治疗后TNF-α、IL-1β、IL-17水平明显降低,提示神经阻滞联合中药热奄包可减轻机体炎症反应,从而减轻炎性因子对关节组织的侵蚀,缓解病情,恢复患者关节活动功能。COX-2主要位于核膜中,通过蛋白激酶传递疼痛信号。PGE2通过介导细胞传递信号,诱导基质分解,产生疼痛感,同时促进软骨组织凋亡。ET-1与疼痛感知相关受体结合,将疼痛信号传递给介导细胞,产生疼痛。观察组治疗后血清COX-2、PGE2、ET-1明显降低,提示神经阻滞联合中药热奄包可调节疼痛感知信号,拮抗软骨细胞凋亡,降低患者疼痛感知的作用。
综上所述,神经阻滞联合中药热奄包治疗早中期AS肾虚督寒证,可有效改善患者的临床症状,降低患者的炎症反应和疼痛感且安全性高,值得临床推广应用。

