玫烟色棒束孢NBL-Z8的培养及对桃蚜的侵染力
齐素敏 陈丹丹 李圆圆 冉新炎 韩广泉 陶宁 王丽荣
摘要:通过探索玫烟色棒束孢NBL-Z8的最佳培养条件并测定该菌对桃蚜[Myzus persicae (Sulzer)]的侵染力,以期为筛选出对桃蚜具有高毒力的微生物杀虫剂提供依据。采用单因素分析法测定菌株的最佳培养条件,并采用喷雾法测定菌株NBL-Z8对桃蚜的致病力。结果显示,NBL-Z8菌株的最佳碳源为蔗糖,最佳氮源为蛋白胨,最佳培养条件为温度25 ℃、初始pH值7、转速180 r/min、接种量6%;菌株的室内致病力测定结果表明,当孢子浓度为1×108 CFU/mL 时,对桃蚜的致死中时间(LT50)为3.118 d,接菌7 d时致死中浓度(LC50)为1.367×104 CFU/mL。由研究结果可以看出,玫烟色棒束孢NBL-Z8对桃蚜具有较强的致病力,可作为桃蚜生防制剂开发中的潜力菌株。
关键词:玫烟色棒束孢;液体培养;桃蚜;侵染力测定;生防潜力
中图分类号: S433.39;S182 文献标志码: A 文章编号:1002-1302(2021)10-0082-04
蚜虫类有13科、500余属,目前世界上已知种类有4 700余种,而我国已知的蚜虫种类就有1 000余种[1]。桃蚜(Myzus persicae)是常见的一种蚜虫,该虫以成虫、若虫群集在寄主叶片、花梗和种荚等部位吸食汁液危害寄主,常导致寄主叶片黄化、蜷缩甚至枯萎,并分泌蜜露诱发煤烟病,引起寄主植株品质和产量下降[2-3]。目前,化学防治仍是控制蚜虫危害的主要方法,而频繁地使用高剂量化学杀虫剂,不仅会导致蚜虫对多种农药产生不同程度的抗性[4-7],还会造成蔬菜中的农药残留超标,给农产品安全生产带来隐患。因此,研究和开发能够减少化学杀虫剂用量甚至替代化学杀虫剂的安全、高效的生物防治方法成为桃蚜综合防治的重要途径。
玫烟色棒束孢(Isaria fumosorosea)是一种重要的昆虫病原真菌,该菌地理分布范围广泛,昆虫寄主多样,能寄生在同翅目、鳞翅目、双翅目等8个目40多种昆虫上[8]。大量研究结果表明,玫烟色拟青霉对蚜虫等刺吸式口器害虫具有很强的致病力。曹娜在大田试验中采用1.0×107个/mL玫烟色棒束孢孢子悬浮液喷雾防治棉蚜,第10天时的校正防效可达95.9%[9]。朱丽梅等的研究结果表明,玫烟色棒束孢QH4对桃粉蚜的毒杀效果较好,施药后120 h的死亡率可达100%[10]。邓建华等研究发现,用玫烟色棒束孢孢子悬浮液处理后第10天,烟蚜的感染率为78.5%[11]。孙莉等用108个/mL玫烟色棒束孢孢子悬浮液处理蚜虫,结果显示,试虫在施药后第10天的死亡率可达86.52%[12]。邢培翔等用108个/mL玫烟色棒束孢孢子悬浮液处理梨黄粉蚜,7 d后的校正死亡率为97.24%[13]。綜合以上研究结果可知,玫烟色棒束孢对多种蚜虫具有良好的防治效果。笔者优化了玫烟色棒束孢 NBL-Z8 的液体培养条件并测定该菌对桃蚜成虫的室内毒力,以期筛选出对桃蚜具有高毒力的微生物杀虫剂,为减少化学药剂使用量、缓解昆虫抗药性、实现农业害虫的无公害防治、提高农产品的安全性提供菌种资源。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 玫烟色棒束孢菌株NBL-Z8从山东省泰安市省庄周边土壤中分离纯化所得,该菌株目前保藏于中国普通微生物菌种保藏管理中心,编号为CGMCC19603。
1.1.2 供试虫源 桃蚜采自山东省泰安市泰山区省庄周边白菜叶片,在温度为(25±1) ℃、相对湿度为(80±5)%、光—暗周期为12 h—12 h的条件下,采用无农药及害虫污染的甘蓝饲养,人工饲养多代。取大小一致的健康的无翅成蚜作为试虫。
1.1.3 培养基 马铃薯葡萄糖琼脂(PDA)培养基配方:200 g马铃薯(去皮),20 g葡萄糖,20 g 琼脂,1 000 mL蒸馏水;PDB(不加琼脂的PDA)培养基配方:200 g马铃薯(去皮),20 g葡萄糖,1 000 mL蒸馏水。
1.2 最适培养条件筛选的单因素试验
以A培养基(25.0 g/L葡萄糖,6.0 g/L蛋白胨,2.0 g/L K2HPO4,1.0 g/L KH2PO4,0.5 g/L MgSO4)作为对照,采用单因素试验法分别研究玫烟色棒束孢在以不同碳源(葡萄糖、蔗糖、甘露醇、柠檬酸钠和糖蜜)、氮源(蛋白胨、硝酸钾、酵母膏、氯化铵和牛肉浸膏)为主要成分的培养基中及不同发酵初始pH值(3、5、7、9、11)、发酵温度(15、20、25、28、30 ℃)、转速(150、170、180、200、220 r/min)和接种量(3%、4%、5%、6%、7%)条件下的发酵效果。发酵条件同原始条件,即初始pH值为7.0,接种量为6%,接种液浓度为108 CFU/mL,培养温度为25 ℃,摇床转速为180 r/min,培养48 h后采用血细胞计数板测定菌株的孢子浓度。
1.3 孢子悬浮液的配制
将保存在4 ℃斜面上的供试菌株活化后,接种到PDA培养基平板上,于25 ℃培养10 d后,用含有0.05%吐温-80的无菌水冲洗孢子,然后用血球计数板测定悬浮液中的孢子数,计算其孢子浓度,再用含有0.05%吐温-80的无菌水逐步稀释,获得浓度为1×104~1×108 CFU/mL的孢子悬浮液。
1.4 室内毒力测定
试验于2020年3月在山东省泰安市植物微生态制剂重点实验室进行。配制水琼脂培养基(1.5 g琼脂,100 mL蒸馏水),每个培养皿10~15 mL,待冷却后,剪取大小一致的甘蓝叶片(圆形,直径为 4 cm),将叶背朝上紧贴在培养基表面使其固定,再将无翅成蚜转移到培养皿中的叶片上,每个培养皿中放20头。 将上述浓度为1×104~1×108 CFU/mL的孢子悬浮液用喷雾器进行喷雾,每个培养皿定量喷雾1次。用含有0.05%吐温-80的无菌水作为对照(CK),每次处理用20头蚜虫,每个处理重复3次。自然风干后加盖,在(25±1) ℃、相对湿度为(80±5)%、光—暗周期为12 h—12 h的条件下逐日观察并记录病死虫数至蚜虫死亡,及时挑出死亡虫体并于灭菌培养皿中保湿培养,3~5 d后镜检死虫,观察是否产生菌丝或孢子,以确定是否是因为有效感染玫烟色棒束孢菌而导致的死亡。
1.5 数据统计与分析
用Excel 2010、SPSS 19.0对数据进行处理,并用Duncans新复极差法进行显著性分析和Probit回归分析。
2 结果与分析
2.1 单因素筛选最适培养条件
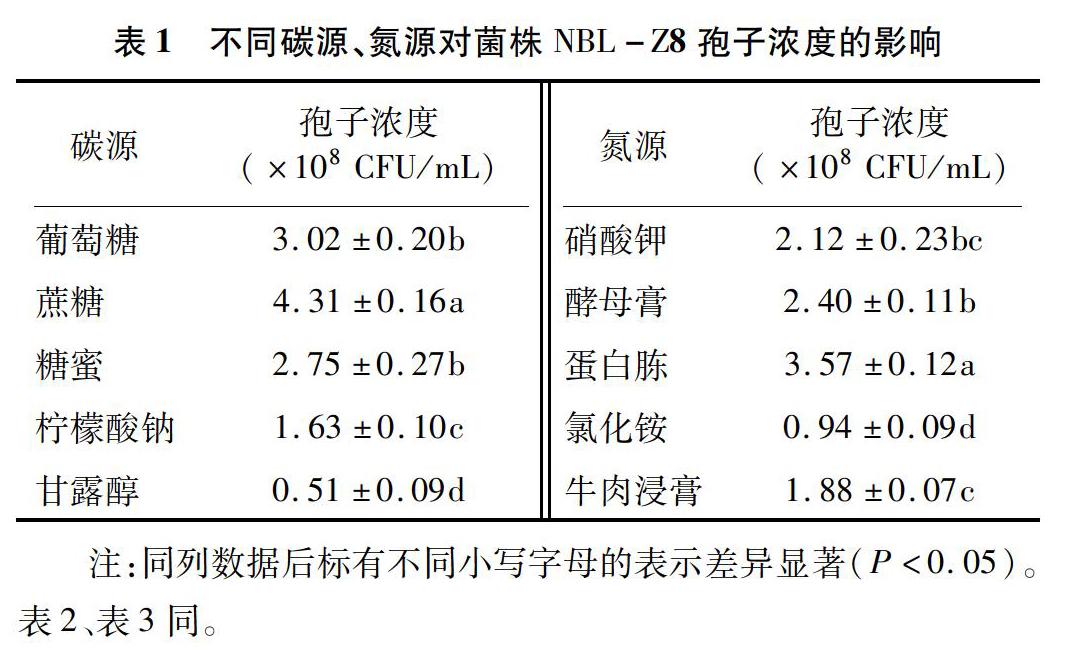
2.1.1 单因素试验法筛选最适培养基 基础培养基选择A培养基(25.0 g/L葡萄糖,6.0 g/L蛋白胨,2.0 g/L K2HPO4,1.0 g/L KH2PO4,0.5 g/L MgSO4),测定不同碳源、氮源对菌株NBL-Z8孢子浓度的影响。由表1可以看出,分别以蔗糖为碳源、蛋白胨为氮源时,菌株NBL-Z8可以获得最大孢子浓度,分别为4.31×108、3.57×108 CFU/mL,且显著高于其他处理。因此,确定将蔗糖、蛋白胨为最优发酵培养基成分。
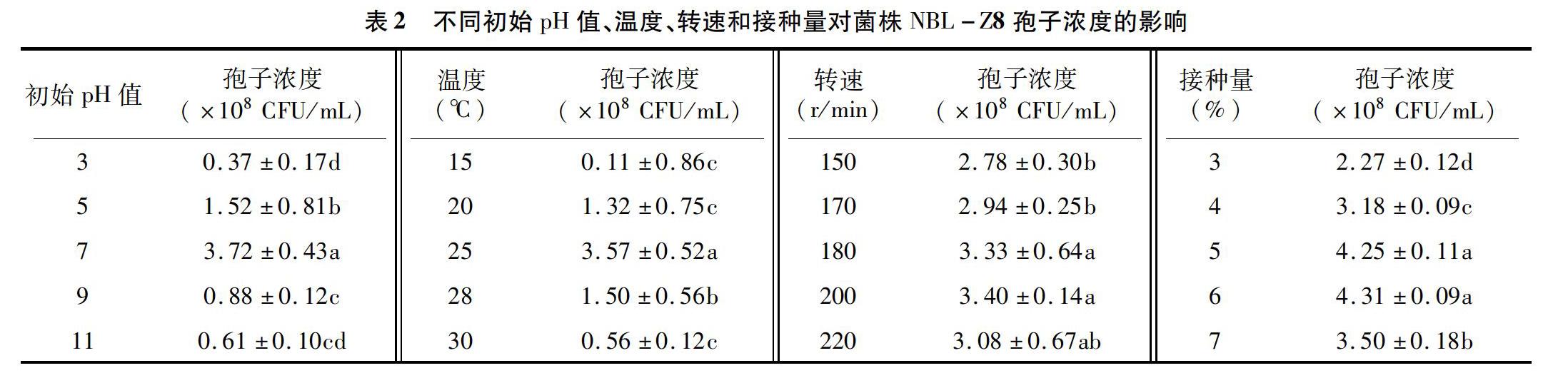
2.1.2 单因素试验法筛选最适发酵条件 如表2所示,当初始pH值为7时,菌株NBL-Z8的孢子浓度显著高于其他处理,可见过酸或过碱的培养基均会影响菌株的产孢性能。菌株NBL-Z8在温度为 15~30 ℃范围内的产孢性能良好,温度过高或过低均不利于该菌产孢,菌株在温度为25 ℃时的孢子浓度最大。当摇床转速为200 r/min时,孢子浓度最大,但菌株在转速超过200 r/min时,摇瓶中的菌株存在起泡、菌丝结球的现象,但是考虑到转速为200、180 r/min时,菌株的孢子浓度不存在显著性差异,因此所以选择180 r/min为最佳转速。当菌株 NBL-Z8的接种量在3%~6%之间时,其菌体孢子浓度随着接种量的增大而增加,当接种量为6%时,孢子浓度最大,为4.31×108 CFU/mL。
2.2 菌株对桃蚜的室内毒力
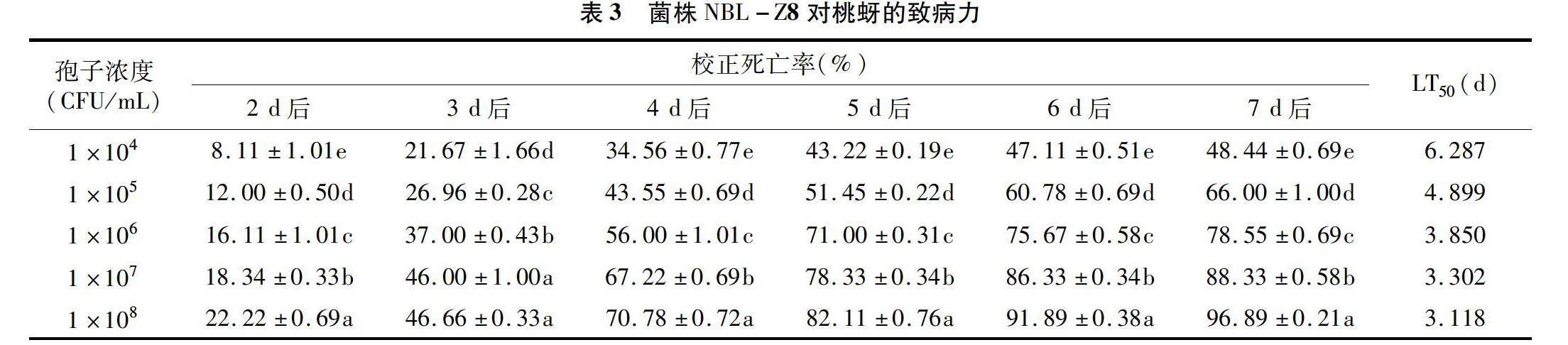
表3中结果显示,不同浓度的玫烟色棒束孢NBL-Z8孢子悬浮液对桃蚜的校正死亡率从处理 2 d 后(1 d后的校正死亡率为0%)起开始出现显著性差异(P<0.05)。1×104 CFU/mL浓度的孢子悬浮液对桃蚜的致死率较低,处理7 d后,校正死亡率仅为48.44%,致死中时间(LT50)为6.287 d;1×107 CFU/mL浓度的孢子悬浮液对桃蚜的致死率较高,处理7 d后时,校正死亡率可以达到88.33%,LT50为3.302 d;浓度为1×108 CFU/mL的孢子悬浮液处理组的效果最好,处理6 d后时,校正死亡率可达90%以上,LT50为3.118 d。
由表4中的数据可以看出,处理2~7 d后,不同处理下该菌对桃蚜的致死中浓度(LC50)分别为1.675×1013、1.038×108、3.653×105、3.584×104、1.660×104、1.367×104 CFU/mL。
上述結果表明,菌株NBL-Z8对桃蚜的致死率随着孢子悬浮液浓度的增加而明显提高,并且随着处理时间的延长而增大,但是在不同浓度处理下,桃蚜的死亡率基本在4 d后达到1个峰值,随后致死率的增加趋势变缓,说明玫烟色棒束孢NBL-Z8菌株可以在较短时间内造成桃蚜成虫死亡。
3 讨论
研究发现,孢子浓度是筛选优良菌株的重要指标,而菌株培养条件对菌种孢子浓度及毒力均有较大影响[14]。因此探索菌株NBL-Z8的最佳产孢条件,对于利用该菌防治害虫具有重要意义。张仙红等研究发现,葡萄糖是玫烟色拟青霉液体培养的最适碳源,蛋白胨是最适氮源[15]。曹娜研究发现,萨氏液体培养基(SDY培养基)是最佳发酵培养基[9]。本研究发现,菌株NBL-Z8的最佳碳源、氮源分别为蔗糖、蛋白胨,这与田晶的研究结果[16]一致。本研究发现,该菌株的最佳产孢条件为温度25 ℃、初始pH值7、转速180 r/min、接种量6%、培养时间48 h。在接下来的试验中,笔者将进一步探究各营养成分对玫烟色棒束孢NBL-Z8生长和生殖的影响。
用微生物或其代谢产物防治农业害虫具有选择性强、对农作物和自然环境安全、不伤害天敌、不易产生抗性等优点,已经逐渐引起人们的重视。研究发现,白僵菌、绿僵菌[17-19]、蜡蚧轮枝菌[20-21]、达旦提狄克氏菌[22-23]等生防菌株对蚜虫均具有良好的防治效果。据报道,玫烟色棒束孢对桃蚜具有较高的致病力[24-26]。本研究发现,菌株NBL-Z8在孢子浓度为1×107、1×108 CFU/mL时对桃蚜的致死率较高,处理7 d后,试虫的校正死亡率分别为88.33%、96.89%,LT50分别为3.302、3.118 d,LC50为1.367×104 CFU/mL,该致死中浓度低于陈巍巍等测得的8.51×105 CFU/mL[24]、张仙红等测得的8.71×106 CFU/mL[25]及孟豪等研究得出的1.20×105 CFU/mL[26]。以上结果表明,玫烟色棒束孢 NBL-Z8对桃蚜的生物防治潜力较大。此外,大量研究表明,玫烟色棒束孢对烟粉虱[27-29]、柑橘木虱[30-31]、小菜蛾[32]和朱砂叶螨[33]等多种害虫具有较强的侵染力,是一种性能优良的昆虫病原真菌。
目前国外已经筛选出具有高致病力的菌株,自20世纪60年代以来,已经有10种玫烟色棒束孢制剂产品获得注册登记[34],而国内尚未出现商品化的玫烟色棒束孢制剂。因此,今后的工作重点是进行商品化研究,包括生产发酵技术、大田施用技术及田间评价体系等,可以为害虫的综合防治提供产品和技术支持。
4 结论
玫烟色棒束孢NBL-Z8对桃蚜具有较强的室内毒力,可作为桃蚜生防制剂开发的潜力菌株。
参考文献:
[1]von Dohlen C D,Rowe C A,Heie O E,et al. A test of morphological hypotheses for tribal and subtribal relationships of Aphidinae (Insecta:Hemiptera:Aphididae) using DNA sequences[J]. Molecular Phylogenetics and Evolution,2006,38(2):316-329.
[2]郑竹胜,邢 鲲,赵 飞,等. 甘蓝蚜虫田间防治研究[J]. 中国果菜,2015,35(4):59-61.
[3]闰彦萍,王海荣,韩巨才. 山西甘蓝蚜对7种杀虫剂的抗性监测[J]. 安徽农业科学,2006,34(18):4684-4685.
[4]Nauen R,Elbert A. European monitoring of resistance to insecticides in Myzus persicae and Aphis gossypii (Hemiptera:Aphididae) with special reference to imidacloprid[J]. Bulletin of Entomological Research,2003,93(1):47.
[5]武銀玉,曹亚萍,杨秀丽,等. 麦蚜抗药性现状及抗性治理研究进展[J]. 小麦研究,2017,38(2):1-8.
[6]苗艳香. 蔬菜蚜虫抗药性现状及治理策略[J]. 热带农业工程,2019,43(1):68-70.
[7]Srigiriraju L,Semtner P J,Bloomquist J R. Monitoring for imidacloprid resistance in the tobacco-adapted form of the green peach aphid,Myzus persicae (Sulzer) (Hemiptera:Aphididae) in the eastern United States[J]. Pest Management Science,2010,66(6):676-685.
[8]Zimmermann G. The entomopathogenic fungi Isaria farinosa (formerly Paecilomyces farinosus) and the Isaria fumosorosea species complex (formerly Paecilomyces fumosoroseus):biology,ecology and use in biological control[J]. Biocontrol Science and Technology,2008,18(9):865-901.
[9]曹 娜. 玫烟色棒束孢发酵条件及对刺吸式口器害虫控制潜力研究[D]. 合肥:安徽农业大学,2018.
[10]朱丽梅,严 慧,方慧子,等. 玫烟色棒束孢QH4对蚜虫和烟粉虱杀虫活性的研究[J]. 金陵科技学院学报,2018,34(1):84-87.
[11]邓建华,吴兴富,庄 辉,等. 两种拟青霉对烟蚜感染作用试验[J]. 烟草科技,2005(3):46-48.
[12]孙 莉,张艳璇,赵玲玲,等. 利用胡瓜新小绥螨携带玫烟色拟青霉菌兼防茄子蚜虫和叶螨[J]. 中国农学通报,2015,31(20):91-96.
[13]邢培翔,刁红亮,韩志慧,等. 烟色棒束孢IF-1106对2种果树蚜虫的致病力[J]. 山西农业科学,2019,47(11):2029-2033,2045.
[14]李农昌,樊美珍,李春如,等. 白僵菌有关培养条件及其与毒力关系的研究[J]. 安徽农业大学学报,1996,23(3):254-259.
[15]张仙红,张 奂,张未仲. 玫烟色拟青霉最适液体培养条件的研究[J]. 微生物学杂志,2006,26(6):15-18.
[16]田 晶. 玫烟色棒束孢生物学特性及对烟粉虱致病作用研究[D]. 晋中:山西农业大学,2014.
[17]Meyling N V,Eilenberg J. Ecology of the entomopathogenic fungi Beanveria bassiana and Metarhnm anisopliae in temperate agroecosystems:potential for conservation biological control[J]. Biological Control,2007,43(2):145-155.
[18]Shan L T,Feng M G. Evaluation of the biocontrol potential of various Metarhiziu misolates against green peach aphid Myzus persicac (Homoptcra:Aphididae)[J]. Pest Management Scicnce,2010,66(6):669-675.
[19]Poprawski T J,Parker P E,Tsai J H,et al. Laboratory and field evalua tion of hyphomycete insect pathogenic fungi for control of brown citrus aphid (Homoptera:Aphididae)[J]. Environmental Entomology,1999,28(2):315-321.
[20]Diaz B M,Oggcrin M,Lastra C C L,et al. Characterization and virulence of Lecanicillium lecanii against diffetent aphid species[J]. BioControl,2009,54(6):825-835.
[21]刘 浩,张 龙,张宗山. 蜡蚧轮枝菌对枸杞蚜虫的室内毒力和常用药剂敏感性测定[J]. 中国蔬菜,2012(4):87-90.
[22]Grenier A M,Duport G,Pages S,et al . The phytopathogen Diekeya dadantii (Frwinia chrysanthcmi 3937) is a pathogen of the pea aphid[J]. Applied and Environmental Microbiology,2006,72(3):1956-1965.
[23]Costeeharcyre D,Balmand S,Condemine G,et al. Dickeya dadantii,aplant pathogenic bacterium producing Cyt-like entomotoxins,causes septicemia in the pea aphid Acyrthosiphon pisum[J]. PLoS One,2012,7(1):e30702.
[24]陈巍巍,冯光明. 四株玫烟色拟青霉作为桃蚜微生物防治因子的潜力评价[J]. 浙江大学学报(农业与生命科学版),1999,25(6):563-568.
[25]张仙红,嵇能焕. 玫烟色拟青霉菌株的毒力测定[J]. 山西农业大学学报,2006,26(1):24-26.
[26]孟 豪,田 晶,付淑慧,等. 玫烟色棒束孢与球孢白僵菌对桃蚜致病力对比[J]. 植物保护学报,2014,41(6):717-722.
[27]周鹏飞,张 婧,张博文,等. 玫烟色棒束孢的遗传地理差异及对B型烟粉虱的致病性[J]. 华南农业大学学报,2018,39(3):60-64.
[28]Flores-Macias A,Diaz M P,Ramos-Lopez M A,et al. Study of the entomopathogenic fungus Isaria fumosorosea as microbiological control of the white fly Bemicia tabaci[J]. Interciencia,2013,38(7):523-527.
[29]Tian J,Diao H L,Li L,Hao C,et al. Pathogenicity of Isaria fumosorosea to Bemisia tabaci,with some observations on the fungal infection process and host immune response[J]. Journal of Invertebrate Pathology,2015,130:147-153.
[30]Hoy M,Singh R. Evaluations of a novel isolate of Isaria fumosorosea for control of the Asian citrus psyllid,Diaphorina citri (Hemiptera:Psyllidae)[J]. Florida Entomologist,2010,93:24-32.
[31]代曉彦,任素丽,周雅婷,等. 黄龙病媒介昆虫柑橘木虱生物防治新进展[J]. 中国生物防治学报,2014,30(3):414-419.
[32]吕利华,何余容,武亚敬,等. 玫烟色拟青霉对小菜蛾致病力的时间-剂量-死亡率模型模拟[J]. 昆虫学报,2007,50(6):567-573.
[33]Shi W B,Feng M G. Ovicidal activity of two fungal pathogens (Hyphomycetes) against Tetranychus cinnabarinus (Acarina:Tetranichidae)[J]. Chinese Science Bulletin,2004,49(3):263-267.
[34]de Faria M R,Wraight S P. Mycoinsecticides and Mycoacaricides:a comprehensive list with worldwide coverage and international classification of formulation types[J]. Biological Control,2007,43(3):237-256.

