S1P-STAT3 信号通路在炎症性疾病中的作用及其机制研究进展*
方 翔 王 民 陈 涛 姚 静
(济宁医学院 山东济宁 272067)
炎症是机体对抗损伤性因子而发生的一系列防御反应,是损伤和抗损伤的统一过程。近年来,炎症性疾病发病率逐年提高,例如,自身免疫性甲状腺炎、类风湿性关节炎等。某些炎症还会发展为癌症,例如,炎症性肠病诱发结直肠癌、肥胖相关炎症诱发乳腺癌等。在这些炎症性疾病的发生、发展进程中,S1P-STAT3 信号通路发挥了重要作用。本文系统阐述了S1P-STAT3 通路在多种炎症性疾病的发生、发展中的作用,并深入研究了S1P 与STAT3 的相互关系,为临床抗炎新药的研发和应用提供理论基础与用药指导。
1 S1P-STAT3 信号通路
1- 磷酸鞘氨醇(sphingosine -1-phosphate,S1P)是一种脂质信号,由鞘氨醇激酶1(sphingosine kinase 1,SphK1)和鞘氨醇激酶2(sphingosine kinase 2,SphK2)合成,2 种酶分别被17 号和19 号染色体编码,在心血管生理学和病理学、炎症和肿瘤等方面发挥作用。鞘氨醇可调节细胞生长、血管张力、内皮功能和完整性,以及淋巴细胞的迁移,其信号转导的失衡与高血压、内皮功能障碍、心血管疾病、炎症及肿瘤的发生、发展密切相关[1]。S1P 在血液和淋巴液中的含量比较丰富,但在组织液中的含量很低,这就形成了组织液和血液、淋巴液之间的S1P 浓度梯度。这种浓度梯度导致了T 淋巴细胞、B 淋巴细胞和树突状细胞等的迁移[2]。S1P 受体(S1P receptor,S1PR)耦联G 蛋白亚基,有5 个亚型,分别为S1PR1~S1PR5[3]。S1PR1~S1PR3 主要表达于心血管系统,S1PR4 表达于淋巴系统,S1PR5 在免疫和神经系统中广泛表达。S1P 浓度还受SphK 和S1P 裂解酶的调控,通过增加或减弱相应酶的活性,调节血液中S1P的浓度,从而达到研究和治疗疾病的目的[4]。有研究表明,S1P 还可通过与细胞表面的S1PR 结合,使受体内陷,诱导淋巴细胞的分化、募集和归巢,从而达到免疫调控的目的[2]。S1P 信号通路还参与多种自身免疫病的发生、发展,例如,类风湿性关节炎和自身免疫性甲状腺炎等。
许多鞘脂调节子(主要包括神经酰胺和S1P)的功能具有十分重要的意义,与癌症的发生和发展都有密切的联系[5]。S1P 主要是通过细胞表面的S1PR 参与肿瘤的发生和发展、细胞的生长分化和血管的生成。其中,S1PR1 通过下游分子STAT3 介导肿瘤的发生,尤其是炎症相关肿瘤[6]。S1P 和SphK1 在结肠癌、黑色素瘤、膀胱癌、淋巴瘤、卵巢癌、乳腺癌、前列腺癌等多种恶性肿瘤中转录和蛋白的表达均呈高水平状态[7-12]。SphK1也被报道可促进肿瘤细胞的侵袭和转移[13-15]。在一些肿瘤中还发现SphK1 的表达水平与肿瘤恶性程度、预后等临床病理特征[16]及肿瘤分级有关。SphK1 的mRNA 在结肠癌中表达水平较癌旁结肠粘膜明显升高,这些结果表明,SphK1 可能参与结肠癌发生,并可作为肿瘤恶性程度分级的指标[17]。
转录激活蛋白(signal transducer and activator of transcription ,STAT)是一种能与DNA 结合的独特蛋白质家族。STAT 属于核内转录因子,但在静息细胞中,STAT 只存在于细胞质中。近年来受到研究者广泛重视的STAT3,在细胞因子和受体的相互作用中充当载体,保持信号在细胞内的传递。它可被多种细胞因子和生长因子[包括干扰素、白介素(interleukin,IL)-5、IL-6、表皮生长因子和肝细胞生长因子等]刺激而介导多种基因的表达,在促进炎症发生、细胞生长及肿瘤发生方面具有重要作用。编码STAT3 的基因位于17 号染色体,其存在许多特殊序列——DNA 连接区、酪氨酸同源体(src homology2,SH2)结构区、羧基末端转录激活结构域等,这些序列均与其功能密切相关。细胞因子与细胞表面受体结合后,通过一系列反应导致STAT3 磷酸化,与SH2 结构区形成二聚体进入细胞核,诱导靶基因的转录,也可调控生长因子的活化。此外,STAT3 被激活后可产生负反馈作用,抑制STAT3 的过度表达,阻断肿瘤细胞的过度增殖,增强机体对肿瘤细胞的免疫能力。
近年来,大量文献报道S1P-STAT 信号通路在各种疾病中的作用。S1P-STAT1 通路可通过促进干扰素的产生,增强免疫反应并参与巨噬细胞的活化[18-19]。S1P-STAT5 参与白血病的发生、发展[20],S1P-STAT6 参与巨噬细胞的抗凋亡作用[21]。其中,研究最系统全面地是S1P-STAT3 通路在各领域的作用,涉及到心血管疾病、各种类型的炎症和癌症。本文通过分析和研究S1P-STAT3 信号通路在炎症中的相互作用,深入阐述炎症发生的机制,为炎症的治疗带来新的突破点,并为临床用药及抗炎新型药物的开发奠定理论基础,从而使药物达到更好的抗炎作用。
2 S1P-STAT3 信号通路与炎症
2.1 炎症性肠病相关癌症(colitis-associated cancer,CAC) 炎症性肠病是结直肠癌的重要危险因素。CAC 患者的STAT3 水平高于普通的结直肠癌患者,可能是由于STAT3 的表达与炎症密切相关[7]。S1P 通过一个自分泌信号环活化STAT3。SphK1 上调S1P,作用于突变的肠上皮细胞,诱导核因子kappa B(nuclear factor-kappa B,NF-κB)和STAT3 的信号级联反应发生,促进肿瘤的发生和发展。最新文献报道,S1P 与S1PR1 结合可上调肿瘤转移靶部位细胞的STAT3 水平,在机体远处组织造成易于接受转移肿瘤的环境,从而促进肿瘤细胞的侵袭转移[22]。S1P-S1PR1-STAT3 信号通路在肿瘤细胞和炎症细胞之间处于一个相互作用的恶性循环,对于肿瘤细胞的侵袭转移具有非常重要的作用。
此外,SphK1 和S1P 也参与肿瘤坏死因子(tumor necrosis factor,TNF)-α 激活NF-κB 的过程。NF-κB 增强趋化因子的表达,招募骨髓来源的免疫细胞,免疫细胞分泌IL-6、TNF-α 等炎症因子,维持肿瘤细胞的炎症环境,促进肿瘤的生长、侵袭和转移[23]。 IL-6 激活炎症肠上皮细胞STAT3,STAT3 调节与炎症发生和细胞增殖有关的基因,上调S1PR1 的表达,促进S1P 通路的表达[24-27]。
目前研究发现,免疫抑制药物芬戈莫德(FTY720)作为S1P 的抑制剂,可干扰SphK1-S1PS1PR1 信号轴以消除NF-κB /IL-6/STAT3 的级联反应从而抑制结、直肠癌的发展[28]。因此,靶向S1P 信号和代谢可能是治疗炎症性肠病(inflammatory bowel disease,IBD)的一种新策略,通过阻断从炎症到癌变的进展以降低结肠癌风险。另有研究表明,哺乳动物来源的食品,也可由正常人体细胞产生S1P 鞘脂代谢物,可能会导致IBD和CAC,而从食物中提取的膳食鞘脂类,例如,大豆和植物型鞘脂(sphingadienes)可预防这些疾病。即饮食中的鞘脂促进或抑制CAC 取决于其转化为S1P 的能力,在炎症性肠病的治疗中引入新的靶点,有望成为抑制CAC 的新手段[29]。
2.2 自身免疫性甲状腺炎(autoimmune thyroiditis,AIT) 研究表明,自身免疫性桥本甲状腺炎患者和自发性自身免疫性甲状腺炎(spontaneous autoimmune thyroiditis,SAT)小鼠模型中,SphK1/S1P/S1PR1 通路表达异常[30]。S1P 能通过S1PR1 及其下游信号通路激活小鼠CD4+T 细胞中的STAT3。FTY 720 阻断S1PR1 可降低SAT 小鼠甲状腺炎和甲状腺肿瘤的发生率和严重程度,且呈时间依赖性。SAT 小鼠体内STAT3 相关和炎症相关的细胞(Th1、Th17 和卵泡T 辅助细胞等)数量升高,FTY720 给药后,相应细胞数量减少,STAT3 相应下调,STAT3 下游炎症细胞因子也相应降低。综上所述,阻断SphK1-S1P-S1PR1 信号通路可减轻AIT 的严重程度,这也为AIT 的治疗提供了新的治疗靶点。
2.3 肥胖相关炎症 肥胖患者的特点是胰岛素分泌增加和促炎细胞因子的分泌增加。肥胖后期的脂肪巨噬细胞甚至可通过原位增殖,维持脂肪组织内的炎症水平,并持续释放多种炎症因子。由此可见,肥胖是一种全身系统性的慢性代谢炎症状态。研究表明,肥胖乳腺癌患者血清S1P 水平明显高于非肥胖患者。高脂饮食可上调SphK1 水平,从而提高血浆S1P 水平,还可提高原发肿瘤和肿瘤间质本身的S1P 水平,为肿瘤细胞向远处转移提供了生存环境[31]。这些发现证明鞘脂传递信号可能是预防肥胖相关乳腺癌转移的有效靶点。SphK1/S1P/S1PR1 轴与肥胖、慢性炎症、乳腺癌发生、发展密切相关。
2.4 自身免疫性脑脊髓炎(experimental allergic encephalomyelitis,EAE) 经外周转染LV-S1PR1可改善实验性EAE 的发生几率和严重程度,其防治作用机制可能与上调外周S1PR1 的表达,降低外周S1P 水平,使T 细胞迁移受阻有关。另有文献报道,磷酸化缺陷型S1PR1[S1PR1(S5A)]的小鼠最终发展为严重的、以Th17 细胞分化为主的自身免疫性脑脊髓炎。髓系细胞S1PR1 水平直接影响神经炎症的严重程度,髓系-S1PR1 信号在中枢神经系统自身免疫过程中具有重要作用[32]。S1PR1 介导的Th17 极化不是T 细胞固有的效应,而是依赖于骨髓细胞中持续的S1PR1 信号。利用S1PR1(S5A)小鼠建立的EAE 模型中活化的S1PR1 可增强骨髓细胞的抗原递呈功能。树突状细胞、单核细胞和巨噬细胞/小胶质细胞中STAT3相继发生磷酸化。促炎单核细胞通过调节IL-6的表达促进Th17 细胞的分化和神经炎症的发生、发展。髓系细胞S1PR1 和STAT3 水平在神经-免疫系统中共同作用,影响神经炎症的严重程度,也为神经炎症的治疗提供了新的靶点。
2.5 肠肌层的局部炎症反应 在大鼠肠道平滑肌(rat intestinal smooth muscle,RISM)细胞中,S1P促进肠肌层的局部炎症反应,这也是术后肠梗阻形成的重要因素[33]。以往研究报道,S1P 在TNF-α和NF-κB 的激活中起关键作用,而外源性S1P 诱导早期生长反应-1(early growth response-1,Egr-1)的产生,而Egr-1 主要参与S1P 诱导的IL-1 和环氧化酶2 的表达,在术后肠梗阻中发挥促炎作用;S1P 也通过激活STAT3 介导IL-6 的表达[33]。综上所述,Egr-1 和STAT 3 协同介导RISM 细胞中S1P诱导的炎症反应,为术后肠梗阻的治疗提供了新的靶点。
2.6 类风湿关节炎(rheumatoid arthritis,RA) RA是一种自身免疫炎症疾病,主要表现为免疫系统攻击滑膜关节组织。在成骨细胞中,S1P 通过S1PR1 和JAK/STAT3 信号通路促进IL-1β 的表达[34]。IL-1β 是RA 发生、发展的关键炎症因子。在成骨细胞中,高表达的S1P 促进IL-1β 的表达,这种促进作用可被小干扰RNA(miRNA)通过拮抗S1PR1 所降低。此外,S1P 也可增强JAK 和STAT3 的分子级联反应,从而促进IL-1β 的表达。2.7 心脏炎症、肥厚和心肌重构 S1P 介导心血管系统的多种病理生理反应。心脏SphK1/S1P/S1PR1 信号通路在心肌细胞促炎症反应调控中起重要作用,而SphK2 是病理性S1P 信号的内源性抑制因子。通过抑制SphK1 活性或增强SphK2 活性靶向SphK1/S1P/S1PR1 轴可能是治疗缺血性心力衰竭的潜在策略。心肌梗死模型小鼠体内,S1P 显著升高,并伴有SphK1 和S1PR1 表达显著上调,如果抑制S1P 的产生或使用S1PR1 功能性拮抗剂会改善慢性心脏炎症,进而改善心肌梗死后的心脏重构和功能障碍,相反,干扰S1P 的降解,会加重疾病的进展[35]。SphK1/S1P/S1PR1 信号轴与持续的NF-κB/STAT3 激活、慢性心脏炎症和心肌梗死后心力衰竭进展有关[36]。S1PR1 在心脏成纤维细胞中促进心脏重构,血管紧张素II、血管紧张素Ⅰ型受体和IL-6/STAT3 信号通路参与此过程:在过表达S1PR1 的转基因小鼠12 周龄时出现双心室肥大,24 周龄时出现弥漫性间质纤维化;转基因小鼠中分离出的成纤维细胞显示血管紧张素II 的生成增强,反之刺激了IL-6 的释放,而使用IL-6 抗体后会抑制心脏中的STAT3 磷酸化,防止心肌肥厚的发生[37-38]。在心肌缺血再灌注损伤中STAT3 仍发挥一定作用,S1P 通过STAT3 通路减轻线粒体功能障碍,从而保护心肌细胞免受缺血再灌注损伤[39-40]。
3 总结与展望
本文以结肠炎、神经炎、自身免疫性甲状腺炎、类风湿性关节炎等为例,阐述了S1P-STAT3通路对于炎症发生、发展的重要性,它们相互促进与激活,共同作用于炎症反应的各个方面,已成为治疗各类炎症的新靶点。S1P-STAT3 通路在不同的炎症中有各自不同的机制(表1),但仍具有相似之处,如图1 所示:SphK1-S1P-S1PR1 信号通路在炎症反应中能引起TNF-α 和IL-6 的分泌增加,进而引起NF-κB 和STAT3 的水平增加,STAT3 作为重要的炎症因子,促进了炎症的发生。反之,STAT3 也可促进S1PR1 表达增加,NF-κB 又可促进炎症因子分泌,从而加重炎症的严重程度,形成环状信号通路。尽管如此,对于S1PSTAT3 的研究探索还未止步,S1P 和STAT3 信号通路对于人体各类炎症的作用还需要深入研究。其中,对于中枢神经系统自身免疫和神经炎症研究较少,还需大量研究以强化证明S1P-STAT3 信号通路在中枢神经系统中的双重作用。
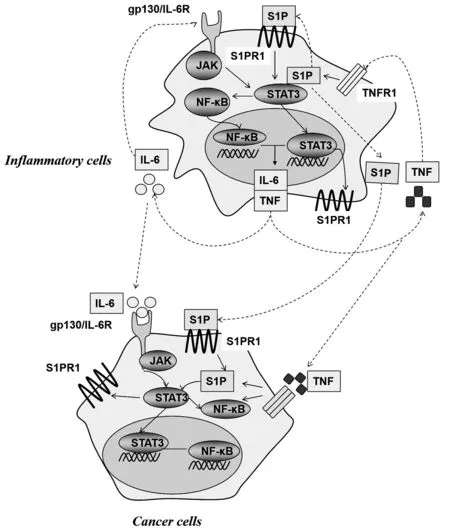
图1 S1P-STAT3 信号通路在炎症与肿瘤中的作用

表1 S1P-STAT3 信号通路与炎症
S1P-STAT3 信号通路在炎症发生和发展、肿瘤侵袭转移、心肌肥厚等方面的作用和机制已逐渐被发现。如何真正以该通路为靶点治疗应用于临床,使患者受益,是当今最重要的问题。在炎症治疗方面,期望开发出更多的靶向S1PSTAT3 信号通路的特异性抗炎药物,减少S1P 的产生,减少因STAT3 造成的炎症反应和肿瘤的远处转移,从而达到更准确更有效地治疗病人的目的。此外,以该通路作为肿瘤治疗的靶点,可阻止炎症向癌症的恶性转化,减少并发症的发生,从而治愈更多病人。

