广西家蚕核型多角体病毒gp64基因遗传多态性及进化分析
陈慧珠 龙羽燕 屈达才 徐开遵 朱方容 陈朝蓉 梁湘
摘要:【目的】了解广西家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)gp64基因的遗传多态性及进化特点,掌握BmNPV在广西蚕区的流行和传播情况,揭示BmNPV种群维持遗传多样性的模式与机制。【方法】对20株广西BmNPV毒株的gp64基因进行测序分析,根据gp64基因构建遗传进化树及绘制毒株流行分布图,并比对不同毒株的致病力。【结果】广西BmNPV毒株gp64基因开放阅读框(ORF)长度存在3种情况(1590、1593和1599 bp),分别编码含529、530和532个氨基酸残基的GP64蛋白。20株广西BmNPV毒株与标准参考T3株的gp64基因核苷酸序列同源性在97.6%~99.2%,其推导氨基酸序列同源性在96.4%~99.6%。在广西BmNPV毒株gp64基因近N端分别出现GCG缺失和GCGCCG/GTGCCG插入突变,发生核苷酸替换突变的位点数目在13~28个,但大部分为同义替换,对编码蛋白的三聚体空间构象无明显影响。广西BmNPV毒株gp64基因编码蛋白的N-糖基化位点为3~4个;除GXZS株外,所有毒株的O-糖基化位点均为2个,且预测位点一致。基于gp64基因构建的遗传进化树显示,几乎所有的广西BmNPV毒株聚类于Clade I分群,其又被分为2个主要亚群(Sub-clade I和Sub-clade II);而几乎所有的国外参考毒株聚类于Clade II分群。广西蚕区的BmNPV流行分布呈集中性与分散性并存;GXUA株对四龄和五龄起蚕的半数致死量(LD50)分别为3.3和3.1,而GXZZ株对四龄和五龄起蚕的LD50分别为5.5和5.3,说明GP64蛋白糖基化位点较少的BmNPV毒株表现出较弱的致病力。【结论】广西BmNPV毒株gp64基因在进化过程中其信号肽区出现明显变异,发生同义突变的频率较高,形成较独立的进化分群,毒株間的致病力差异可能与GP64蛋白糖基化位点不同有关,说明广西BmNPV毒株具有不同的基因型和表型,在一定程度上维持了BmNPV野生群体的遗传多样性。
关键词: 家蚕核型多角体病毒;gp64基因;遗传多态性;进化分析;致病力
中图分类号: S884.51 文献标志码: A 文章编号:2095-1191(2021)02-0448-09
Abstract:【Objective】This research was aimed to understand the genetic polymorphism and evolving characteristic of the gp64 genes derived from Bombyx mori nucleopolyhedrovirus(BmNPV) in Guangxi, study the condition of Bm-NPV epidemic and spread in Guangxi sericultural regions, andreveal the patterns and mechanisms of maintaining genetic diversity in BmNPV population. 【Method】The gp64 gene of 20 Guangxi BmNPV strains were sequenced and analyzed. The phylogenetic tree was constructed according to gp64 gene and the epidemic distribution map was drawn. The pathogenicity of different strains was also compared. 【Result】The open reading frame(ORF) length of gp64 genes of these Guangxi BmNPV strains showed three conditions(1590,1593 and 1599 bp), which encoded GP64 proteins of 529, 530 and 532 amino acid residues, respectively. The homologies of nucleotide sequence in gp64 genes of 20 Guangxi BmNPV strains was 97.6%-99.2% and the homologies of deduced amino acid sequence was 96.4%-99.6% compared with standard reference T3 strain. The mutations of GCG deletion and GC/TGCCG insertion were found near the N terminal of gp64 gene of Guangxi BmNPV strains. The site mutation numbers of nucleotide substitution were between 13 to 28, but most of them were synonymous substitutions which had little effect on the trimeric spatial conformation of the coded protein. There were three to four N-glycosylation sites in decoded amino acids of gp64 genes of Guangxi BmNPV strains. There were two O-glycosylation sites in all strains except for GXZSand the predicted sites were all the same. Almost all the Guangxi BmNPV strains were clustered as CladeⅠwhich was further separated into two major groups(Sub-clade I and Sub-clade II) in the phylogenetic tree constructed based on gp64 gene, while almost all the reference strains from abroad were clustered as Clade Ⅱ. The BmNPV epidemic distribution showed coexistence of concentration and scatteration. The median lethal dose(LD50) of GXUA strains for 4thand 5th instar silkworm were 3.3 and 3.1, while LD50 of GXUA strains for 4thand 5th instar silkworm were 5.5 and 5.3. It indicated that BmNPV strain with less glycosylation site in GP64 protein glycosylation site showed weak pathogenicity. 【Conclusion】A major mutation in signal peptide of gp64 genes of Guangxi BmNPV strains occurs, frequency of synonymous mutation is high and a relatively independent cluster is formed during the evolution. The diverse pathogenicity of BmNPV strains may be related to the differentiation of GP64 protein glycosyla-tion sites. It shows that there are diverse genotypes and phenotypes among the Guangxi BmNPV strains. These diversities sustain the genetic diversity in BmNPV wild population to a certain extent.
Key words: Bombyx mori nucleopolyhedrovirus(BmNPV); gp64 gene; genetic polymorphism; evolution analysis; pathogenicity
Foundation item: Guangxi Natural Science Foundation(2017GXNSFBA198158)
0 引言
【研究意义】家蚕血液型脓病是茧丝生产上最常见且危害最严重的一种病毒性传染病(王霞等,2020),为农业农村部公布的三类动物疫病(中华人民共和国农业部公告 第1125号)。家蚕血液型脓病传染性强、病死率高,目前尚无有效的治疗方法,生产上主要依靠化学消毒剂降低环境中的病原含量进行防控,但消毒剂的性状及稳定性通常会影响其消毒效果,因此一旦暴发流行家蚕血液型脓病即对桑蚕生产造成巨大经济损失(鲁兴萌,2012)。家蚕血液型脓病由家蚕核型多角体病毒(Bombyx mori nucleopolyhedrovirus,BmNPV)感染引起,BmNPV组装形成的多角体(Polyhedral inclusion body,PIB)蛋白晶体结构耐腐烂、干燥、紫外线照射和极端气候等不良环境因素,病毒粒子能在多角体的保护下长期保持感染活力(陈朝蓉等,2017)。病毒多角体在自然环境中富集,极易对桑叶和蚕作环境造成污染,尤其在交通、贸易等人为因素及风雨、掠食动物等自然因素的作用下,还能导致病毒远距离传播(Fuxa,2004),极大制约了蚕桑产业的可持续发展。此外,当前国内的蚕区呈现建设区域化,生产规模集约化,生产季节集中,蚕种流通及蚕茧贸易频繁,为BmNPV的传播和流行创造了有利条件。gp64基因是BmNPV的重要结构蛋白基因,在病毒感染早期和晚期均能转录表达(夏定国等,2007;陈朝蓉等,2017),因此,加强对BmNPV流行毒株gp64基因进行遗传多态性及进化分析,不仅能为其分子致病机理的研究提供参考,还有利于揭示同一宿主杆状病毒种群致病力差异的分子机理。【前人研究进展】BmNPV是杆状病毒科(Baculoviridae)α杆状病毒属(α-NPV)的重要成员,是除苜蓿银纹夜蛾核型多角体病毒(Auto-grapha californica multiple nucleopolyhedrovirus,AcMNPV)外,研究昆虫杆状病毒的最常用模型(柳林,2018)。囊膜糖蛋白(GP64)是杆状病毒出芽型(BV)病毒粒子特有且占比较高的囊膜成分,位于病毒粒子一端,以同源三聚体的形式构成表面嵌突。GP64蛋白是杆状病毒从宿主细胞质膜出芽并最终形成成熟病毒粒子及病毒在组织细胞间传播必不可少的要素(Monsma et al.,1996),其介导病毒与细胞受体的识别和吸附,以及低pH条件下病毒囊膜与细胞内吞体膜的融合(Zhou and Blissard,2008)。GP64蛋白还参与决定杆状病毒的宿主域。Katou等(2006)研究发现,当BmNPV的gp64基因被AcMNPV的gp64基因替代后,即能顺利进入非受纳细胞Sf9的细胞核,并产生具有感染活性的子代病毒。此外,GP64蛋白与病毒的致病性密切相关,是病毒重要的毒力因子。AcMNPV的GP64蛋白位于胞外区靠近跨膜域,有4个氨基酸残基对病毒的出芽和感染力起重要作用(Li and Blissard,2009),而将GP64蛋白的合成时间延迟能有效降低AcMNPV经口感染棉铃虫的毒力(Washburn et al.,2003)。因此,以gp64基因为靶标研发BmNPV防治药物具有极大潜能。已有研究证实,以gp64基因为RNA干扰靶标,能有效抑制BmNPV在细胞中的基因表达和复制增殖,而降低家蚕死亡率(夏定国等,2007;Jiang et al.,2013;Zheng et al.,2019)。Li等(2011)研究表明,以表面重组表达BmNPV GP64蛋白的枯草杆菌芽孢免疫家蚕,家蚕机体能对BmNPV入侵产生一定抵抗力。Kato等(2012)通过构建展示表达人肾素受体的重组BmNPV,并证实重组BmNPV对肾素的结合具有亲和性,可用于分析受体和配体间的相互作用。Deo等(2014)利用BmNPV构建展示表达肿瘤靶标单链可变片段的病毒样颗粒,为肿瘤的特异性免疫治疗提供了新思路。【本研究切入点】宿主昆虫对病原基因型的选择是野外杆状病毒种群保持遗传多样性的一种机制(Hitchman et al.,2007)。家蚕在生长和繁殖过程中受人工干预的程度远高于自然界其他昆虫种类,且抗家蚕血液型脓病品种的选育和推广养殖、净化蚕作环境病原使用的消毒剂及小蚕共育+大蚕分户的饲养模式等均会对BmNPV的进化和传播产生影响,也意味着BmNPV种群所面对的选择压力较其他杆状病毒种群更大,而有可能导致更快的进化速度及衍生特殊的进化模式。GP64蛋白与BmNPV的致病性密切相关,但至今鲜见广西家蚕核型多角体病毒gp64基因遗传多态性及进化分析的研究报道。【拟解决的关键问题】对20株广西BmNPV毒株的gp64基因进行测序分析,根据gp64基因构建遗传进化树及绘制毒株流行分布图,并比对不同毒株的致病力,了解gp64基因遗传多态性及其进化特点,旨在掌握BmNPV在广西蚕区的流行和传播情况,以揭示BmNPV种群维持遗传多样性的模式与机制。
1 材料与方法
1. 1 试验材料
供试家蚕品种为两广二号的四龄和五龄起蚕。20株BmNPV毒株中有18株是从广西不同桑蚕产区采集获得,采集地点及gp64基因GenBank登录号分别为GXCW(梧州苍梧,MT165666)、GXHJ(河池环江,MT165668)、GXJX(百色靖西,MT165670)、GXLeY(百色乐业,MT165671)、GXLuoC2(河池罗城,MT165672)、GXMS2(梧州蒙山,MT165673)、GXNN(南宁,MT165674)、GXTY(百色田阳,MT165675)、GXWX(来宾武宣,MT165677)、GXXD1(钦州小董,MT165678)、GXYZ2(河池宜州,MT165682)、GXYF(桂林永福,MT165680)、GXYJ(百色右江,MT165681)、GXZP(贺州昭平,MT165683)、GXZS(贺州钟山,MT165684)、GXXZ(来宾象州,MT165679)、GXHP(北海合浦,MT165669)和GXFM(玉林福綿,MT165 667);GXZZ(MT165685)和GXUA(MT165676)株则分别由广西蚕业技术推广总站和亚热带农业生物资源保护与利用国家重点实验室保存提供。
1. 2 BmNPV多角体提纯及镜检
将采集的血液型脓病病蚕样本分别置于密封瓶子中常温腐熟,加入超纯水稀释后,以3层纱布过滤去除不腐烂的蚕体组织。滤液进行400和4000 r/min各10 min的反复差速离心,待多角体沉淀呈灰白色时以纯水重悬;然后将病毒多角体悬液置于20%~60%连续密度梯度的蔗糖溶液上,4000 r/min离心15 min,收集含多角体条带的蔗糖溶液再离心,重悬多角体沉淀后加入等量丙酮溶液,离心收集沉淀以除去附着于多角体表面的脂类杂质。多角体沉淀经37 ℃烘干成粉状,以备扫描电镜观察使用。
1. 3 引物设计与合成
根据BmNPV标准参考株(日本T3株)基因序列信息,采用Primer 5.0设计gp64基因的特异性引物,gp64-F:5'-GCCAAATAGCGGTCGGGTAT-3'(101450~101469 nt),gp64-R:5'-CGCTTGTGGTAT GAGAAACGAAC-3'(99679~99701 nt),预计扩增片段长度1791 bp,包含gp64基因的完整开放阅读框(ORF)。特异性扩增引物委托深圳华大基因股份有限公司合成。
1. 4 gp64基因克隆及测序
取BmNPV多角体悬液,加入碱性溶液(0.20 mol/L Na2CO3+0.32 mol/L NaCl)进行裂解,以释放内部的病毒粒子,10000 r/min离心1 min后取上清液,用1 mol/L Tris-HCl调整pH至7.0。加入10% SDS和蛋白酶K,55 ℃作用1 h,使用等体积的苯酚—氯仿—异戊醇混合液(25∶24∶1)抽提病毒DNA。PCR反应体系及扩增程序参照陈朝蓉等(2017)的方法,以58 ℃为最佳退火温度。将清晰、无非特异性扩增且与预期相符的目的条带切下,使用DNA纯化回收试剂盒进行回收纯化。将目的基因连接至pMD18-T载体,阳性克隆送至深圳华大基因股份有限公司测序,并使用MegAlign和SeqMan进行序列拼接。
1. 5 遗传多态性及进化分析
以BmNPV日本T3株的gp64基因为标准参考,不同地域来源的BmNPV毒株为同一种群参考,亲缘关系相近的同属异种核型多角体病毒(NPV)为种群外参考,包括AcMNPV、薄荷灰夜蛾NPV(RoMNPV)和野桑蚕NPV(BomaNPV)。使用MegAlign中的ClustalW进行序列比对,并以MEGA 5.0的Kimura 2-parameter模式构建系统发育进化树,Bootstrap重复设为1000。分别通过NetNGlyc 1.0 Server和NetOGlyc 4.0 Server预测蛋白编码序列可能存在的N-糖基化位点和O-糖基化位点;以SWISS-MODEL在线建模预测编码蛋白三级结构;根据系统发育进化树的分群,对广西BmNPV毒株的流行分布地点进行标识。
1. 6 BmNPV毒株毒力测定
将GXZZ和GXUA株分别接种至五龄起蚕进行复壮增殖,提纯病毒多角体并以血球计数板计数,然后配制成浓度约109 PIBs/mL的病毒原液,取2 mL置于18 mL纯水中进行10倍梯度稀释,共配制10个梯度。各稀释样品4000 r/min离心10 min,弃上清液,仅留少量重悬多角体沉淀。将稀释样品分别均匀涂抹在2张适熟偏嫩的桑叶表面(10 cm×10 cm),稍晾干后给四龄和五龄起蚕饷食,每个稀释梯度添食30头家蚕,设2个组重复,待食尽再添新的桑叶,确保病毒被完全摄食,对照组桑叶涂抹纯水。统计发生血液型脓病的病死家蚕及死笼茧数目,采用Reed-Muench法计算半数致死量(LD50)。
2 结果与分析
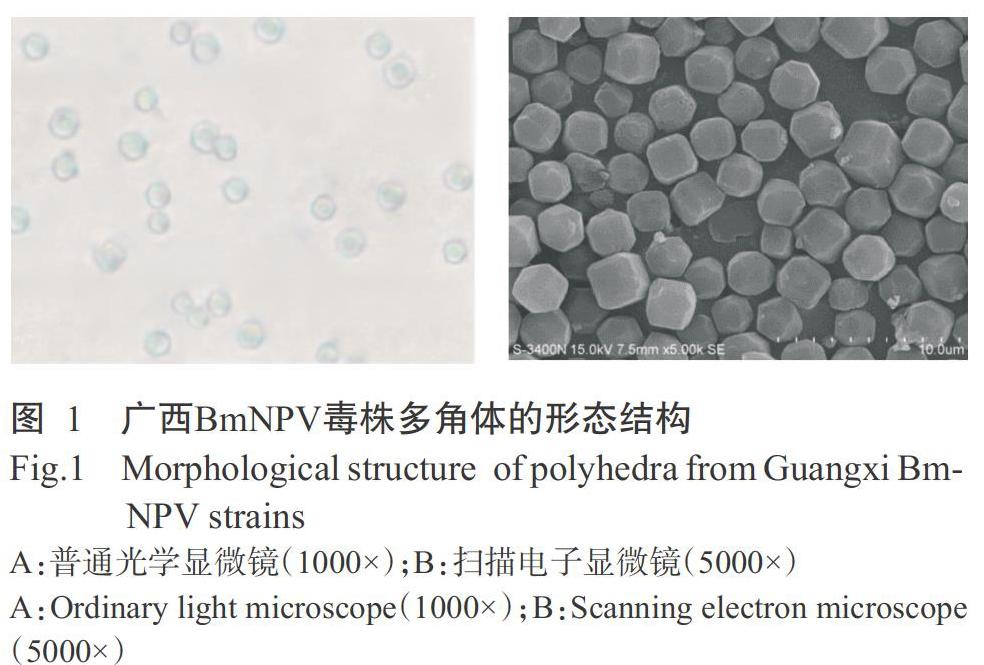
2. 1 广西BmNPV毒株多角体的形态结构
在普通光學显微镜下观察,广西BmNPV毒株多角体外观呈多角形,大小不等,表面有较强的折光性,呈暗蓝色(图1-A);在扫描电子显微镜下观察发现多角体呈近似球形或方形的多面体,个体差异显著,大型多角体的体积是小型多角体的2~3倍,且多面体的构成面存在数量和形状上的差异(图1-B),进一步说明野生BmNPV多角体结构存在不均质性。
2. 2 广西BmNPV毒株gp64基因遗传多态性
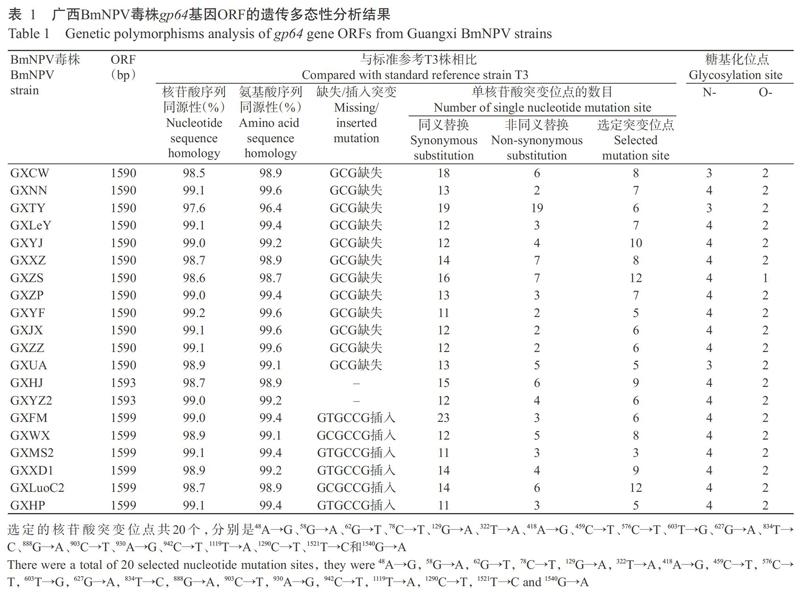
广西BmNPV毒株gp64基因ORF长度存在3种情况(1590、1593和1599 bp),分别编码含529、530和532个氨基酸残基的GP64蛋白。其中,GXHJ和GXYZ2株为1593 bp,与标准参考T3株相同;GXNN、GXJX、GXYF、GXZP、GXZS、GXXZ、GXYJ、GXLeY、GXCW、GXTY、GXZZ和GXUA等12株毒株为1590 bp,均缺失第94~96位编码丙氨酸的GCG密码子;GXFM、GXHP、GXLuoC2、GXXD1、GXMS2和GXWX等6株毒株为1599 bp,则在第97~102位出现6个核苷酸插入,GXLuoC2和GXWX株为GCGCCG插入,编码丙氨酸和脯氨酸,其余4株毒株为GTGCCG插入(表1),编码缬氨酸和脯氨酸,故推测此处为1个高变位点,允许突变的程度较大。
20株广西BmNPV毒株与标准参考T3株的gp64基因核苷酸序列同源性在97.6%~99.2%,其推导氨基酸序列同源性在96.4%~99.6%(表1)。其中,GXJX株与GXZZ株的gp64基因核苷酸序列完全一致;而GXYF、GXJX、GXNN和GXZZ等4株毒株的gp64基因推导氨基酸序列完全一致,GXFM、GXHP和GXMS2等3株毒株的gp64基因推导氨基酸序列也完全一致。广西BmNPV毒株发生核苷酸替换突变的位点数目为13~28个,除GXTY株外,各毒株的同义替换位点数目为非同义替换位点的2~7倍,说明广西BmNPV野生群体gp64基因发生点突变频率较高,但大部分变异并未改变氨基酸编码。其中,有20个位点的单核苷酸突变在广西BmNPV毒株gp64基因中较常见,但在广西BmNPV毒株中出现的数目和分布情况各不相同。根据gp64基因遗传多态性分析结果可知,不同广西BmNPV毒株gp64基因的编码长度和突变程度存在明显差异,说明从广西不同蚕区采集的BmNPV毒株可能来源于同一祖先病毒株,但在不同地理环境及经不等传代后,表现出进化的程度各不相同。
采用NetNGlyc 1.0 Server和NetOGlyc 4.0 Server对20株广西BmNPV毒株及标准参考T3株的gp64基因推导氨基酸序列进行N-糖基化位点和O-糖基化位点预测,结果显示:标准参考T3株有4个N-糖基化位点和2个O-糖基化位点,广西BmNPV毒株的N-糖基化位点为3~4个(表1),部分毒株的预测位点也存在差异,如GXTY株为第5、175和213位,而GXUA株为第5、175和442位;除GXZS株外,其他广西BmNPV毒株的O-糖基化位点均为2个,且预测位点一致。以SWISS-MODEL对广西BmNPV毒株GP64蛋白序列进行同源建模,发现GP64蛋白三级结构皆为空间构型相似的同源三聚体。可见,gp64基因N端多核苷酸的插入或缺失突变,以及其他位点的单核苷酸突变尚未对编码蛋白的空间构象产生明显影响。
2. 3 广西BmNPV毒株gp64基因遗传进化树
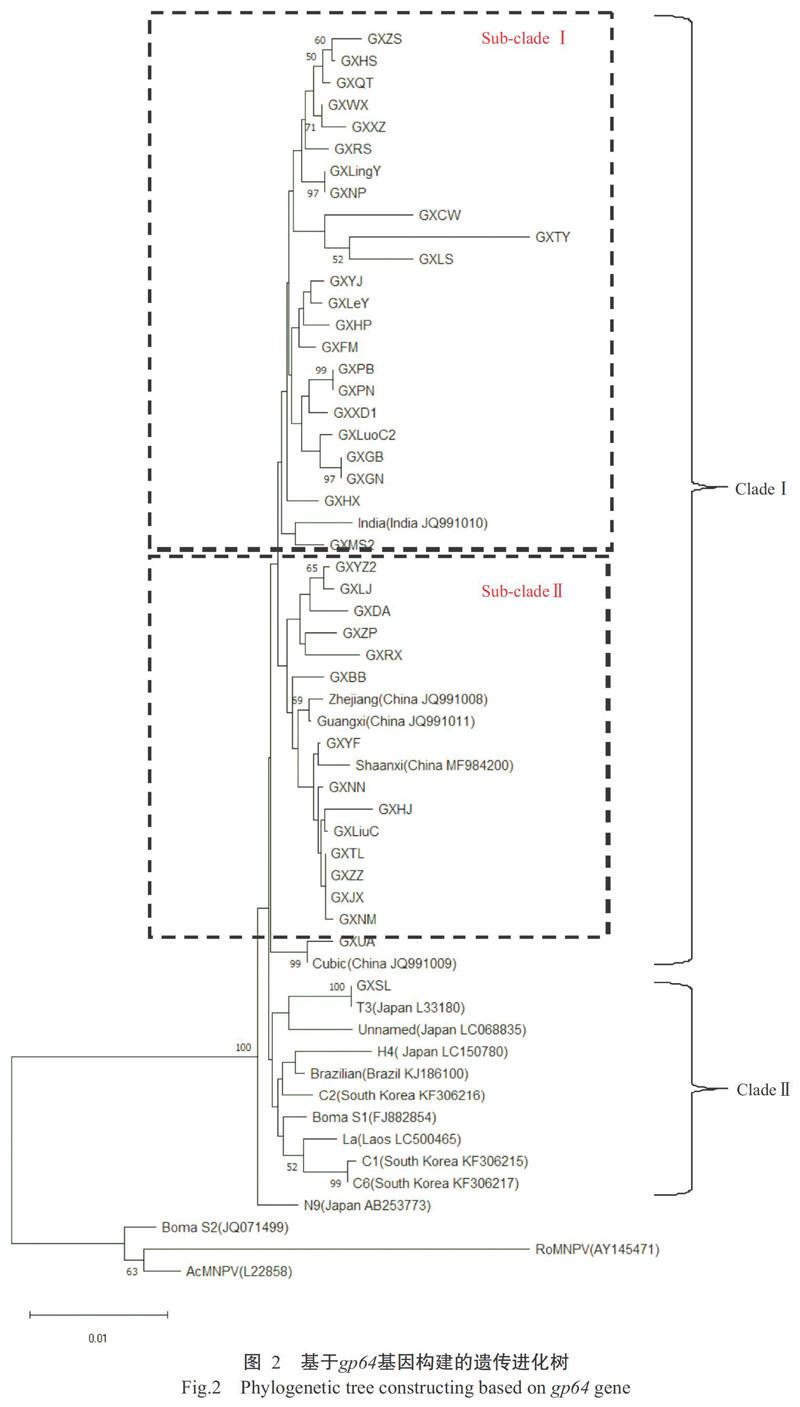
以GenBank已公布的14株国内外BmNPV毒株为群内参考,以AcMNPV、RoMNPV及BomaNPV(S1和S2)为群外参考,将本研究测序的20株广西Bm-NPV毒株与本课题组前期测序的18株广西BmNPV毒株(陈朝蓉等,2017),基于gp64基因构建遗传进化树。结果(图2)显示,所有BmNPV毒株位于同一大群中,而群外参考毒株中除BomaS1外,其余毒株均位于另一小群,说明gp64基因在种系发育上存在较大的进化距离。在BmNPV进化群中,除参考毒株N9外,其他BmNPV毒株被分成两大群类(Clade I和Clade II)。几乎所有的广西BmNPV毒株聚类于Clade I,且又被分为2个主要亚群(Sub-clade I和Sub-clade II),其中GXUA株与参考毒株Cubic的遗传关系最近,被单独聚为一支。除参考毒株India外,Sub-clade I中全部为广西BmNPV毒株,其他广西BmNPV毒株和国内参考毒株则位于Sub-clade II。几乎所有的国外参考毒株聚类于Clade II,广西BmNPV毒株中仅GXSL株被归类在该群类,是由于其gp64基因核苷酸序列与标准参考T3株完全一致(陈朝蓉等,2017)。可见,广西BmNPV毒株的进化程度与国外参考毒株明显不同,与国内参考毒株也存在一定差异。
2. 4 广西BmNPV毒株的流行分布情况
根据gp64基因的遗传进化树Sub-clade I和Sub-clade II分群情况,绘制广西BmNPV毒株的流行分布图。结果(图3)显示,Sub-clade I毒株主要分布在广西中南部和西部地区,Sub-clade II毒株则主要分布在广西中北部地区,流行区域既呈集中连片,也有分散个体。在广西河池、柳州和来宾地区2个亚群毒株的流行呈交织分布,而在广西贵港和百色地区主要流行Sub-clade I毒株。
2. 5 广西BmNPV毒株的致病力比较
以GXZZ株和GXUA株分别接种四龄和五龄起蚕,计算血液型脓病的病死率及毒株对各龄蚕的LD50。结果(图4)发现,在相同的病毒多角体稀释梯度下,GXUA株的平均死亡率均低于GXZZ株,且出现死亡的最高稀释倍数小于GXZZ株。GXUA株对四龄和五龄起蚕的LD50分别为3.3和3.1,而GXZZ株对四龄和五龄起蚕的LD50分别为5.5和5.3,前者较后者低2个数量级,二者对四龄蚕的LD50均高于五龄起蚕。说明GXUA株对家蚕的致病力较GXZZ株弱,但二者对四龄和五龄起蚕的致病力相差不明显。
3 讨论
BmNPV标准参考T3株的gp64基因ORF编码530个氨基酸残基,起止位点为99864~101436 nt,与AcMNPV的gp64基因核苷酸序列同源性在95.0%以上(Gomi et al.,1999)。在BmNPV和AcMNPV的gp64基因ORF中潜在2个能成为翻译起始位点的框架,且这2个起始密码子相距54 nt(Rahman and Gopinathan,2003)。广西BmNPV毒株gp64基因近N端的GCG缺失及GCGCCG/GTGCCG插入突变,均位于第2个翻译起始框架内,对应AcMNPV的gp64基因信号肽区,且突变氨基酸呈疏水性,碱基突变对编码蛋白的三聚体空间构象未产生显著影响,故推测这些突变发生在BmNPV的gp64基因信号肽区,即与GP64蛋白基因其他功能区相比,gp64基因信号肽区在BmNPV进化过程中的保守性较低。
与AcMNPV不同,BmNPV的GP64蛋白信号肽长38 aa,在BmN和Bm5细胞中完整的GP64信號肽可将报告基因(eGFP)定位于细胞质膜,而不完整的GP64信号肽均无此项功能;在Sf9细胞中完整的GP64信号肽也将eGFP基因定位于细胞质膜,但部分缺失的BmNPV GP64信号肽也具有此功能,说明GP64信号肽具有宿主特异性(柳林,2018)。另有研究结果显示,在BmNPV和AcMNPV的GP64蛋白序列中分别存在4和3个胆固醇识别位点,其区别在于BmNPV的GP64信号肽内含有1个胆固醇识别位点(1~13 aa),将该位点中保守的酪氨酸突变为丙氨酸后,对重组BmNPV的感染性和致病力均无影响,但报告基因的表达有所增强(南文斌,2018)。BmNPV的GP64信号肽在引导成熟蛋白跨膜定位后未被切割,可能是其信号肽内的胆固醇识别位点与宿主胆固醇发生相互作用,且BmNPV的GP64蛋白加工分泌及介导入侵细胞途径可能与AcMNPV的GP64蛋白有所不同(梁飞,2016;柳林,2018)。本研究结果表明,所有广西BmNPV毒株及其他参考毒株的GP64信号肽胆固醇识别位点均非常保守,但GP64信号肽末端疏水性氨基酸的缺失或插入是否对信号肽酶切割产生影响尚有待进一步探究。杆状病毒具有严格的宿主域,病毒关键蛋白的信号肽在进化过程中可能已发生种属特异性变异,BmNPV的宿主域远比AcMNPV窄,是否与携带胆固醇识别位点的GP64信号肽发挥限制作用有关也需进一步验证。
杆状病毒进化与宿主昆虫进化并行,遵循宿主依赖性进化原则,宿主的抗病毒防御反应可能是其主要驱动因素之一(Nagamine and Sako,2016)。杆状病毒的核心基因在进化过程中非常保守,基于核心基因构建的杆状病毒系统发育进化树显示其聚类分群与宿主昆虫的分类基本一致(Herniou and Jehle,2007;覃吕高等,2013)。在同一杆状病毒种群中,核心基因的进化也相当保守,对广西BmNPV毒株种群核心基因polh序列的分析结果显示大部分毒株的polh基因核苷酸序列同源性大于99.9%,发生突变的位点很少(Liang et al.,2013)。可见,核心基因可能更适用于不同杆状病毒种群的宏观进化分析,但在微观进化过程中无法全面反映进化事件发生的具体信息,因此对非核心基因的进化分析显得尤为重要。本研究结果表明,与标准参考T3株相比,发生变异的广西BmNPV毒株gp64基因核苷酸序列同源性为97.6%~99.2%,在基于gp64基因构建的遗传进化树中,广西BmNPV毒株主要被分为两大群类(Clade I和Clade II)。而本课题组前期研究发现,广西BmNPV毒株的微管相关蛋白p10基因核苷酸序列同源性在98.1%~99.5%,根据p10基因构建的遗传进化树将广西BmNPV毒株分为三大群类(Liang et al.,2013;陈朝蓉等,2017)。尽管基于不同基因的遗传进化分析结果存在差异,但从BmNPV的群类分布结果来看均能有效反映出集中分布的特点及其传播规律,鉴于gp64基因是BmNPV非常重要的致病性相关基因,故推测根据gp64基因构建的遗传进化树更具代表性。
广西BmNPV毒株的gp64基因突变较频繁,但大部分变异并未改变氨基酸编码,仅在信号肽序列上存在差异,而导致其进化与其他参考BmNPV毒株保持一定距离。究其原因除了与当地的气候环境有关外,还可能与当地饲养的家蚕品种存在一定关联。Xu等(2013)以不同来源的BmNPV、BomaNPV和AcMNPV为研究对象,基于基因组序列构建遗传进化树,结果显示除广西和浙江2个地理分离BmNPV毒株被归为同一分支外,其他地理分离毒株均单独聚类为一分支,表明地理分离毒株间的基因型差异可能与地理来源有关。本研究基于gp64基因构建遗传进化树,结果显示,几乎所有的广西BmNPV毒株聚类于Clade I,而几乎所有的国外参考毒株聚类于Clade II,进一步证实BmNPV的基因进化与地理来源相关,且与基于基因组构建遗传进化树的进化分群结果(Xu et al.,2013)基本一致。
BmNPV的GP64蛋白糖基化修饰被抑制,其诱导的膜融合活性降低,具有传染性的出芽型病毒粒子产量减少(Rahman and Gopinathan,2003)。Jarvis等(1998)研究表明,当GP64蛋白第198、355、385和426位的N-糖基化位点单独或共同发生突变时,AcMNPV产生感染性子代病毒的水平明显低于野生型,且突变型出芽型病毒粒子的受体结合能力受损,感染扩散的速度变慢。在本研究中,GXUA株GP64蛋白的N-糖基化位点比GXZZ株少1个,其对家蚕的致病力也较GXZZ株弱,推测是由于糖基化位点改变而影响GP64蛋白的折叠及构象,进而影响病毒的复制增殖,导致其致病力减弱。广西的蚕桑主产区多为老蚕区,分布区域集中,病原种类繁多且经年积累。广西蚕区的BmNPV流行分布呈集中性与分散性并存,反映了病毒传播的广泛性和复杂性,给血液型脓病的防控带来极大难度。在缺乏有效药物防治的情况下,及时预警、精准防控及群防群控等措施有助于阻止BmNPV的流行和传播。只有从根本上减少蚕区BmNPV多角体累积,才能有效降低家蚕血液型脓病的发生概率,实现广西蚕桑产业的持续健康发展。
4 结论
广西BmNPV毒株gp64基因在进化过程中其信号肽区出现明显变异,发生同义突变的频率较高,形成较独立的进化分群,毒株间的致病力差异可能与GP64蛋白糖基化位点不同有关,说明广西BmNPV毒株具有不同的基因型和表型,在一定程度上维持了BmNPV野生群体的遗传多样性。
参考文献:
陈朝蓉,屈达才,朱方容,李俊,闭立辉,梁湘. 2017. 广西家蚕核型多角体病毒株gp64基因克隆与序列分析[J]. 南方农业学报,48(2):328-335. doi:10.3969/j:issn.2095-1191. 2017.02.328. [Chen C R,Qu D C,Zhu F R,Li J,Bi L H,Liang X. 2017. Cloning and sequence analysis of gp64 gene in Bombyx mori nucleopolyhedrovirus Guangxi isolates[J]. Journal of Southern Agriculture,48(2):328-335.]
梁飛. 2016. BmNPV膜融合蛋白GP64作用机制初步研究[D]. 镇江:江苏科技大学. [Liang F. 2016. A preliminary study on mechanism of BmNPV envelope fusion protein GP64[D]. Zhenjiang:Jiangsu University of Science and Technology.]
柳林. 2018. 量子点标记BmNPV芽生病毒粒子研究及GP64信号肽分析[D]. 镇江:江苏科技大学. [Liu L. 2018. Study on quantum dots labeling of BmNPV BV and ana-lysis GP64 signal peptide[D]. Zhenjiang:Jiangsu University of Science and Technology.]
鲁兴萌. 2012. 家蚕对血液型脓病的抗性与防治策略[J]. 中国蚕业,33(3):4-7. doi:10.16839/j.cnki.zgcy.2012.03. 002. [Lu X M. 2012. Resistance and prevention strategy of Bombyx mori to nuclear polyhedrosis[J]. China Sericulture,33(3):4-7.]
南文斌. 2018. BmNPV膜融合蛋白GP64中胆固醇结合位点活性分析[D]. 镇江:江苏科技大学. [Nan W B. 2018. Analysis of cholesterol-binding site activity in GP64 of BmNPV membrance fusion protein[D]. Zhenjiang:Jiangsu University of Science and Technology.]
覃吕高,屈达才,李俊,徐周徐. 2013. 家蚕抗核型多角体病毒基因与蛋白的研究进展[J]. 南方农业学报,44(5):854-858. doi:10.3969/j:issn.2095-1191.2013.5.854. [Qin L G,Qu D C,Li J,Xu Z X. 2013. Research progress in silkworm gene and protein against Bombyx mori nuclear polyhedrosis virus[J]. Journal of Southern Agriculture,44(5):854-858.]
王霞,黄旭华,蒋满贵,唐亮,董桂清,黄深惠,石美宁,潘志新. 2020. 广西家蚕血液型脓病发病因子及其病原分子系统发育分析[J]. 南方农业学报,51(3):669-676. doi:10.3969/j.issn.2095-1191.2020.03.025. [Wang X,Huang X H,Jiang M G,Tang L,Dong G Q,Huang S H,Shi M N,Pan Z X. 2020. Epidemic factors of Bombyx mori hemolymph-type septic disease in Guangxi and its molecular phylogenetic analysis[J]. Journal of Southern Agriculture,51(3):669-676.]
夏定國,张国政,王文兵,赵巧玲,唐顺明. 2007. gp64基因相应dsRNA对家蚕核型多角体病毒(BmNPV)增殖的抑制[J]. 中国农业科学,40(12):2882-2887. [Xia D G,Zhang G Z,Wang W B,Zhao Q L,Tang S M. 2007. Inhibitory effects of the corresponding dsRNA of gp64 gene on BmNPV multiplication[J]. Scientia Agricultura Sinica,40(12):2882-2887.]
Deo V K,Yui M,Alam J,Yamazaki M,Kato T,Park E Y. 2014. A model for targeting colon carcinoma cells using single-chain variable fragments anchored on virus-like particles via glycosyl phosphatidylinositol anchor[J]. Pharmaceutical Research,31(8):2166-2177. doi:10.1007/s11095-014-1316-4.
Fuxa J R. 2004. Ecology of insect nucleopolyhedroviruses[J]. Agriculture,Ecosystems & Environment,103(1):27-43. doi:10.1016/j.agee.2003.10.013.
Gomi S,Majima K,Maeda S. 1999. Sequence analysis of the genome of Bombyx mori nucleopolyhedrovirus[J]. The Journal of General Virology,80(5):1323-1337. doi:10. 1099/0022-1317-80-5-1323.
Herniou E A,Jehle J A. 2007. Baculovirus phylogeny and evolution[J]. Current Drug Targets,8(10):1043-1050. doi:10. 2174/138945007782151306.
Hitchman R B,Hodgson D J,King L A,Hails R S,Cory J S,Possee R D. 2007. Host mediated selection of pathogen genotypes as a mechanism for the maintenance of baculovirus diversity in the field[J]. Journal of Invertebrate Pathology,94(3):153-162. doi:10.1016/j.jip.2006.10.002.
Jarvis D L,Wills L,Burow G,Bohlmeyer D A. 1998. Mutational analysis of the N-linked glycans on Autographa californica nucleopolyhedrovirus gp64[J]. Journal of Virology,72(12):9459-9469. doi:10.1128/JVI.72.12.9459-9469.1998.
Jiang L,Zhao P,Wang G H,Cheng T C,Yang Q,Jin S K,Lin P,Xiao Y,Sun Q,Xia Q Y. 2013. Comparison of factors that may affect the inhibitory efficacy of transgenic RNAi targeting of baculoviral genes in silkworm,Bombyx mori[J]. Antiviral Research,97(3):255-263. doi:10. 1016/j.antiviral.2012.12.020.
Kato T,Suzuki F,Park E Y. 2012. Display of the human (pro) renin receptor on Bombyx mori nucleopolyhedrovirus(BmNPV) particles using Bm cells[J]. Journal of Bioscience and Bioengineering,114(5):564-569. doi:10.1016/ j.jbiosc.2012.06.008.
Katou Y,Ikeda M,Kobayashi M. 2006. Abortive replication of Bombyx mori nucleopolyhedrovirus in Sf9 and High Five cells:Defective nuclear transport of the virions[J]. Virology,347(2):455-465. doi:10.1016/j.virol.2005.11.043.
Li G H,Tang Q,Chen H Q,Yao Q,Ning D G,Chen K P. 2011. Display of Bombyx mori nucleopolyhedrovirus GP64 on the Bacillus subtilis spore coat[J]. Current Microbio-logy,62(5):1368-1373. doi:10.1007/s00284-011-9867-7.
Li Z F,Blissard G W. 2009. The pre-transmembrane domain of the Autographa californica multicapsid nucleopolyhedrovirus GP64 protein is critical for membrane fusion and virus infectivity[J]. Journal of Virology,83(21):10993-11004. doi:10.1128/JVI.01085-09.
Liang X,Lu Z L,Wei B X,Feng J L,Qu D C,Luo T R. 2013. Phylogenetic analysis of Bombyx mori nucleopolyhedrovirus polyhedrin and p10 genes in wild isolates from Guangxi Zhuang Autonomous Region,China[J]. Virus Genes,46(1):140-151. doi:10.1007/s11262-012-0820-z.
Monsma S A,Oomens A G,Blissard G W. 1996. The GP64 envelope fusion protein is an essential baculovirus protein required for cell-to-cell transmission of infection[J]. Journal of Virology,70(7):4607-4616. doi:10.1128/JVI. 70.7.4607-4616.1996.
Nagamine T,Sako Y. 2016. A role for the anti-viral host defense mechanism in the phylogenetic divergence in baculovirus evolution[J]. PLoS One,11(5):e0156394. doi:10. 1371/journal.pone.0156394.
Rahman M M,Gopinathan K P. 2003. Characterization of the gene encoding the envelope fusion glycoprotein GP64 from Bombyx mori nucleopolyhedrovirus[J]. Virus Resea-rch,94(1):45-57. doi:10.1016/s0168-1702(03)00123-0.
Washburn J O,Chan E Y,Volkman L E,Aumiller J J,Jarvis D L. 2003. Early synthesis of budded virus envelope fusion protein GP64 enhances Autographa californica multicapsid nucleopolyhedrovirus virulence in orally infected Heliothis virescens[J]. Journal of Virology,77(1):280-290. doi:10.1128/jvi.77.1.280-290.2003.
Xu Y P,Cheng R L,Xi Y,Zhang C X. 2013. Genomic diversity of Bombyx mori nucleopolyhedrovirus strains[J]. Genomics,102(1):63-71. doi:10.1016/j.ygeno.2013.04.015.
Zheng H,Ren F F,Lu Q Y,Cao Z M,Song J C,Feng M,Liu J S,Sun J C. 2019. An efficient method for multigene co-interference by recombinant Bombyx mori nucleopolyhedrovirus[J]. Molecular Genetics and Genomics,294(1):111-120. doi:10.1007/s00438-018-1491-9.
Zhou J,Blissard G W. 2008. Identification of a GP64 subdomain involved in receptor binding by budded virions of the baculovirus Autographica californica multicapsid nucleopolyhedrovirus[J]. Journal of Virology,82(9):4449-4460. doi:10.1128/JVI.02490-07.
(責任编辑 兰宗宝)

