ddPCR技术和Sanger测序法检测甲状腺乳头状癌患者BRAF V600E基因突变的比较分析
时运, 王卓
甲状腺乳头状癌(papillary thyroid cancer,PTC)是甲状腺癌中最常见的病理类型,占所有甲状腺癌的85%~90%[1]。BRAF V600E基因突变是PTC最常见的驱动基因突变位点。其为BRAF基因第1 799位点的胸腺嘧啶(T)被腺嘌呤(A)替代,从而导致蛋白质产物中第600位的赖氨酸(V)被谷氨酸(E)替代。近来的研究显示,BRAF V600E基因突变与PTC的不良临床病理学因素及复发风险相关[2],并且可以辅助甲状腺结节的良恶性鉴别[3-6]。目前,BRAF V600E基因突变检测的方法很多[7-9],但Sanger测序法依然是“金标准”[10]。微滴式数字PCR(droplet digital PCR,ddPCR)技术是近年来引入国内的一种新型检测方法,其具有高灵敏度,重复性好且可绝对定量等特点。本研究利用ddPCR技术与Sanger测序法检测甲状腺乳头状癌患者BRAF V600E基因突变,并加以分析对比。
1 材料与方法
1.1 标本来源 收集2017年1月1日至2019年9月1日江苏省肿瘤医院收治手术,经病理诊断为PTC的术后甲醛固定后石蜡包埋样本90例为病例组,其中男36例,女54例,年龄17~72岁,中位年龄52岁。以病理诊断为甲状腺良性病变的术后甲醛固定后石蜡包埋样本19例为对照组,其中男8例,女11例,年龄28~56岁,中位年龄45岁。患者临床特征信息见表1。TNM分期参照美国癌症联合委员会(AJCC)最新版(第8版)。本研究所有患者均知情同意,并经医院医学伦理委员会批准。
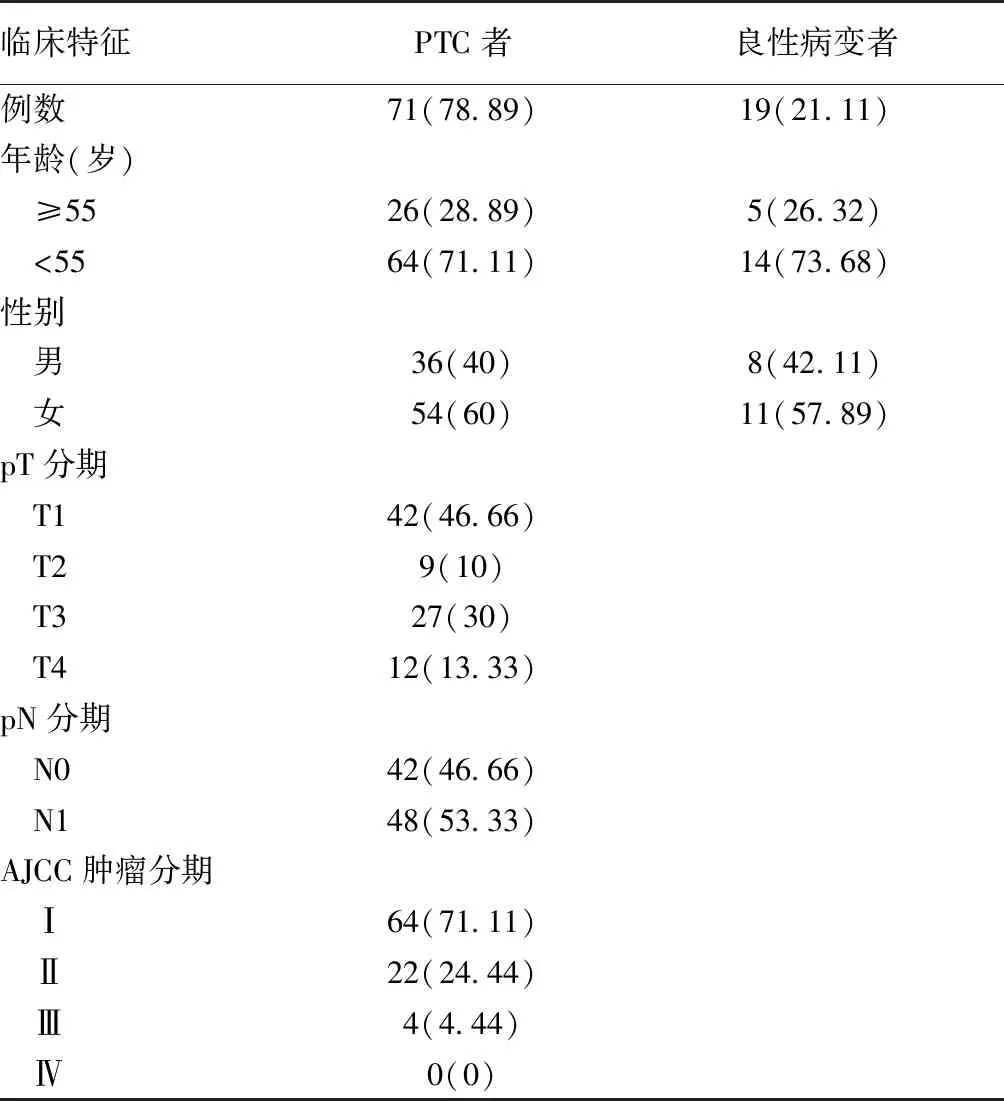
表1 90例PTC患者临床特征资料[例(%)]
1.2 DNA提取 按照QIAamp DNA FFPE Tissue Kit 试剂盒(批号148030295,德国凯杰公司)说明书操作,提取DNA。采用Onedrop OD-1000+spectrophotometer检测仪检测提取DNA的浓度和纯度。琼脂糖电泳检测DNA的片段化程度。
1.3 Sanger测序法检测BRAF V600E基因突变 运用PCR扩增仪扩增BRAF基因目的片段,扩增引物如表2所示。扩增条件为95 ℃预变性5 min,然后95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,35个循环,最后72 ℃延伸5 min。按照Cycle-Pure Kit 纯化试剂盒(批号D6492-02,美国Omega Biotek公司)说明书操作,纯化PCR产物。采用Big Dye Terminator v3.1 kit (批号1803136, 美国赛默飞世尔公司)进行测序反应(测序引物同扩增引物),随后纯化,运用ABI 3500基因测序仪进行测序分析。

表2 Sanger测序法和ddPCR法检测BRAF V600E基因突变引物
1.4 ddPCR法检测BRAF V600E基因突变 ddPCR法反应体系为:20 ng DNA, 1×ddPCR supermix (no dUTP), 0.5 μmol/L 引物,0.25 μmol/L探针,总体积20 μl。采用QX200 Droplet Digital PCR系统(美国Bio-Rad公司)进行检测。反应条件为:95 ℃ 10 min (1个循环), 94 ℃ 30 s ,55 ℃ 1 min (40个循环), 98 ℃ 10 min(1个循环,2 ℃/s的升温速率),最后4 ℃ 保温(1 ℃/s的降温速率)。采用QuantaSoft v1.6.6 analysis software进行数据分析,阈值的确定依据“Droplet Digital Application Guide” (美国Bio-Rad公司)。阳性判定:“ch1+ch2-”区的点≥3个。
2 结果
2.1 Sanger测序法和ddPCR法检测BRAF V600E基因突变的比较 90例PTC标本中,Sanger测序法检测出48例BRAF V600E基因突变(如图1所示),检出率53.33%,ddPCR法检测出66例BRAF V600E基因突变(如图2所示),检出率73.33%。两种检测方法比较,有18例标本检测结果不一致,均为ddPCR法检测为突变型,而Sanger测序法检测为野生型。与“金标准”Sanger测序法相比,采用ddPCR法检测BRAF V600E基因突变敏感性和特异性分别为100%和57.14%,阳性预测值和阴性预测值分别为72.73%和100.00%,两种方法一致率为80%。在19例甲状腺良性病变标本中,Sanger测序法和ddPCR法均未检出BRAF V600E基因突变。
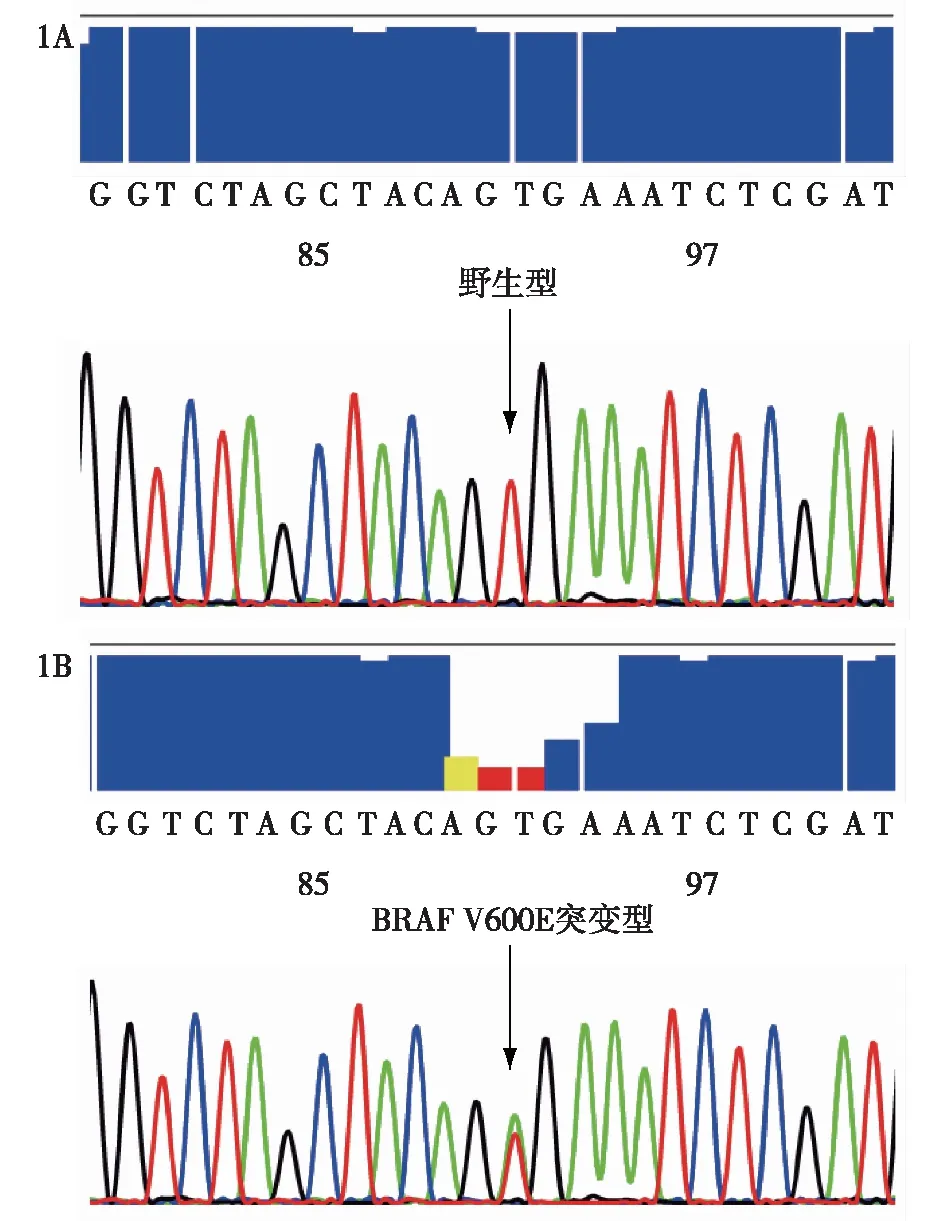
注:1A为BRAF V600E基因野生型;1B为BRAF V600E基因突变型图1 Sanger测序法检测BRAF V600E基因突变的结果示意图
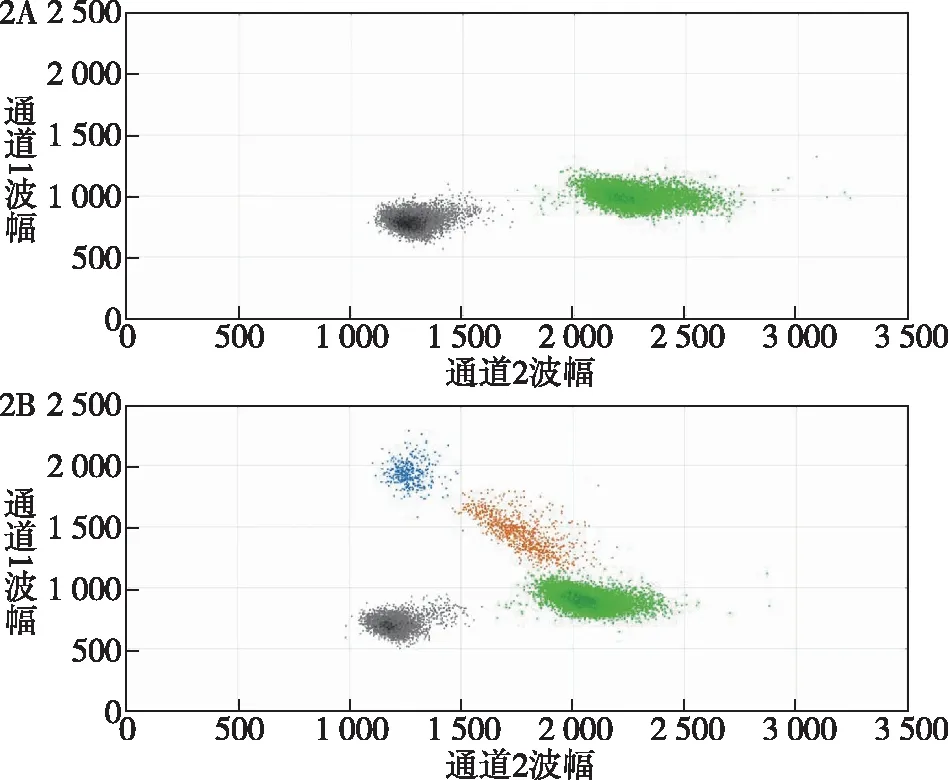
注:2A为BRAF V600E基因野生型;2B为BRAF V600E基因突变型。图中黑色代表不含目的片段DNA的微滴,绿色代表含野生型目的片段DNA的微滴,蓝色代表含突变型目的片段DNA的微滴黄色代表既含野生型又含突变型目的片段DNA的微滴。图2 ddPCR法检测BRAF V600E基因突变的结果示意图
2.2 PTC患者BRAF V600E基因突变丰度分布 采用ddPCR法检测,66例检出BRAF V600E基因突变的样本中,基因突变丰度分布范围0.35%~47.50%。其中,68.18%的样本(45/66)基因突变丰度≥10%,9.09%的样本(6/66)基因突变丰度在5%~10%,22.73%的样本(15/66)基因突变丰度≤5%。ddPCR法检测基因突变丰度≥10%的全部45例样本,基因突变丰度在5%~10%的3例样本,采用Sanger测序法均检测出BRAF V600E基因突变。其余样本采用Sanger测序法未检出BRAF V600E基因突变。
3 讨论
BRAF基因位于RET和RAS的下游,是RAS-RAF-MEK-ERK信号通路的关键基因之一。BRAF基因 V600E 突变约占所有BRAF基因突变的95%[11]。BRAF V600E基因突变目前已广泛应用于甲状腺癌的术前诊断和预后评估,并且作为潜在的治疗靶点受到越来越多的关注[1]。
Sanger测序法被认为是基因检测的“金标准”,其广泛应用于BRAF V600E基因突变的临床检测,但其存在检测灵敏度不高的问题,实际检测中易产生假阴性。ddPCR是近年来新发展起来的一项检测技术,其无需校准物和绘制标准曲线即可实现对样品初始浓度的绝对定量,比传统荧光定量PCR具有更加出色的灵敏度、特异性和精确性[12]。ddPCR技术在PCR扩增前对样品进行微滴化处理,扩增结束后对每个微滴的荧光信号进行分析,通过泊松分布原理计算每个反应单元格的平均浓度,检测数万个微滴。ddPCR技术在肿瘤相关的分子检测领域已有众多应用[13-14]。由于检测方法,取材等因素的差异,PTC患者BRAF V600E突变检出率不尽相同,突变检出率范围29%~90%[10,15-17]。本研究中的突变检出率在此范围内。本研究中,ddPCR法检测BRAF V600E基因突变检出率明显高于Sanger测序法,显示出ddPCR法高灵敏度的优势。
此前的研究认为,肿瘤驱动基因的突变仅发生在肿瘤组织中,BRAF V600E突变仅发生在PTC组织中,[18-21]。但近来不断有研究指出,正常组织中也会存在肿瘤驱动基因的突变。丁金旺等[22]研究结果显示采用扩增阻滞突变法在115例甲状腺良性病变组织中检测出2例BRAF V600E突变。本研究受限于样本数,ddPCR法和Sanger测序法均未在甲状腺良性病变组织中检测出BRAF V600E突变。
McEvoy等[23]指出,使用焦磷酸测序法检测突变丰度在5%~8%的样品时,需要采用其他检测方法进行验证。本研究也发现,采用Sanger测序法检测高突变丰度的样品时,检测结果和ddPCR法一致。而检测低突变丰度的样品时,仅部分BRAF V600E基因突变的样品可以检出。Sanger测序法无法检出突变丰度≤5%的样品。因此在检测肿瘤DNA含量和突变丰度较低的样品时,Sanger测序法有可能产生假阴性,需采用其他检测方法。
本研究采用的标本均为手术后石蜡包埋样本。而目前,BRAF V600E突变检测标本部分来源于甲状腺结节术前细针穿刺细胞学 标本和粗针穿刺活检标本。此类样本普遍肿瘤细胞含量较石蜡包埋样本低,需要采用ddPCR法、 ARMS法等高灵敏度的检测方法。采用传统的金标准Sanger测序法可能产生更多的假阴性。
综上,ddPCR法检测PTC患者BRAF V600E突变,灵敏度好,检出率更高,适合检测肿瘤DNA含量和突变丰度较低的样品。可替代Sanger测序法,在临床检测中应用推广。

