利用数字化实验鉴别碳酸钠和碳酸氢钠溶液
湖北省武昌实验中学(430061) 唐 苏
1 实验背景及意义
碳酸钠和碳酸氢钠作为钠的重要化合物,其性质研究是中学化学教学的重点。“对比法”是学习这一内容最常用的方法,人教版必修1课本主要介绍了二者的碱性不同、固体的热稳定性以及溶液和盐酸反应的现象不同。Na2CO3和NaHCO3溶液都是无色澄清的溶液,在对其进行鉴别时,一些中学教师和辅导资料认为:可以用CaCl2溶液鉴别Na2CO3和NaHCO3溶液,理由是根据复分解反应的条件简单地认为CaCl2溶液与Na2CO3溶液混合生成CaCO3白色沉淀,而NaHCO3则不能。但是通过实验会发现,在Na2CO3和NaHCO3溶液中加CaCl2溶液均能产生白色沉淀,通过对其产生白色沉淀的理论分析,二者虽然都能产生白色沉淀,但是产生的过程会有所差异,因此可以采用数字化实验仪器对反应过程进行即时记录。
在一次作业中遇到这样一道题:将碳酸氢钠溶液加热,发现有能使澄清石灰水变浑浊的气体生成,学生在课下提出疑问:“以前上课讲的是碳酸氢钠固体受热会产CO2,难道碳酸氢钠溶液也会分解吗?”为了解决学生的困惑,笔者采用数字化实验仪器设计了此实验。
传统的使用盐酸鉴定碳酸钠和碳酸氢钠溶液的方法无法定量地反映整体变化过程,不利于学生理解水解平衡、电离平衡和滴定突跃等问题。因此,本研究利用数字化实验仪器分别测定盐酸滴定碳酸钠和碳酸氢钠溶液过程中的pH变化曲线。
学生通过本节课的实验探究,能够进一步巩固其对化学反应原理等相关知识的掌握,形成完整的认知结构。将数字化实验应用于日常教学是一种崭新的教学模式,学生对这种实验模式充满了新鲜感,而学生的自主操作、小组讨论实验结果更是让他们的参与意识、合作精神、实验操作、分析能力都得到了极大的发挥。同时,学生通过简单的数据处理和分析,完成实验现象由定性到定量的转变,能够更集中于对数据背后隐藏的科学规律的探究,促进学生对化学研究方法的理解和定量研究能力的提升,从而有利于培养学生的科学素养。
2 实验原理及设计
2.1 利用CaCl2溶液鉴别Na2CO3和NaHCO3溶液
(1)反应方程式
Na2CO3+ CaCl2=2 NaCl + CaCO3↓
2 NaHCO3+ CaCl2=2 NaCl + CaCO3↓ + H2O + CO2↑
(2)实验原理
当加入的碳酸钠、碳酸氢钠以及氯化钙的量相同时,产生的沉淀量不同,同时HCO3-电离产生CO32-,与Ca2+反应生成沉淀,从而促进其电离,因此碳酸氢钠与氯化钙反应生成沉淀的过程应该是持续进行的,产生的沉淀量也应该是持续增加的。据此可采用色度计和浊度计对其产生的沉淀量进行测定,从而鉴别出碳酸钠和碳酸氢钠溶液。
(3)色度计原理
色度传感器用于测量溶液的透光率,相当于一台简易的分光光度计。通过滤光片发出一定波长的平行光,当一束平行光通过比色皿中均匀的溶液介质时,光的一部分被吸收(It),一部分被透过(Io)。通过比对透射光强度与发射光强度,即可得到透光度T(T=It/Io)。根据朗伯比尔定律,溶液的吸光度(A)与吸光物质的浓度(c)和吸收层厚度(b)的乘积成正比,且等于透光率倒数的对数:吸光度A=lg(1/T)=Kcb(K为比例常数)。
本实验中随着反应的进行,生成的沉淀越多,吸收光越多,透射光越弱,色度计测出的色度值越低。
(4)浊度传感器原理
浊度传感器是用于测量液体的浑浊度或化学反应过程中生成的沉淀量,即液体中悬浮物的多少。一束平行光在透明液体中传播,如果液体中无任何悬浮颗粒存在,那么光束在直线传播时不会改变方向;若有悬浮颗粒,光束在遇到颗粒时就会改变方向(不管颗粒透明与否)。这就形成所谓散射光。颗粒愈多(浊度愈高)光的散射就愈严重。浊度计发出光线,使之穿过一段样品,并从与入射光呈90°的方向上检测有多少光被水中的颗粒物所散射。
在本实验中,随着反应的进行,当生成碳酸钙的量不断增加时,颗粒对光的散射增强,溶液的浊度值越大。
2.2 利用加热鉴别Na2CO3和NaHCO3溶液
(1)反应方程式
(2)实验原理
NaHCO3溶液在加热过程中会产生CO2,而Na2CO3溶液不能,分别将其加热,通过测装置中CO2的含量变化,从而鉴别出碳酸钠和碳酸氢钠溶液。
(3)二氧化碳传感器原理
二氧化碳传感器用于测量气体中二氧化碳含量,采用“泵动循环式”构造,传感器前段有进气管和出气管,可使被测气体循环进入敏感器件,本传感器通过红外线吸收法,从而测出二氧化碳含量。
(4)温度传感器原理
温度传感器与温度计类似,其温度敏感元件位于传感器金属探针的顶端,使用时需被测物体与此处充分接触。
2.3 利用盐酸滴定Na2CO3和NaHCO3溶液
(1)反应方程式
Na2CO3+ HCl=NaHCO3+ NaCl
NaHCO3+ HCl=NaCl + H2O + CO2↑
(2)实验原理
Na2CO3溶液与HCl的反应过程分为两个阶段:
Na2CO3+ HCl=NaHCO3+ NaCl
NaHCO3+ HCl=NaCl + H2O + CO2↑
NaHCO3溶液与HCl 的反应过程:
NaHCO3+ HCl=NaCl + H2O + CO2↑
(3)光电门传感器原理
光电门是由1个发光元件和1个接收元件组成的传感器,当二者之间没有物体阻挡时,接收元件受光照射,输出1个低电平,若二者之间有物体阻挡时,接收元件不受光照射,输出1个高电平,因此可通过光电门测量滴下的液体滴数。
(4)pH传感器原理
pH传感器是用来检测被测物中氢离子浓度并转换成相应的可输出信号的传感器,通常由化学部分和信号传输部分构成。本实验中使用pH传感器即时记录溶液中的pH值。
3 实验过程
3.1 仪器与药品
朗威DISLab 8.0数据采集器、计算机、色度传感器、浊度传感器、pH传感器、CO2传感器、温度传感器、光电门传感器、磁力搅拌器、滤纸、100 mL蒸馏烧瓶、干燥管(CaCl2)、导管、酒精灯、石棉网、沸石、小烧杯、磁子、针筒、比色皿、试管、量筒;酚酞试液、蒸馏水、0.1 mol/L Na2CO3溶液、1.0 mol/L Na2CO3溶液、0.1 mol/L NaHCO3溶液、1.0 mol/L NaHCO3溶液、1.0 mol/L CaCl2溶液、1.0 mol/L 盐酸。
3.2 实验步骤
3.2.1 利用CaCl2溶液鉴别Na2CO3和NaHCO3溶液
3.2.1.1 浊度计
(1)连接好浊度计和数据采集器如图1所示,打开数据采集软件;

图1 浊度计实验装置
(2)取5 mL 0.1 mol/L Na2CO3溶液于试管中,加入1 mL 1 mol/L的CaCl2溶液,振荡后立即倒入比色皿中,将比色皿放入浊度计中,点击软件开始记录数据和图像;
(3)待曲线不再发生变化时,保存数据和图像;
(4)将Na2CO3溶液换成5 mL 0.1 mol/L NaHCO3溶液,重复(2)~(3)操作。
3.2.1.2 色度计
(1)连接好色度计和数据采集器,如图2所示,打开数据采集软件;

图2 色度计实验装置
(2)取5 mL 0.1 mol/L Na2CO3溶液于试管中,加入1 mL 1 mol/L的CaCl2溶液,振荡后立即倒入比色皿中,将比色皿放入色度计中,点击软件开始记录数据和图像;
(3)待曲线不再发生变化时,保存数据和图像;
(4)将Na2CO3溶液换成5 mL 0.1 mol/L NaHCO3溶液,重复(2)~(3)操作。
3.2.2 利用加热鉴别Na2CO3和NaHCO3溶液
(1)连接好二氧化碳传感器、温度传感器和数据采集器,如图3所示,打开数据采集软件;

图3 加热法实验装置
(2)取50 mL 1.0 mol/L Na2CO3溶液于蒸馏烧瓶中,点击软件开始记录数据和图像,用酒精灯加热;
(3)待曲线不再发生变化时,保存数据和图像;
(4)将Na2CO3溶液换成50 mL 1.0 mol/L NaHCO3溶液,重复(2)~(3)操作。
3.2.3 利用盐酸滴定鉴别Na2CO3和NaHCO3溶液
(1)连接好pH传感器、光电门和数据采集器,如图4所示,打开数据采集软件;

图4 滴定法实验装置
(2)在针筒中倒入适量1 mol/L的盐酸;
(3)对光电门的滴数进行校准,设置好图像坐标以及记录数据的表格格式;
(4)量取10 mL 1.0 mol/L Na2CO3溶液于小烧杯中,加入磁子,放在磁力搅拌器上,打开磁力搅拌器,小心地将洗净的pH传感器放入小烧杯中(若溶液不能将pH传感器浸没,可加适量的蒸馏水);
(5)点击软件开始记录数据,再打开针筒下端的活塞,开始实验;
(6)待滴定结束后,保存数据和图像;
(7)将Na2CO3溶液换成10 mL 1.0 mol/L NaHCO3溶液,重复(2)~(6)操作。
4 实验数据分析
4.1 利用CaCl2溶液鉴别Na2CO3和NaHCO3溶液

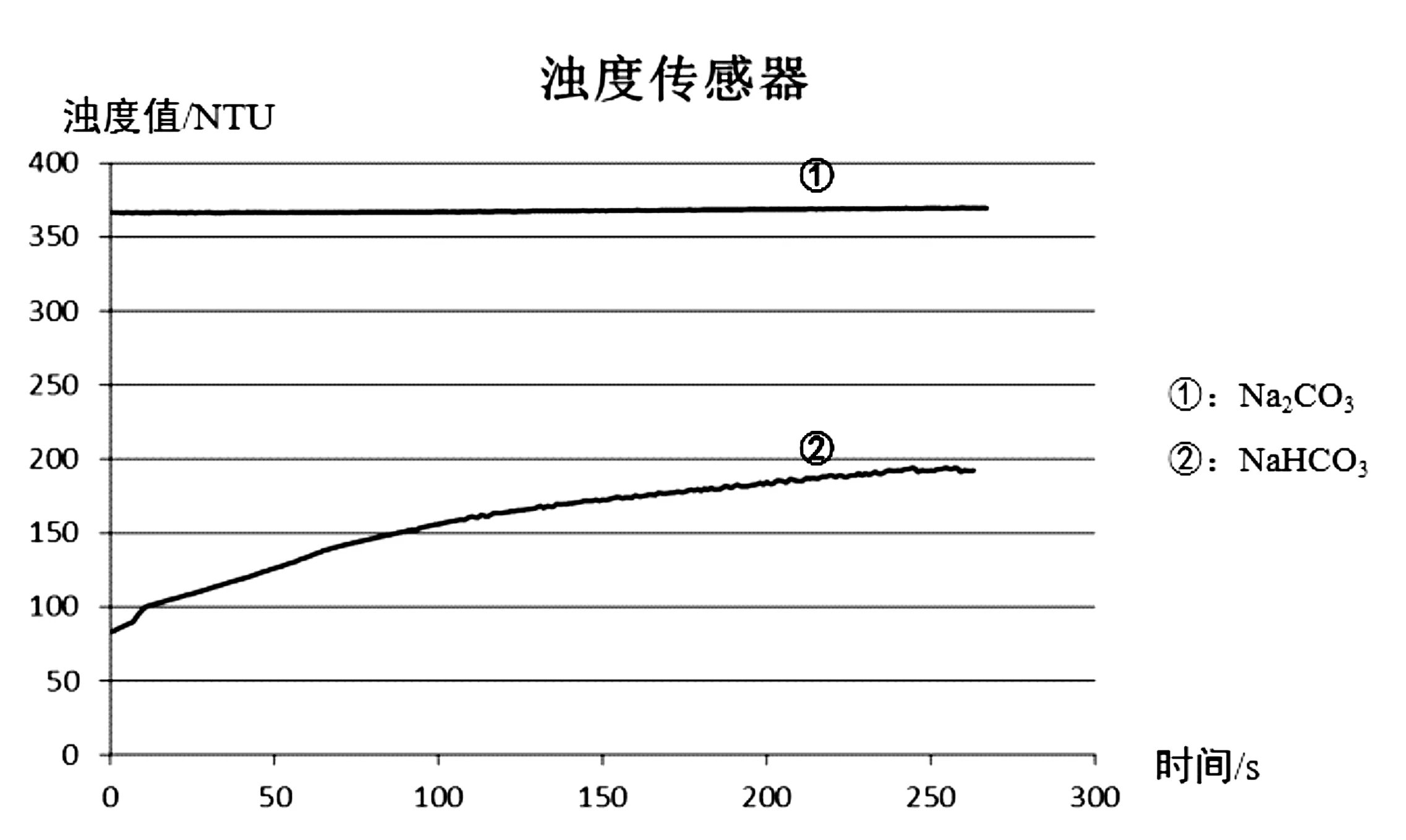
图5 实验图像浊度计
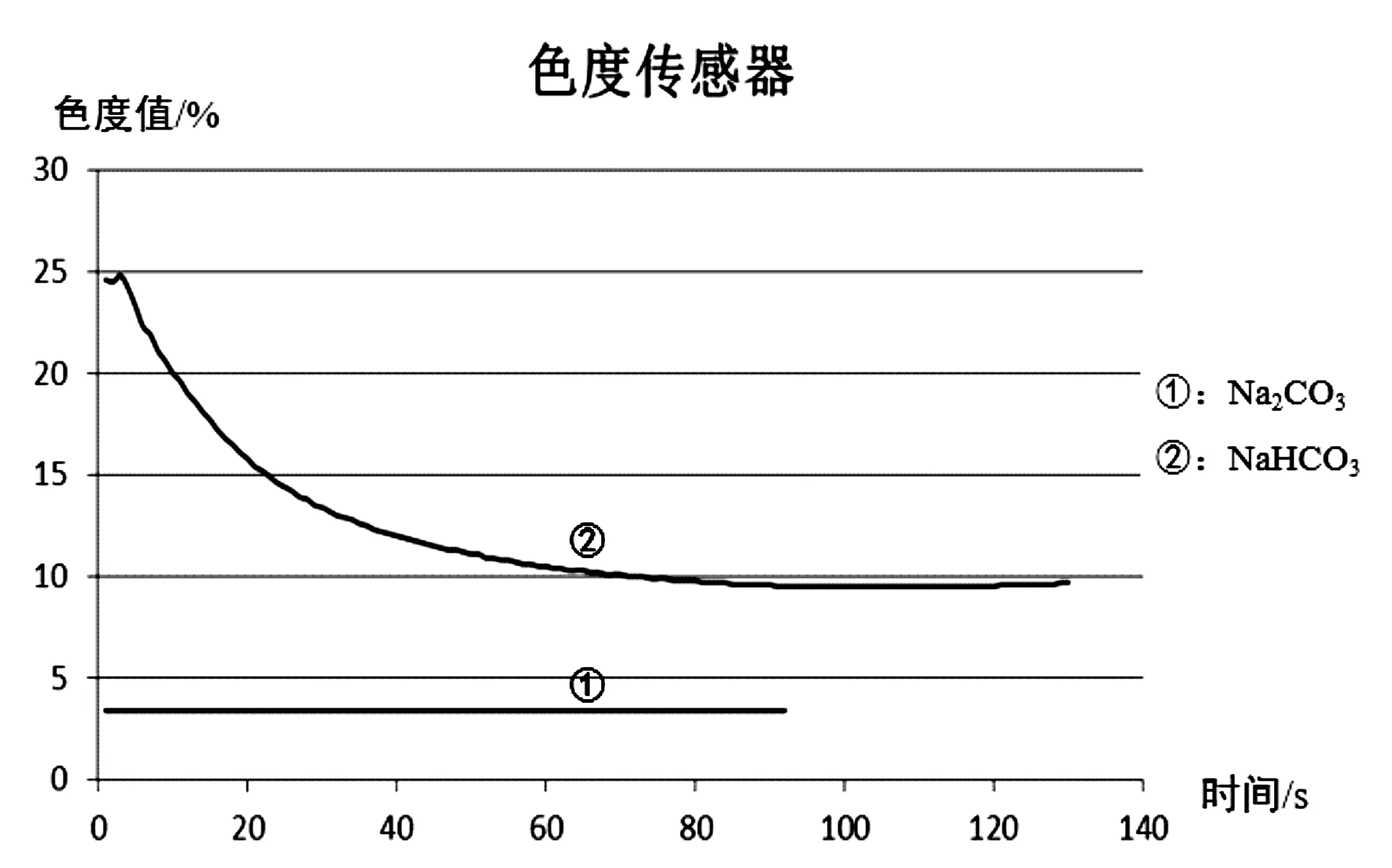
图6 色度计实验图像
4.2 利用加热鉴别Na2CO3和NaHCO3溶液
将二氧化碳传感器和温度传感器得到的数据绘制成图像,得到图7。从图中可以明显看出,在相同的装置中加热同浓度、同体积的Na2CO3和NaHCO3溶液,Na2CO3溶液未发生分解,CO2的含量几乎保持不变。而NaHCO3溶液在50 ℃时即发生分解,体系中CO2的含量明显增加。因此,在查阅碳酸氢钠的溶解度表时,几乎没有60 ℃以上的数据。同时可测得Na2CO3溶液的沸点约为102 ℃,NaHCO3溶液的沸点约为101 ℃。加热NaHCO3溶液时,观察蒸馏烧瓶可看到在50 ℃左右时,烧瓶内壁有气泡产生,且蒸馏烧瓶内壁有白色固体析出,而加热Na2CO3溶液时未观察到此现象,可说明NaHCO3的溶解度比Na2CO3小。

图7 二氧化碳传感器实验图像
4.3 利用盐酸滴定Na2CO3和NaHCO3溶液
盐酸滴定NaHCO3溶液的部分数据见表1,盐酸滴定Na2CO3溶液的部分数据见表2。将所得数据作图,得到图8。从图中可看到Na2CO3溶液在A、B两点有2个明显的突跃,NaHCO3溶液只在C点有一个明显的突跃。由图可以看出,0.1 mol/L的Na2CO3溶液有较强的碱性,数据采集器显示为pH=11.2,溶液为红色;逐滴滴入盐酸后,pH稍有下降,此时溶液中没有气泡产生,当pH约为8.0时,溶液已基本褪为无色;此时随着盐酸的不断滴入,可看到溶液中有气泡产生。从图中可看到第一次突跃pH约为8.0,此时的溶液为NaHCO3和H2CO3的混合液,第二次突跃pH约为4.0,此时的溶液为NaCO和H2CO3的混合液。0.1 mol/L的HaHCO3溶液碱性较弱,数据采集器显示pH=8.57,和理论计算值8.34相差不多,溶液红色较浅;刚开始加入盐酸时,可看到溶液中没有气泡产生,且pH值几乎不变,此时由于生成的CO2溶于溶液中,形成了缓冲溶液,随后可看到有气泡产生,pH开始下降,溶液逐渐褪色,在pH约为4.0时出现了突变,与Na2CO3溶液的第二次突跃重叠。

表1 盐酸滴定碳酸氢钠溶液数据

表2 盐酸滴定碳酸钠溶液数据

图8 pH传感器实验图像
5 结论
通过本次实验,我们可以利用以下方法来鉴别碳酸钠溶液和碳酸氢钠溶液:①溶液加氯化钙溶液,观察是否有气泡生成,以及产生沉淀的量;②加热,观察溶液中是否有气泡生成(未沸腾);③同浓度测pH,碳酸钠的pH大于碳酸氢钠;④滴加盐酸绘制滴定曲线,碳酸钠溶液有2个突跃,碳酸氢钠溶液仅1个突跃。
6 教学反思
课堂上学生在实验前并不知道所给的溶液到底是什么,通过分组实验操作,小组讨论实验数据并对结果进行分析从而鉴别出碳酸钠溶液和碳酸氢钠溶液,实现了学生作为教学的主体,教师作为导向的课堂教学。在用盐酸滴定碳酸氢钠溶液时,这一组的学生提出笔者预先没有注意到的问题:“为什么在前20滴时,溶液的pH没有变化?”这个问题引发了大家激烈地讨论,最后由另外一组的学生得到了结论。通过滴定实验学生们已经认识到在用盐酸滴碳酸钠溶液时不能使用酚酞做指示剂,从而又引出了双指示剂法。在课堂上笔者还提出了一个问题:“如果使用本次实验所加入的量,那么碳酸氢钠溶液的浓度需要达到多少才能出现沉淀?”由于课堂时间有限,笔者让有兴趣的学生课下计算,在实验报告中有学生通过计算得出了结果。
化学科学素养由化学基本知识和技能、化学科学能力、化学科学品质组成。本次的实验,并不是所有小组都完全操作正确,但是各小组在进行展示时,都谈到了自己操作时出现的问题,并对这些问题可能造成的误差或错误进行了分析,这也正是笔者希望学生通过本节课能够学到的东西,即失败并不可怕,及时的分析与纠正才是最重要的。希望通过本次的探究实验,让学生体会到化学是一门以实验为基础的科学。学生在这节课上不仅学会了如何鉴别碳酸钠和碳酸氢钠溶液,同时还学会了如何通过分析实验数据和现象得出结论,将所学习的理论知识运用于实际问题的解答。更重要的是,即使在实验过程中出现了失误或者是失败,也能够分析出原因找到改进的方法。
课后很多学生对传感器表现出了很大的兴趣,对于这节课还能使用哪些传感器提出了自己的想法,希望在以后的教学中学生能够自主完成探究实验设计,实现真正意义上的实验探究,并将这种探究精神以及分析问题、解决问题的能力应用于生活学习中。

