近红外测定丹参提取浓缩过程中的丹参酮类的含量
张偲偲,王德勤,朱晶晶,李楚源,王智民,匡艳辉*
(1.广州白云山和记黄埔中药有限公司,广州510515;2.中国中医科学院中药研究所,北京100700)
复方丹参片是一种常用的中成药,用于防治心脑血管疾病[1],能够活血化瘀,理气止痛,用于治疗气滞血淤所致的胸痹,冠心病,心绞痛等病症[2]。丹参是复方丹参片中的成分之一,为君药,需经过提取浓缩的工艺以中间体入药。作为原料药,丹参提取物的质量对产品的质量起着至关重要的作用。2015版《中国药典》中对于复方丹参片的含量测定,使用高效液相色谱法检测丹参酮类(检测指标:丹酚酸B和丹参酮ⅡA),但采用此法有时间滞后性,难以快速、高效、实时地反映丹参提取浓缩过程中含量的变化情况,不便用于丹参提取浓缩过程中含量的实时监测和过程控制,从而无法保证相关过程的可控性。由查阅文献以及从临床应用的研究中可知,不同厂家之间甚至相同厂家不同批号之间的复方丹参片的质量和疗效的差异很大[3]。因此可知,为了适应生产过程的实时监控,建立一种快速,高效的过程分析技术方法是目前大势所趋。
作为一种间接分析技术,近红外(NIR)光谱分析具有样品处理过程无损简单、分析过程快速高效、无试剂消耗等特点,已经陆续用于制药过程药效成分含量的在线检测、监控、天然药物鉴别、中药材的产地鉴别等[4-8]。将NIR技术应用于药材的质量检测,中药生产过程的监控[9-11],可实现入库、投料和生产过程中的现场快速检测,从而保证最终产品的质量安全、稳定、均一、有效。
本研究基于NIR技术结合化学计量学方法对复方丹参片生产过程中丹参的提取和浓缩过程中的二氢丹参酮,隐丹参酮,丹参酮Ⅰ和丹参酮ⅡA进行定量分析,通过近红外图谱建立相关模型,实现生产过程实时质量控制,为中药制药生产过程监测方法开发提供参考思路。
1 仪器及试药
德国BRUKER-MPA型傅立叶变换近红外光谱仪(光源:卤钨灯,检测器:PbS,附漫反射积分球,样品旋转器和石英样品杯);ACQUITY UPLC H-Class型超高效液相色谱系统 (美国Waters公司、二极管阵列(PDA)检测器、柱温箱、Empower 3色谱工作站);Milli-Q型超纯水制备仪 (美国Millipore公司);SB25-12DTD超声波清洗器(宁波新芝生物科技有限公司);Satorius BT214D万分之一分析天平。
乙腈、甲醇均为色谱纯;水为超纯水;其余试剂为分析纯。对照品二氢丹参酮(批号:A0060,购自成都曼思特生物科技有限公司);隐丹参酮 (批号:110852-200305),丹参酮Ⅰ(批号:110867-200406),丹参酮ⅡA(批号:110766-200619),均购自中国药品生物制品检定所,供含量测定使用。
2 方法
2.1 丹参提取浓缩液制备
参考 《中国药典》2015年版复方丹参片中丹参的提取、浓缩工艺条件:称取2.00kg的丹参饮片,精密称定,第一次提取时,加5倍量的95%乙醇加热回流1.5h,提取液过滤后滤液回收乙醇并浓缩至相对密度1.10~1.20。第二次提取时,于药渣加入4倍量的50%乙醇加热回流1.5h,提取液过滤,滤液回收乙醇并浓缩至相对密度1.10~1.20。第三次提取时往药渣加入4倍量的水加热回流2h,过滤,得到滤液。将三次所得的浓缩液混合并浓缩至相对密度为1.30~1.41。提取过程中,沸腾开始时取样,之后每15min取一次样,每次取样量为5mL,浓缩过程中,每3min取样,每次取样2mL,将取得样进行NIR扫描和UPLC含量的测定。
2.2 NIR光谱采集
NIR测定条件为室温环境下测定,选定透射模式Near-IR Transmittance, 扫描范围12500~4000cm-1,扫描次数:64次,样品池2mm,分辨率:8cm-1,每个样品扫描一次光谱。
2.3 UPLC方法测定二氢丹参酮、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA的含量
2.3.1 色谱条件与系统适用性试验
ACQUITYHSS-T3® HSST3 1.8μm 2.1×100mm色谱柱;以乙腈(A)-0.1%磷酸水(B)为流动相;理论板数以丹参酮ⅡA不低于30000。梯度洗脱(0~1min,3%~50%A;1~7min,50%~55%A;7~10min,55%~70%A;10~11min,70%~95%A), 柱温30℃; 进样量2μL, 流速0.5ml·min-1。 检测波长为275nm。
2.3.2 对照品溶液的配置
取对照品适量,精密称定,加甲醇制成每1mL含145μg二氢丹参酮,142μg隐丹参酮,228μg丹参酮Ⅰ,403μg丹参酮ⅡA的混合溶液,即得。
2.3.3 样品溶液的配置
将提取液样品直接用0.25μm微孔滤膜过滤,取续滤液,即得。将浓缩液稀释5倍后用0.25μm微孔滤膜过滤,取续滤液,即得。其中检验样品集为[30min取的95%乙醇提取液 (样品编号1),45min取的95%乙醇次提取液(样品编号2),9min取的50%乙醇浓缩液(样品编号3),12min取的50%乙醇浓缩液(样品编号4),15min取的95%乙醇浓缩液(样品编号5)],预测样品 集 为 编 号 为 样 品6、8、13、33、42、50、56[样 品6(60min取的95%乙醇的提取液),样品8(105min取的95%乙醇提取液),样品13(45min取的50%乙醇提取液),样品15(90min取的50%乙醇提取液),样品42(9min取的95%乙醇浓缩液),样品44(15min取,95%乙醇浓缩液,稀释5倍),样品50(3min取的50%乙醇浓缩液),样品56(18min取的50%乙醇提取液,稀释5倍)]。
3 结果和讨论
3.1 提取浓缩液中二氢丹参酮,隐丹参酮,丹参酮Ⅰ,丹参酮ⅡA的含量测定结果
建立的二氢丹参酮,隐丹参酮,丹参酮Ⅰ,丹参酮ⅡA的标准曲线中,线性回归方程分别为二氢丹参酮Y=7012X-28077(R2=1,n=6), 隐丹参酮Y=8000X-22714(R2=1,n=6),丹参酮ⅠY=5018X-58986(R2=1,n=6),丹参酮ⅡA Y=2268X+12045(R2=1,n=6)。 二氢丹参酮,隐丹参酮,丹参酮Ⅰ,丹参酮ⅡA分别在72.5~725ng、71~710ng、114~1140ng、203~2030ng范围内线性关系良好;精密度实验显示二氢丹参酮的RSD为0.54%,隐丹参酮的RSD为0.39%,丹参酮Ⅰ的RSD为2.14%,丹参酮ⅡA的RSD为0.42%,结果显示良好。稳定性试验结果显示在0、2、4、8、16、24h测定二氢丹参酮,隐丹参酮,丹参酮Ⅰ,丹参酮ⅡA的含量的RSD值分别为4.33%,0.72%,4.67%和0.95%;加样回收率试验结果显示二氢丹参酮的回收率是98.7%(RSD=1.55%),隐丹参酮的回收率97.5%(RSD=1.13%),丹参酮Ⅰ的回收率是90.8%(RSD=0.51%),丹参酮ⅡA的回收率是104.2%(RSD=0.92%)。
3.2 二氢丹参酮,隐丹参酮,丹参酮Ⅰ,丹参酮ⅡA的定量分析模型的建立及评价
3.2.1 样品集近红外光谱测定
其扫描得到的光图谱经过SG平滑处理得到以下光谱图,详见图1。
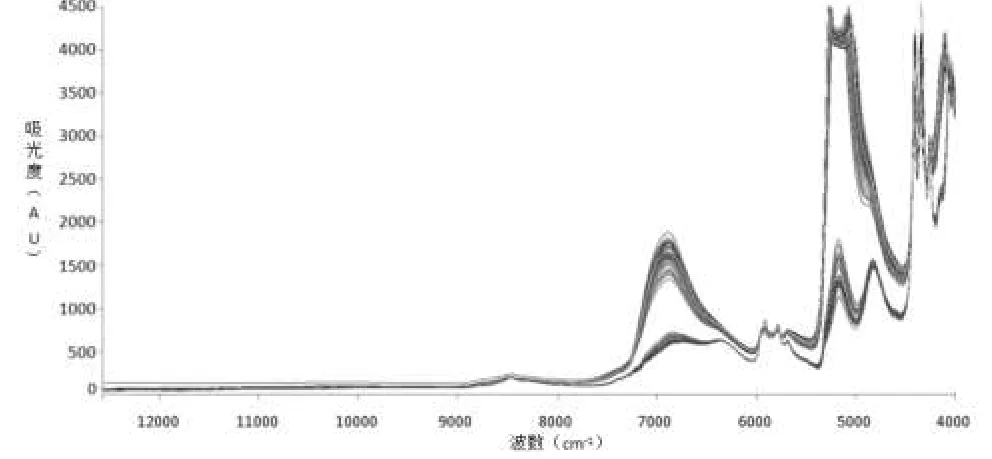
图1 为丹参样品的近红外图谱Fig1.TheNear-infrared spectra of Salvia miltiorrhiza samples
3.2.2 数据预处理和数据模型构建
利用定量分析软件建立校正模型,采用化学计量法将上述不同时间点收集的样品经扫描所得的光谱图和测得的UPLC含量值进行分析,选定光谱影响值和化学值误差Residual剔除测定的异常值,软件计算后得出的模型比较RMSECV和R2的大小,选择光谱范围和预处理方法建立4个较好的校正模型,采用外部验证,并以NIR数学模型的主要参数即R2和RMSECV为指标确定最佳模型,结果见表1,表2,表3,表4。 (软件为Bruker OPUS6.5/QUANT-2)
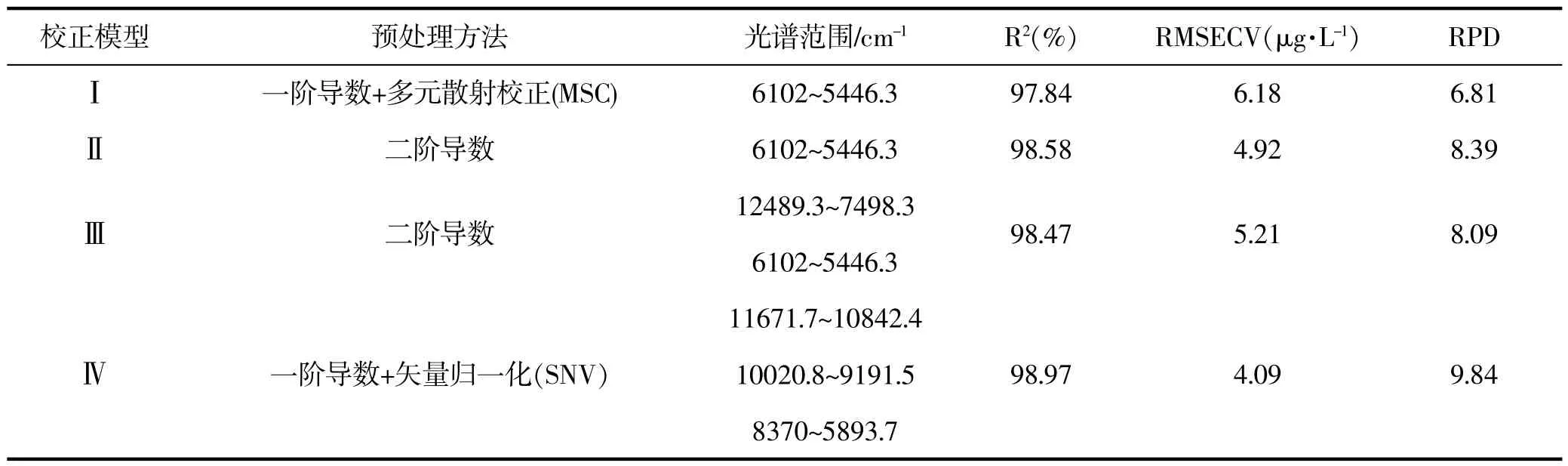
表1 不同预处理方法和谱区范围对二氢丹参酮模型的影响Table 1 Effect of different pretreatment methods and spectral region on model ofdihydrotanshinone

表2 不同预处理方法和谱区范围对隐丹参酮模型的影响Table2 Effects of different pretreatment methods and spectral regions on model ofcryptotanshinone
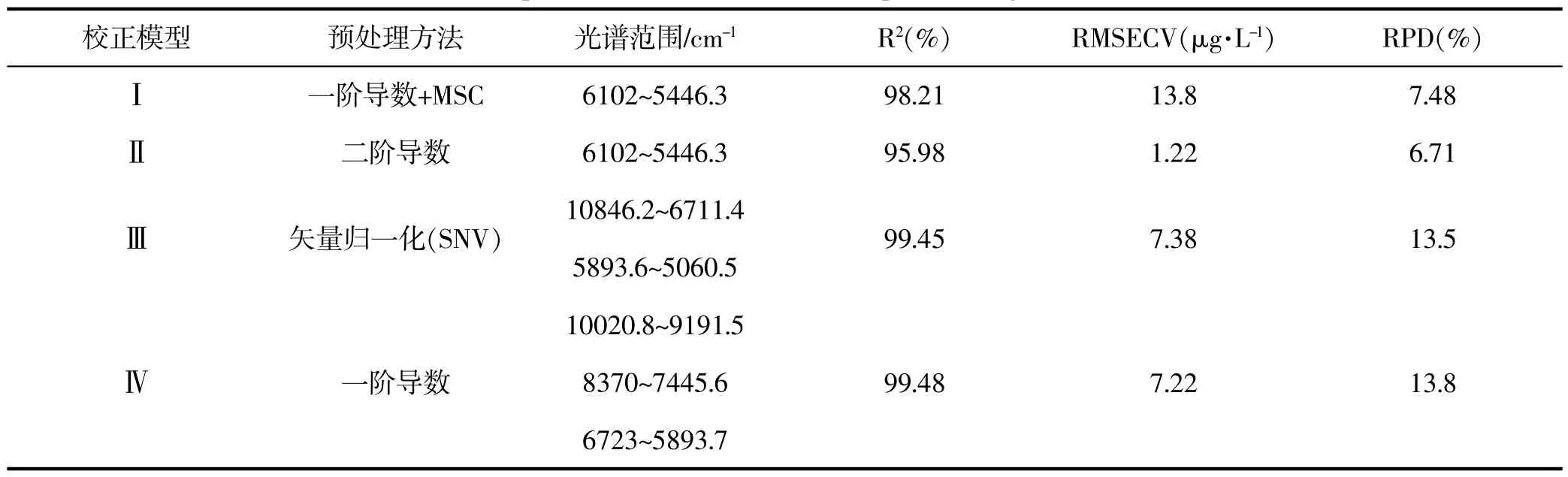
表3 不同预处理方法和谱区范围对丹参酮Ⅰ模型的影响Table 3 Effects of different pretreatment methods and spectral regions on model oftanshinoneⅠ
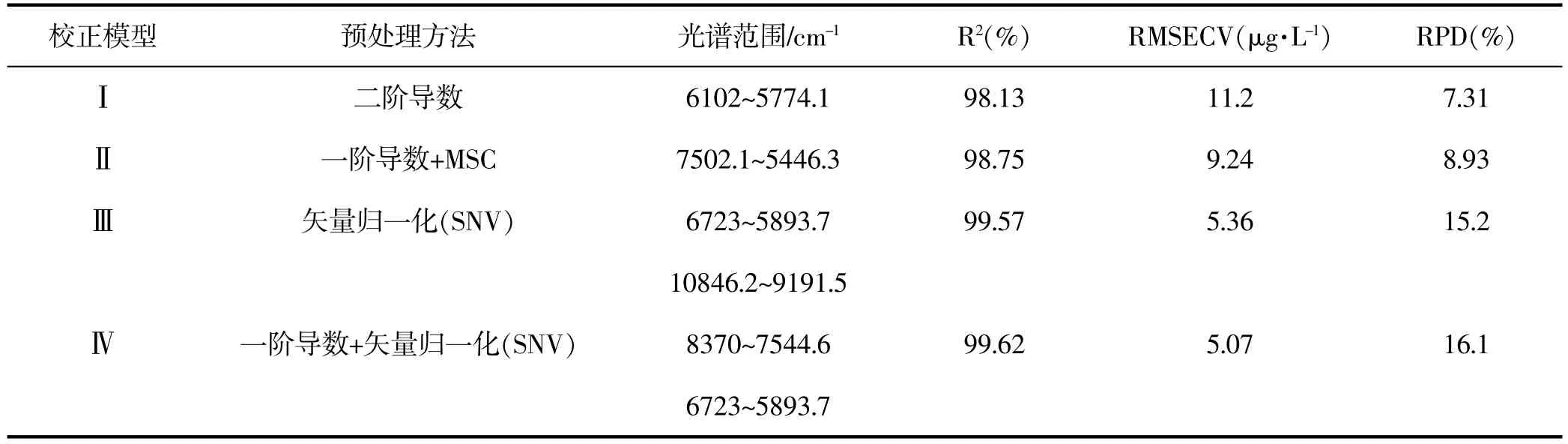
表4 不同预处理方法和谱区范围对丹参酮ⅡA模型的影响Table 4 Effects of different pretreatment methods and spectral regions on model oftanshinoneⅡA
由以上四个模型可看出,不同的预处理方法,在各波段下的光谱范围不同,线性关系都较良。
3.2.3 校正模型的验证和最优模型的选择
将检验样品集的二氢丹参酮等四个丹参酮类成分的UPLC测出的含量以及近红外光谱图关联到上述四个模型中,可计算出真实值和预测值之间的相关系数以及偏差,以下表5是各成分校正模型对检验样本集的预测结果相关系数和预测值与真实值之间的偏差的比较。
通过软件对四种校正模型中各成分的含量真实值及预测值之间进行比较计算,选择RMSEP和偏差(BIS)最小的模型即为最优模型。相关系数可见图2,图3,图4和图5。模型Ⅲ为二氢丹参酮的最佳校正模型;模型Ⅰ为隐丹参酮,丹参酮Ⅰ,丹参酮ⅡA的最佳校正模型。
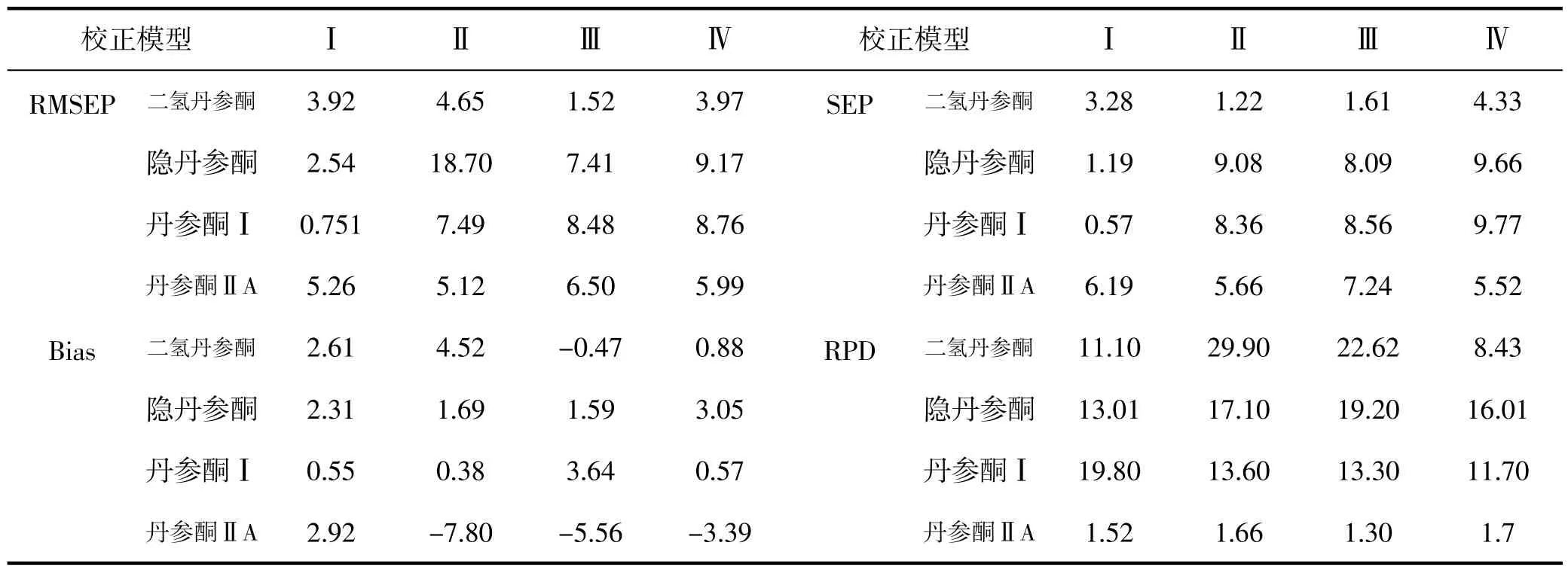
表5 四个校正模型对检验样本集的各成分预测结果的相关系数Table 5 The correlation coefficients of four calibration models for the test sample sets
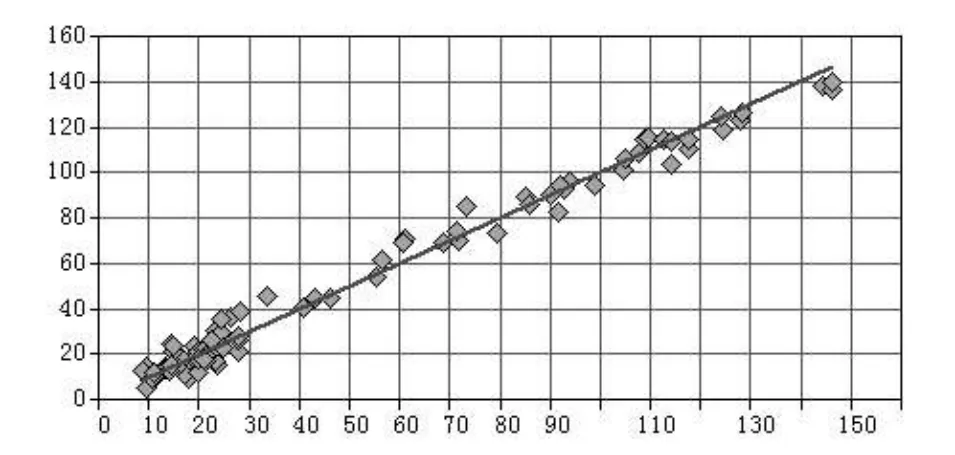
图2 二氢丹参酮的近红外测定值和色谱法测定值的相关系数图谱Fig 2 Correlation coefficient image of Near infrared values and UPLC values of dihydrotanshinone
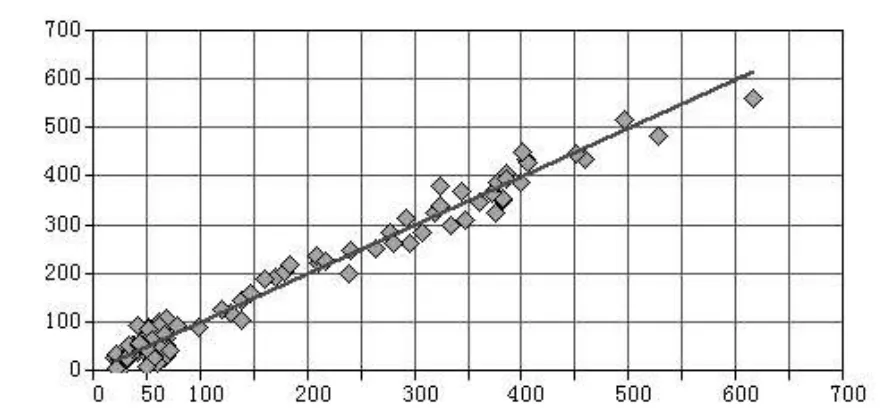
图3 隐丹参酮的近红外测定值和色谱法测定值的相关系数图谱Fig 3 Correlation coefficient image of Near infrared values and UPLC values of cryptotanshinone
3.2.4 模型稳定性与预测效果评价
3.2.4.1 精密度试验
取45min取的95乙醇提取的提取液1份,对该份样品重复扫描6次,扫描所得光谱和二氢丹参酮等四个丹参酮类成分的含量校正模型进行关联,测得二氢丹参酮,隐丹参酮,丹参酮Ⅰ,丹参酮ⅡA的含量RSD分别为1.73%,3.01%,2.78%,2.51%。由结果可知该校正模型精密度良好。
3.2.4.2 重现性试验
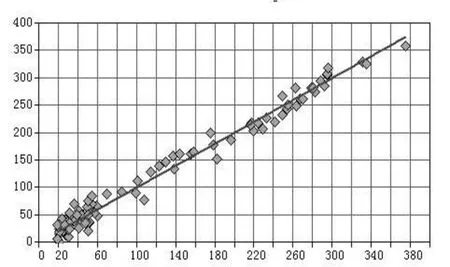
图4 丹参酮Ⅰ的近红外测定值和色谱法测定值的相关系数图谱Fig 4 Correlation coefficient image of Near infrared values and UPLC values of tanshinon
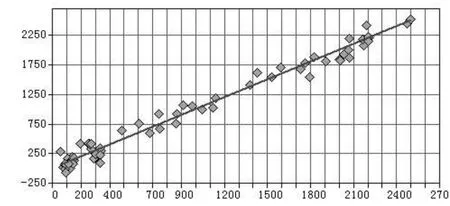
图5 丹参酮ⅡA的近红外测定值和色谱法测定值的相关系数图谱Fig 5 Correlation coefficient image of Near infrared values and UPLC values of tanshinoneⅡA
取45min取的95乙醇提取的提取液样品6份,分别扫描,扫描所得光谱和二氢丹参酮等四个成分的含量校正模型进行关联,进行计算。隐丹参酮,丹参酮Ⅰ,丹参酮ⅡA的含量RSD分别为1.19%,2.73%,1.64%,1.35%。由结果可知该校正模型的重现性良好。
3.2.4.3 模型预测效果的评价
为了检测模型是否有效,将模型计算出的二氢丹参酮等四个丹参酮类成分的NIR预测值与UPLC的实测值进行对比,结果见表6。由表6结果可知,真实值和模型校正预测值的平均偏差均小于5%,说明预测结果较为准确。本次研究所建立的复方丹参片中二氢丹参酮等四个丹参酮类成分的含量值相关性模型预测性能良好。

表6 丹参酮类成分的NIR预测值与UPLC的实测值对比/mg·g-1Table 6 Thepredictability of Tanshinones by NIR compared with that by UPLC/mg·g-1
4 结论
该研究将NIR分析技术应用于丹参的提取浓缩过程中的二氢丹参酮等四个丹参酮类成分的含量进行分析。建立二氢丹参酮等四个丹参酮类成分的NIR模型,可用于监测丹参提取浓缩过程中上述成分的质量变化过程,可用于指导丹参提取浓缩过程的终点,最终实现复方丹参片生产过程中的全程实时质量监控及终点判断,可尝试用于工厂大生产时的含量实时在线监测。当需要检测样品的时间或空间条件与建模时不同,必须用检验集样品检验该模型。如果最终模型的预测效果降低,真实值和模型校正预测值的平均偏差过大,就需要在校正集样品增加这一检验样品,并再次按原步骤修改校正集样品,稳定准确的模型需要在使用的过程中不断的维护与完善。

