阿帕替尼联合紫杉醇及奈达铂方案治疗复发性宫颈鳞癌的疗效观察
赵江萍,李爱军,牛亚蒙,贾艳艳
(郑州大学第一附属医院妇科,河南 郑州 450052)
宫颈癌是全球女性发病率第3位的恶性肿瘤[1],每年全球有超过20万人死于宫颈癌[2]。宫颈癌经过标准手术治疗或放化疗后,愈后良好,但仍有一部分出现局部复发或远处转移,复发性宫颈癌治疗难度大,愈后差,这也是宫颈癌致死的主要原因。近年来,抗血管生成靶向治疗成为了一个新的研究热点,这也为宫颈癌患者带来新的治疗方法。阿帕替尼是一种新型抗血管生成药物,其高度选择性竞争血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)内的ATP结合位点,抑制磷酸化从而阻断下游信号通路的激活,最终抑制肿瘤的血管生长。目前阿帕替尼已应用于胃癌、乳腺癌、肺癌、肝癌、食管癌、结直肠癌等实体瘤治疗中,并取得了一定疗效[3],但在宫颈癌中报道甚少。因此本研究对阿帕替尼联合紫杉醇及奈达铂方案治疗复发性宫颈癌的疗效和安全性进行了探讨,现报道如下。
1 资料与方法
1.1 一般资料收集2018年3月至2019年3月就诊于郑州大学第一附属医院的复发性宫颈鳞癌患者。纳入标准:1)经过初始根治性治疗后6个月后,盆腔或远处再次出现肿瘤的宫颈鳞癌患者;2)结合患者临床症状、肿瘤标志物、病理及影像检查综合诊断为宫颈鳞癌复发患者;3)患者一般情况可,KPS评分≥60分,能配合治疗;4)无明显心、肝、肾功能异常;5)未使用其他靶向治疗药物;6)无高血压失控。排除标准:1)初发性宫颈癌及其他非鳞癌复发;2)一般情况差,KPS评分<60分,不能配合治疗;3)存在严重心、肝、肾功能疾病;4)使用其他靶向治疗药物或化疗药物;5)高血压失控。最终40例患者纳入本研究,年龄31~64岁,按治疗方法分为2组,每组20例。本研究经我院伦理委员会批准通过,患者均签署入组知情同意书。
1.2 治疗方法对照组患者给予紫杉醇及奈达铂方案化疗:第1天给予紫杉醇(南京绿叶制药有限公司,商品名:力扑素,国药准字:YBH20030357,30 mg/支)135 mg/m2,第2天给予奈达铂(南京先声东元制药有限公司,商品名:捷佰舒,国药准字:YBH08642008,10 mg/支)80 mg/m2,21 d为1个周期。实验组:在给予紫杉醇及奈达铂方案化疗基础上,加用甲磺酸阿帕替尼片(江苏恒瑞医药股份有限公司,国药准字H20140103,0.25 g)250~500 mg/d,餐后30 min服用,21 d为1个周期。2组均在4个周期治疗结束后14 d评价近期疗效及不良反应。治疗期间均给予护胃止吐,肝、肾功能保护等对症治疗。
1.3 疗效评价
1.3.1 近期疗效 患者接受治疗前,行胸腹计算机断层扫描及盆腔磁共振成像明确转移部位及复发病灶大小,治疗结束后再次行影像学及其他相关检查,根据实体瘤疗效评价标准RECIST 1.1对近期疗效进行评定[4],分为完全缓解(complete response,CR)、部分缓解(partial response, PR)、疾病稳定(stable disease,SD)及疾病进展(progressive disease, PD)。以CR+PR计算客观缓解率(objective response rate, ORR),以CR+PR+SD计算疾病控制率(disease control rate,DCR)。
1.3.2 随访及远期疗效 治疗期间第1个月每天检测血压,每周检测血、尿常规,观察2组的疾病无进展生存时间(progression free survival, PFS),即开始用药治疗至肿瘤出现明确进展的时间。随访截止至2020年3月31日。
1.4 不良反应评价方法采用CTCAE V4.0不良反应分级标准[5],比较观察2组患者治疗期间骨髓抑制、高血压、蛋白尿、手足综合征、恶心呕吐,肝功能损伤等不良反应的发生情况。

2 结果
2.1 2组患者一般资料比较实验组年龄31~64(50.3±8.9)岁,对照组年龄38~64(49.0±6.6)岁,比较差异无统计学意义(t=0.524,P=0.603)。肿瘤转移部位、初始治疗方式、FIGO分期及病理分级的差异无统计学意义。见表1。
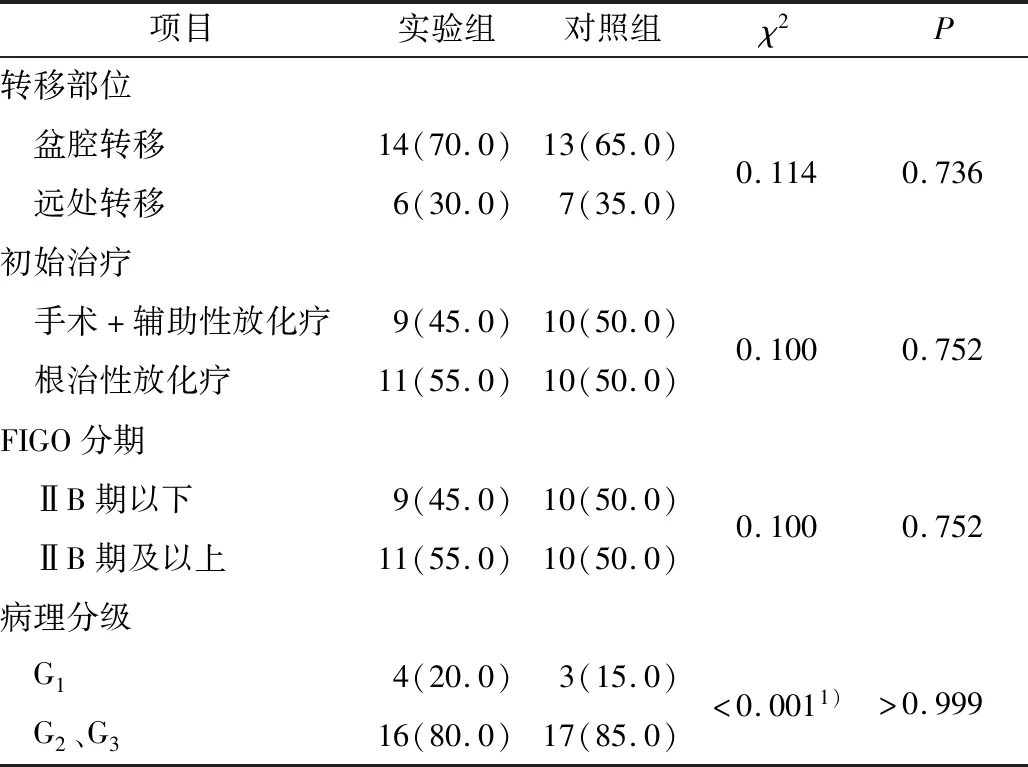
表1 2组患者一般资料比较 n(%)
2.2 2组患者近期疗效比较实验组ORR、DCR分别为65.0%、90.0%,高于对照组的40.0%、75.0%,差异均有统计学意义(χ2=2.506,P=0.113;χ2=0.693,P=0.049)。见表2。
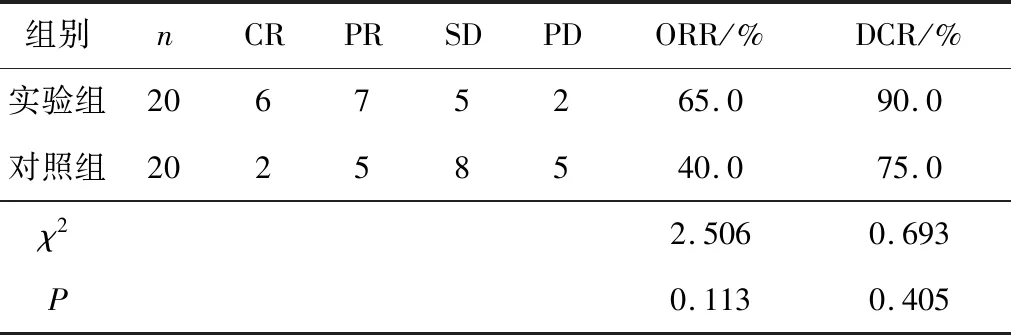
表2 2组患者近期疗效比较 n(%)
2.3 2组患者远期疗效比较实验组中位PFS时间为7.4个月(95%CI为5.9~8.9个月),对照组为5.7个月(95%CI为4.4~7.0个月),2组患者PFS生存曲线差异有统计学意义(χ2=4.387,P=0.036)。截止至2020年3月31日,实验组1例死于PD,对照组1例死于PD,1例死于肺栓塞。2组均无失访病例,中位随访时间12.3(5.3~24.8)个月。
2.4 2组患者不良反应发生情况比较实验组蛋白尿发生率为30.0%,高于对照组的0.0%,差异有统计学意义(χ2=4.902,P=0.027)。2组患者中共4例出现Ⅲ、Ⅳ度不良反应。其中实验组1例患者出现Ⅲ度高血压减药,1例因Ⅲ度手足综合征减药,1例出现Ⅲ度骨髓抑制,给予暂停用药并给予升血小板对症处理;对照组1例因Ⅳ度骨髓抑制给予暂停化疗并给予升白对症治疗。2组不良反应均得到有效控制,未出现与不良反应相关的死亡。见表3。
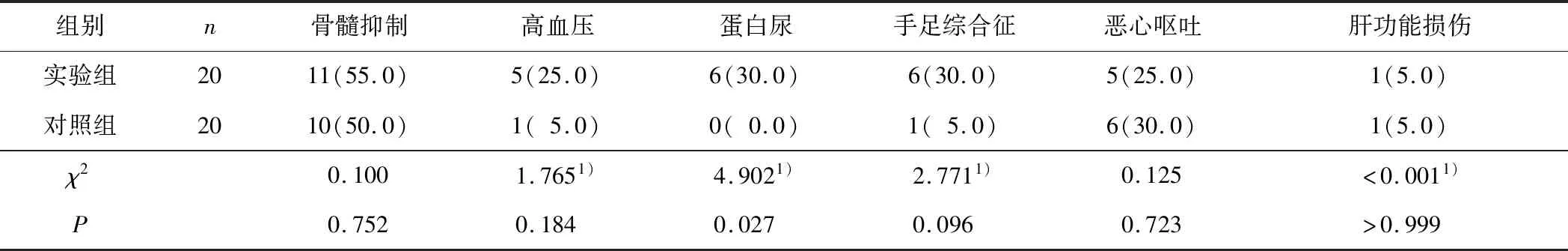
表3 2组患者不良反应发生情况比较 n(%)
3 讨论
宫颈癌复发后由于首次治疗的手术、放疗、化疗史,再次治疗时往往比较棘手,如何延长患者的生存时间和提高患者的生活质量面临着巨大的挑战[6]。复发性宫颈癌一般已接受过全量放疗,再次放疗已不适用,全身化疗通常是绝大数患者唯一的治疗手段[7],目前临床医生多使用奈达铂、紫杉醇等药物进行化疗[8],该方案能有效抑制肿瘤进一步扩散,但最佳方案仍在不断的探索中。
近年来,分子靶向治疗在肿瘤治疗中取得了较好的疗效,抗肿瘤血管生成抑制剂贝伐单抗作为首个进入临床指南的治疗复发性宫颈癌的靶向药物,已得到多个临床试验证实[9],但其成本效益比较高,增加了患者的经济负担。而阿帕替尼是由我国自主研发的抗血管生成药物,已被纳入医保,可被大多数患者接受,并且阿帕替尼是口服药物,使用上非常方便。阿帕替尼主要作用机制是特异性的与血管内皮生长因子竞争结合VEGFR-2,从而阻断下游信号转导通路,抑制肿瘤的血管生长[10]。而血管生成是包括宫颈癌在内的大多数肿瘤发生、转移的关键过程,抗血管生成途径被证实是一种抑制宫颈癌进展的有效策略,尤其是晚期的宫颈癌[11-13]。阿帕替尼使用安全性高,受试者单次口服750 mg阿帕替尼96 h后,77%以尿液及粪便的形式排泄[14],其中经尿液排泄仅占7.02%。有研究[15]显示,阿帕替尼是治疗复发性或晚期宫颈癌的有效且耐受性良好的二线药物。但国内外文献报道阿帕替尼应用于宫颈癌的文章较少,因此本研究旨在探讨阿帕替尼联合化疗治疗复发性宫颈癌的治疗效果。
本研究结果显示,实验组近远期疗效均优于对照组,这表明在紫杉醇及奈达铂化疗基础上,增加阿帕替尼应用可以获得更好的疗效,并且能够改善患者的生存。
本研究结果还显示,实验组蛋白尿的发生率较对照组高,但2组患者大多数不良反应为轻度,出现重度不良反应的患者通过减量、暂缓化疗及对症治疗后均可缓解。本研究还发现实验组高血压及手足综合征发生率较高,但差异无统计学意义,这可能是由于本研究纳入数据较少的原因。但发生的高血压及不良反应均在可控范围内,可通过对症治疗来缓解。这表明阿帕替尼治疗复发性宫颈癌具有良好安全性。
综上所述,阿帕替尼联合紫杉醇及奈达铂方案治疗复发性宫颈癌有一定的疗效,能够改善患者的生存,且安全性较高。但本研究中纳入患者较少,存在一定的偏倚误差,还需更大的临床试验来证实。并且该方案也并非最佳方案,因此仍然需要寻找更有效的治疗方案,延长患者生存期,提高其生活质量,让患者获得最大的收益。

