程序性死亡受体1抑制剂联合安罗替尼治疗广泛期小细胞肺癌疗效和安全性
余旭旭,李向柯,杨闽洁,陈 钟,毛迎港,宋丽杰
(郑州大学第一附属医院肿瘤科,河南 郑州 450052)
根据全球癌症统计报告[1],2018年全球新发肺癌约209.4万,占新发肿瘤的11.6%,肺癌死亡人数约176.1万,占肿瘤性死亡人数的18.4%,是全球发病率最高的恶性肿瘤。肺癌是中国最常见的肿瘤,也是居第2位的致死性肿瘤[2]。小细胞肺癌约占原发性肺癌的15%~20%[3],是常见的一种神经内分泌肿瘤,相较于其他类型的肺癌,具有分化程度低、恶性程度高、远处转移早等生物学特征,预后差,死亡率高。晚期小细胞肺癌最常见的一线治疗手段是化疗[4],但二线及以后尚无标准方案。本研究回顾性分析接受程序性死亡受体1(programmed death 1,PD-1)抑制剂联合安罗替尼治疗的25例广泛期小细胞肺癌患者的临床资料,探讨PD-1抑制剂联合靶向治疗在小细胞肺癌中的疗效和安全性。
1 资料与方法
1.1 研究对象回顾性分析2018年1月至2020年6月郑州大学第一附属医院经组织病理诊断为小细胞肺癌的患者临床资料。纳入标准:病理诊断为小细胞肺癌;晚期不可切除、既往接受标准化疗后失败;具有可评估病灶;应用安罗替尼联合PD-1抑制剂治疗;预计生存时间>3个月。排除标准:原发部位不在肺的小细胞癌;临床分期早期可手术切除;既往尚未接受标准一线及以上化疗方案治疗;无可评估病灶;存在未控制的严重内科疾病。
1.2 病理诊断标准肺神经内分泌肿瘤诊断采用2015年WHO肺、胸膜、胸腺和心脏肿瘤分类标准[5],将肺神经内分泌肿瘤分为低级别典型类癌、中级别非典型类癌及高级别的小细胞肺癌和大细胞神经内分泌癌。
1.3 疗效及不良反应评价标准所有患者在接受PD-1单抗联合安罗替尼治疗后2~3个周期复查1次增强计算机断层扫描和(或)磁共振成像;根据RECIST 1.1标准[6]进行疗效评价,分为完全缓解、部分缓解、疾病稳定、疾病进展,以完全缓解+部分缓解计算有效率,以完全缓解+部分缓解+疾病稳定计算疾病控制率。疾病无进展生存时间定义为开始接受PD-1抑制剂联合安罗替尼方案至疾病进展或死亡的时间。依据美国国立综合癌症研究不良反应分级标准4.0版进行不良反应评价和分度[7]。
1.4 随访通过电话或短信方式进行随访,随访日期从接受本研究方案至疾病进展或死亡日期,末次随访时间2020年9月。
1.5 统计学处理采用SPSS 21.0分析数据,不符合正态分布的计量资料用范围和中位数表示,计数资料用百分数表示,用Kaplan-Meier法绘制生存曲线,检验水准α=0.05。
2 结果
2.1 临床资料共纳入符合入组标准的小细胞肺癌25例,其中男15例(60.00%)、女10例(40.00%),男女比32,年龄42~82岁,中位年龄56岁。应用PD-1单抗联合安罗替尼治疗前均有淋巴结及远处转移,且存在可测量病灶,其中11例(44.00%)骨转移、8例(32.00%)肝转移、8例(32.00%)脑转移、6例(24.00%)肺内转移、肾上腺转移5例(20%)、其他部位转移8例(32.00%,胸膜2例、胰腺2例、胸壁1例、肾脏1例、盆腔1例、心包1例)。所有患者既往接受过标准一线及以上化疗方案治疗后失败,其中3线及以上治疗失败7例(28.00%)。基本特征见表1。
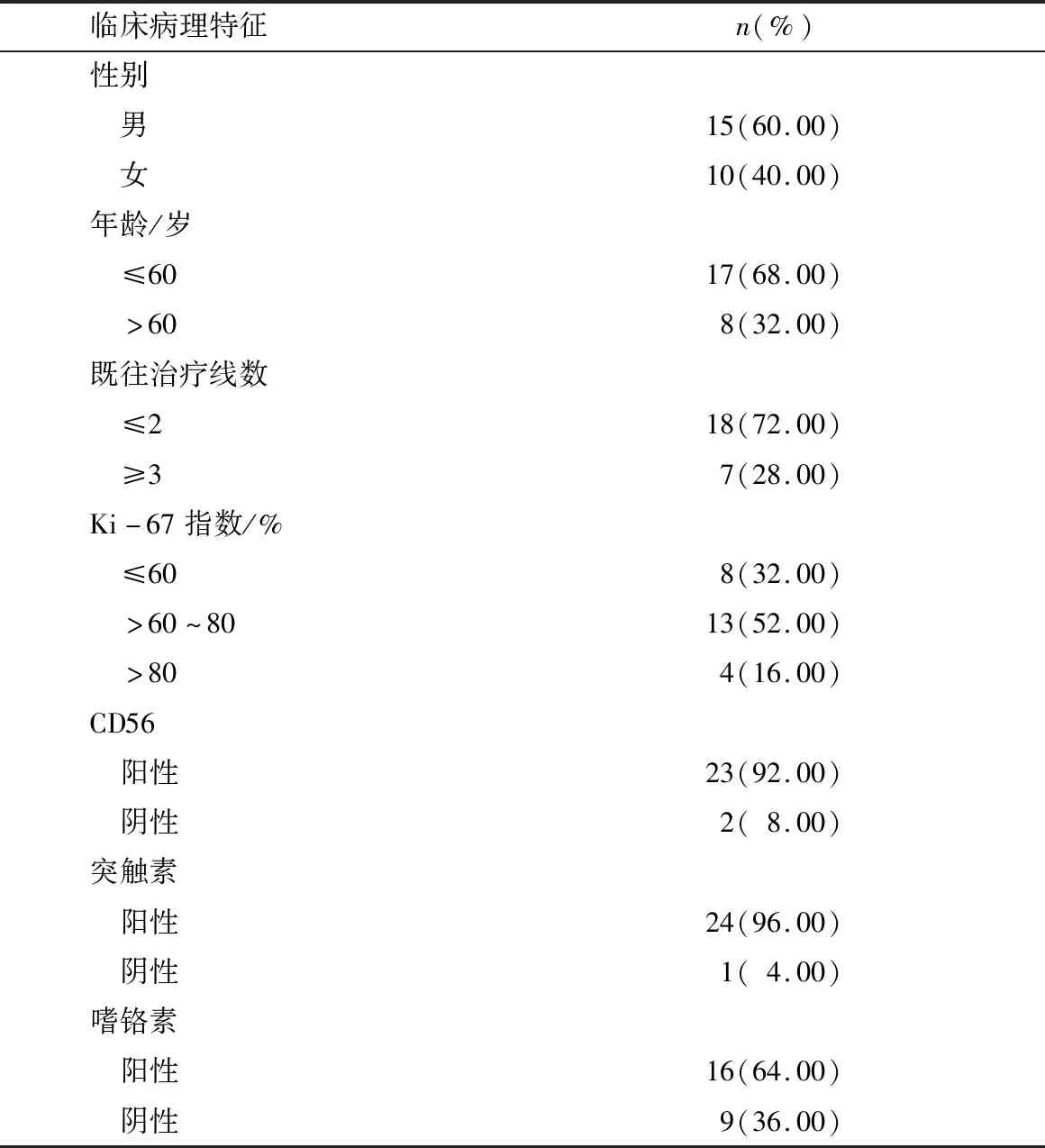
表1 25例广泛期小细胞肺癌患者临床病理特征
2.2 治疗情况截止2020年9月,所有患者接受3~14个周期的治疗,中位治疗周期数为7个。应用PD-1抑制剂包括特瑞普利单抗(8例)、卡瑞利珠单抗(7例)、信迪利单抗(10例)。PD-1抑制剂用药方法:特瑞普利单抗每次240 mg,3周1次;卡瑞利珠单抗和信迪利单抗每次200 mg,3周1次。安罗替尼12 mg/d,连续口服2周休息1周,每3周为1个周期。
2.3 疗效情况截至2020年9月,随访2~11个月,中位随访时间6.1个月。25例患者中3例(12.00%)部分缓解、11例(44.00%)疾病稳定、11例(40.00%)疾病进展[包括1例(4.00%)因疾病进展死亡]。有效率为12.00%(3/25,95%CI:3.00%~32.00%),疾病控制率为56.00%(14/25,95%CI:37.00%~73.00%)。中位疾病无进展生存时间为5.6(95%CI: 4.1~7.1)个月。
2.4 不良反应主要不良反应包括Ⅰ、Ⅱ度血液学毒性和消化道反应。所有不良反应经暂停“安罗替尼”及给予对症支持治疗后好转。见表2。
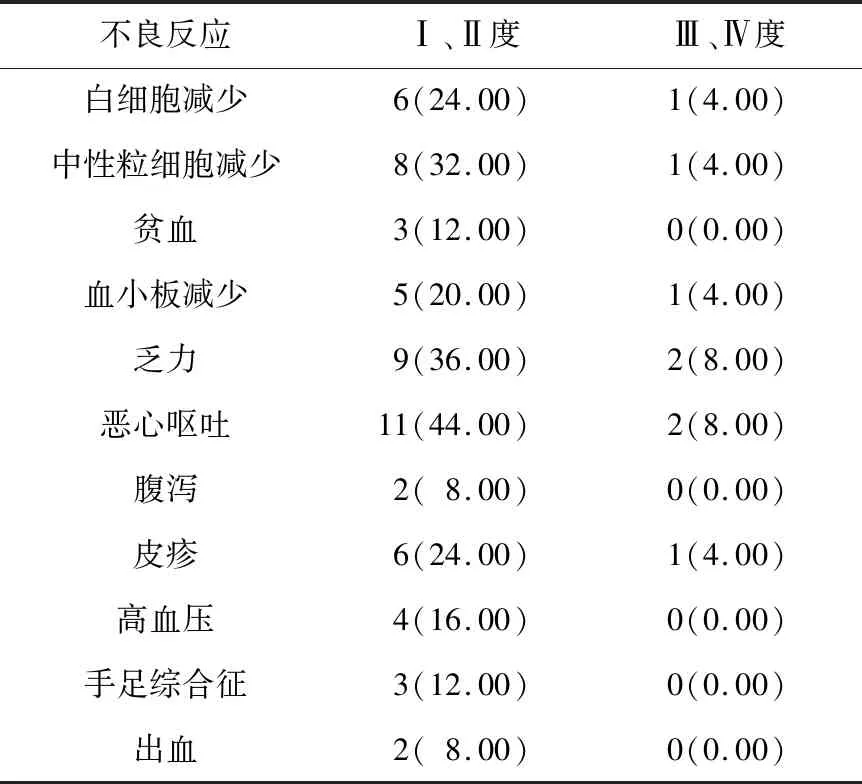
表2 PD-1抑制剂联合安罗替尼的不良反应 n(%)
3 讨论
小细胞肺癌恶性程度高、治疗药物少,预后差。肺神经内分泌瘤患者中位生存时间仅有7.6个月[8];小细胞肺癌5 a生存率不足10%[9],广泛期小细胞肺癌5 a生存率不足5%[10]。含铂双药方案化疗是晚期小细胞肺癌患者的标准一线治疗方案,但多在短期内出现疾病进展[11]且无标准二线及后续治疗方案。
免疫治疗的出现改变了肿瘤治疗的模式,且已在恶性黑色素瘤、非小细胞肺癌、肝癌等肿瘤治疗中取得显著疗效。此外,免疫治疗在小细胞肺癌中也显示出一定的疗效,但有效率仅10%~20%[12-13],疗效有限。抗血管生成治疗可改善肿瘤微环境,增强肿瘤免疫应答,提高肿瘤免疫治疗的疗效[14-16]。安罗替尼是一种多靶点小分子酪氨酸激酶抑制剂,可通过作用于血管内皮生长因子受体起到抗肿瘤血管生成的作用[17]。既往研究[18-19]显示安罗替尼在小细胞肺癌上也有一定的疗效。因此,免疫治疗联合安罗替尼成为小细胞肺癌治疗的新思路。
本中心回顾性研究显示,PD-1单抗联合安罗替尼治疗经标准化疗治疗失败后的广泛期小细胞癌,有效率为12.00%,疾病控制率为56.00%,中位疾病无进展生存时间为5.6个月。与其他免疫治疗联合化疗或靶向药物治疗小细胞肺癌研究结果相近。IMpower 133研究[20]结果显示,阿特利珠单抗联合化疗治疗广泛期小细胞肺癌的中位疾病无进展生存时间为5.2个月,结果与本研究相似。吴朝真等[21]研究发现,帕博利珠单抗联合奥拉帕尼作为二线方案治疗广泛期小细胞肺癌,其中位疾病无进展生存时间为5.93个月。一项 Ⅱ 期研究[22]显示,德瓦鲁单抗联合奥拉帕尼治疗铂耐药或复发的小细胞肺癌的有效率为10.5%,结果与本研究相似。本研究中发生的不良反应主要为Ⅰ、Ⅱ度血液学毒性和消化道反应,Ⅲ、Ⅳ度不良反应少,所有不良反应经暂停安罗替尼及对症治疗后好转。其中皮疹、乏力、腹泻等不良反应不能排除与PD-1抑制剂相关,暂未观察到明确与免疫相关不良事件发生。
PD-1抑制剂联合安罗替尼治疗广泛期小细胞肺癌显示出一定的疗效,耐受性好,是广泛期小细胞肺癌标准化疗治疗失败后的一种选择,但本研究是一项小样本的单中心回顾性研究,仍需进行随机对照研究进一步证实其疗效和安全性。

