猕猴桃“翠香”再生体系的建立
丁光雪,刘天天,辛纳慧,李钰媛,张乃群,杨 迪
(1 南阳幼儿师范学校,河南南阳,474150; 2 南阳农业职业学院,河南南阳,473000; 3 南阳师范学院生命科学与农业工程学院,河南南阳,473061)
美味猕猴桃(Actinidiachinensisvar.deliciosa)又称硬毛猕猴桃,属大型落叶藤本[1],在秦岭一带广为分布,休眠枝条冬季抗冻阈值在-18~-10 ℃[2],果实大,被有刺状长硬毛,维生素C含量40~350 mg/100 g,还含有丰富的糖类、有机酸、氨基酸等,不仅食用价值高,且具备清热、消炎、抗癌等药用价值。随着人们对美味猕猴桃的认识及现代育种技术的不断发展,选育出了大量的优质猕猴桃品种,如“徐香”[3]、“华美二号”[4]、“秦美”[5]、“贵长”[6]等。但对于苗木繁殖,生产上主要采用扦插、嫁接等方式[7],美味猕猴桃类扦插成活率普遍较低[8],春季嫁接又是猕猴桃溃疡病多发季节[9],影响猕猴桃产业的健康发展。组织培养具有不受生长季节限制、繁殖快、遗传性状稳定等特点[10],已成为猕猴桃苗木繁育的重要手段。
“翠香”猕猴桃也是选自美味猕猴桃,果肉呈翠绿色,味香且质地细腻[11],抗逆性强,是目前综合性状最好的中早熟品种,经济效益显著,广受消费者欢迎[12]。当前国内外对“翠香”猕猴桃组织培养的研究尚未见报道,因此,本研究利用带腋芽茎段为外植体,研究了“翠香”猕猴桃腋芽诱导、多代增殖、生根培养、驯化移栽的情况,建立了离体快繁体系,以期为“翠香”猕猴桃种质资源的保存及优质苗木生产提供技术参考。
1 材料与方法
1.1 材料
供试材料取自西峡县猕猴桃种植基地,取健壮的幼嫩枝条用于组培试验。
1.2 方法
1.2.1 取材时间、培养条件与消毒处理
取材时间为4—6月。培养条件为光照时间12 h/d,培养温度为(25±2)℃,光照强度为1 500~2 000 Lx,下述所有培养基均添加蔗糖30 g/L、琼脂6 g/L、调节pH值为5.8~6.0。将剪取的幼嫩枝条冲洗2 h,切为长约2~3 cm,带1~2个腋芽的茎段,置于超净工作台,先用75%酒精浸泡30 s,无菌水冲洗2次,再用0.1%升汞消毒7 min,无菌水冲洗5次,放于无菌滤纸上吸干表面水分,接种于腋芽诱导培养基培养。
1.2.2 茎段腋芽的诱导
带腋芽茎段经消毒处理后接种,茎段腋芽诱导培养基为MS,添加6-BA(2.0、3.0、4.0 mg/L),NAA(0.1、0.2 、0.3 mg/L),设9个处理,每个处理30瓶,每瓶1个茎段,重复3次,记录带腋芽茎段状态变化,于30 d后统计腋芽诱导率。
1.2.3 增殖培养
选择诱导出的健壮腋芽,切下接种至增殖培养基MS,添加6-BA(3.0、4.0、5.0 mg/L),NAA(0.4、0.5 、0.6 mg/L),设9个处理,每个处理30个芽,3次重复,50 d时记录增殖系数。再选择最优的增殖培养基,进行第二代、第三代增殖培养,30个芽,3次重复,记录数据,比较三代增殖系数的差异性。
1.2.4 生根培养
待芽长至2~4 cm时,切下转至生根培养基进行生根培养。生根培养基为1/2MS,分别含有不同浓度(0.7、0.9、1.1 mg/L)NAA、IBA,设6个处理,每个处理接种30个芽,重复3次,密切观察生根情况,40 d后记录生根率、根数和根长。
1.2.5 驯化移栽
生根培养得到的长势优良的幼苗放到自然环境条件下放置3~5 d,再开盖驯化2 d,定时进行叶片喷水保湿。然后,从瓶中取出组培苗,用清水洗净培养基,移栽到细砂土中,定时淋水,移栽20株,重复3次,30 d后统计移栽成活率。
1.2.6 数据处理及分析
诱导率(%)=诱导出芽的茎段(叶片、叶柄)数/接种的茎段(叶片、叶柄)总数×100%
增殖系数=诱导后不定芽总数/原接种芽数
生根率(%)=生根芽数/接种芽数×100%
移栽成活率(%)=存活苗数/移栽苗数×100%
运用Excel 2019整理数据,运用SPSS 22.0统计分析软件进行显著性分析和Duncan多重比较。
2 结果与分析
2.1 腋芽诱导
“翠香”猕猴桃带腋芽茎段培养7 d左右,基部切口会略肥大,14 d左右茎段基部切口处出现愈伤组织,呈浅绿色。由表1可知,“翠香”猕猴桃的腋芽诱导率随6-BA浓度的增加,在NAA浓度为0.1 mg/L时,呈现为“低—高—低”,在NAA浓度为0.2、0.3 mg/L时,逐渐降低;当6-BA浓度一定时,随NAA浓度的升高,6-BA的浓度为2.0 mg/L时,诱导率呈现为逐步升高,6-BA的浓度为3.0、4.0 mg/L时,逐渐降低;在6-BA的浓度为2.0 mg/L、NAA的浓度为0.3 mg/L时,腋芽诱导率达到最高88.89%,其次是6-BA 2.0 mg/L、NAA 0.2 mg/L时,达到87.78%,接着是6-BA 3.0 mg/L、NAA 0.1 mg/L时,达83.33%,三者间在0.05水平上无显著差异,但与其余处理相比存在显著差异;诱导率最低的是6-BA 4.0 mg/L、NAA 0.3 mg/L,仅3.33%,茎段多褐化。
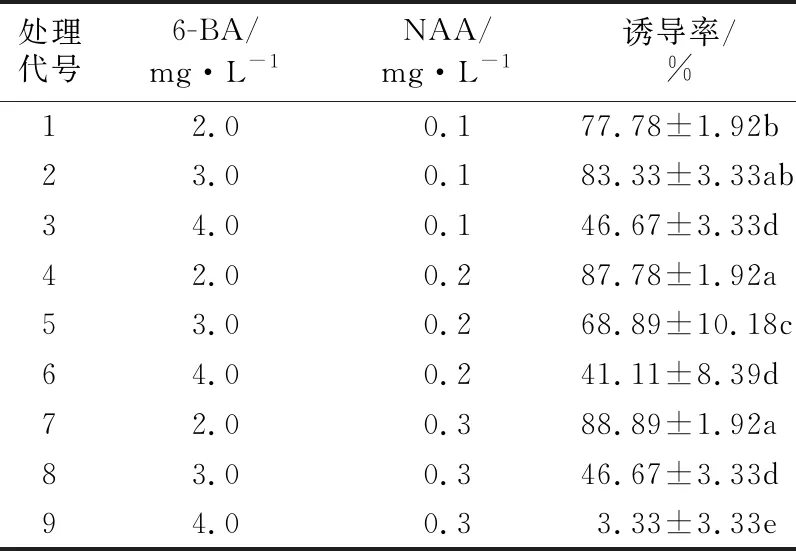
表1 植物生长调节剂配比对“翠香”猕猴桃茎段腋芽诱导的影响
从表2方差分析可以看出,在“翠香”猕猴桃茎段腋芽诱导过程中,细胞分裂素6-BA对诱导率影响最大,其F值270.279,在0.01水平达到显著,6-BA、NAA、6-BA与NAA组合均在0.01水平显著影响诱导率。结合表1,筛选出“翠香”猕猴桃茎段腋芽诱导最佳培养基为MS+6-BA 2.0 mg/L+NAA0.3 mg/L,诱导效果良好(见图1)。
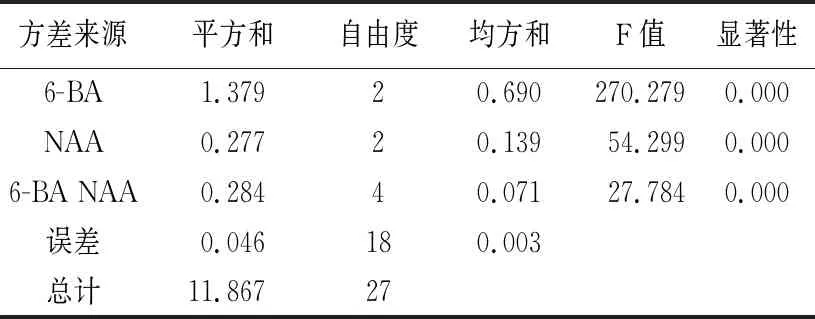
表2 “翠香”猕猴桃茎段腋芽诱导的方差分析

图1 “翠香”猕猴桃茎段腋芽萌发
2.2 增殖培养
在增殖培养过程中,观察到有些生长状态良好的芽在接种1周左右就会长出少量的愈伤组织,在接种后的第14 d会发现愈伤组织上长出了芽点。接种后3周左右会发现所有不定芽的基部都会形成愈伤组织块且有大量的芽点产生。30~40 d,之前观察到的不定芽点会长成健壮的不定芽,叶和茎也都有适当的分化(见图2:左)。在40~50 d时丛生芽基本上不会继续增殖,只有叶和茎会继续生长。50 d以后,部分芽会出现褐化现象。表3呈现的是50 d时记录的接种芽增殖情况,由表3可以看出,7号植物生长调节剂组合的试验结果最好,增殖系数为6.20,其培养瓶内的丛生芽茎叶分化适中,长势好,与其他增殖系数在0.05水平上差异显著;3号植物生长调节剂组合的增殖系数最低,为2.11,培养瓶中的芽黄、畸形且只有个别芽增殖。试验结果表明,当NAA浓度为0.4 mg/L时,增殖系数随6-BA浓度的增加而增大;当NAA浓度为0.5、0.6 mg/L时,增殖系数也随6-BA浓度的增加而增大,但其增殖系数的最大值均小于NAA为0.4 mg/L时的最大值,故增殖系数在6-BA为5 mg/L时取得最大值。当6-BA的浓度一定时,增殖系数随NAA浓度的增加而减小,可见,NAA浓度为0.4 mg/L时适合“翠香”猕猴桃不定芽的增殖。因此,“翠香”猕猴桃不定芽增殖的最佳植物生长调节剂组合为MS+6-BA 5 mg/L+NAA 0.4 mg/L。

图2 “翠香”猕猴桃增殖培养
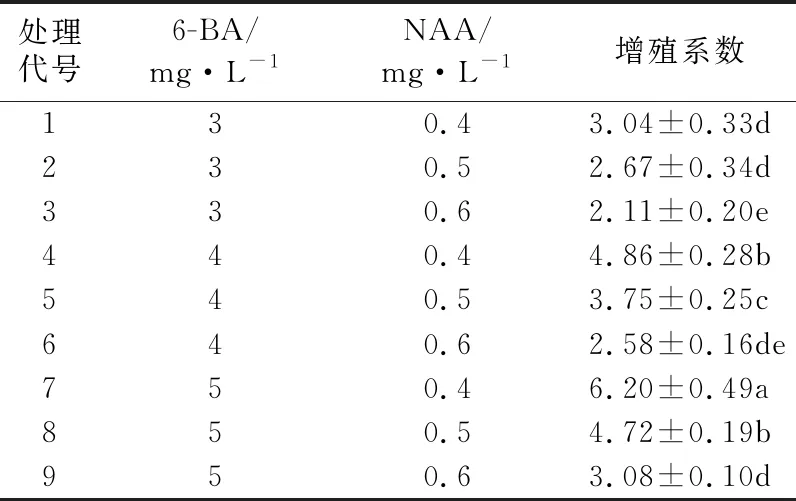
表3 不同浓度组合的6-BA、NAA对“翠香”猕猴桃不定芽增殖的影响
选择MS+ 6-BA 5 mg/L+NAA 0.4 mg/L培养出来的芽,继续进行第2代、第3代增殖。试验中发现,第2代增殖的芽长势正常,大部分芽可清晰观察,增殖效果较好(见图2:中),第3代增殖芽大多数都长势好,叶片平展(见图2:右),只有个别叶片卷曲,稍有畸形。由图3可知,培养3代的增殖系数在0.05水平上无显著差异,第2代继代培养的增殖系数略高于第1代的,到第3代时略有下降,但总体上增殖系数比较稳定。

图3 “翠香”猴猴桃3次继代增殖的差异比较
2.3 生根培养
由表4可知, NAA或IBA单独作用时,“翠香”猕猴桃芽的生根率均较高,最高的是IBA 1.1 mg/L处理,达95.56%;其次是IBA 0.9 mg/L,达94.44%;最低的是NAA 0.7 mg/L,为86.67%,所有处理的生根率无显著差异。根数最多的为IBA 0.9 mg/L处理,达11.40条,与其余5个处理有显著差异,其余5个处理根数间无显著差异,根数最少的为NAA 1.1 mg/L,根数的变化随IBA或NAA浓度的升高先增后减。根长最长的处理为IBA 0.9 mg/L,平均长度为2.94 cm,除IBA 0.7 mg/L处理的根长外,显著长于其他处理,而IBA 0.7 mg/L根长的平均长度为2.69 cm,两者有一定差距,根长最短处理为NAA 0.7 mg/L,平均长度为2.30 cm,根长的变化也是随IBA或NAA浓度的升高先增后减。综上所述,筛选出“翠香”猕猴桃生根培养的最佳培养基为1/2MS+IBA 0.9 mg/L,生根效果良好(见图4)。

图4 “翠香”猕猴桃的生根培养

表4 不同浓度植物生长调节剂对“翠香”猕猴桃生根的影响
2.4 驯化移栽
移栽30 d后统计,“翠香”猕猴桃组培苗的移栽成活率为(88.33±7.63)%,长势健壮(见图5,图6)。

图5 “翠香”猕猴桃移栽30 d后的根系

图6 “翠香”猕猴桃移栽30 d后的苗
3 讨论
在已报道的猕猴桃组织培养中,除了茎段,叶片[13]、叶柄[14]、花药[15]等培养也有报道,而带腋芽茎段培养是离体快繁最有效、遗传最稳定的途径。本研究采用“翠香”猕猴桃的带腋芽茎段为外植体,腋芽诱导率为88.89%,与源自美味猕猴桃的其他品种相比[16-17],诱导率略低,说明“翠香”猕猴桃茎段腋芽诱导有待进一步优化。经过方差分析,发现6-BA对腋芽诱导影响最大,NAA也有显著影响,两者共同作用于腋芽诱导,但当植物生长调节剂浓度过高时,诱导效果很差。这与隆前进等[18]在“红阳”猕猴桃中、杨迪等[19]在“杨氏金红50号”中的研究结果一致,因此,植物生长调节剂配比决定着初代培养是否成功。
增殖培养基中,6-BA、NAA组合能有效促进丛生芽形成,最高增殖系数为6.20,与其他研究有一定差异。隆前进等[18]培养“红阳”的最高增殖系数为4.5,吴秀华等[20]培养“海沃德”的最高增殖系数为6.38,张艳玲等[21]培养“秦美”猕猴桃的最高增殖系数为6.43。可见,不同品种猕猴桃进行组织培养的最佳植物生长调节剂浓度组合是不同的,这与基因型的不同关系很大。本研究在做了3代增殖后发现,增殖系数第3代有降低,个别叶片出现畸形。赵芮[22]以软枣猕猴桃组培苗为材料进行继代增殖,发现其最佳的增殖周期为40 d,当继代的时间大于40 d时,增殖系数降低,叶片开始失绿、畸形甚至脱落。最佳的继代次数为6次,在第3~5次时,增殖系数逐渐增大,在第6次时增殖系数达到最大值,在第7~9次时,增殖系数逐渐降低,丛生芽生长变慢,叶片卷曲且畸形较多;张玉杰[23]以狗枣猕猴桃为材料做了7代继代培养,在1~5代时增殖系数会逐渐增加,不定芽长势健壮,叶片平展,6~7代时叶片开始出现卷曲、畸形,增殖系数降低。本次试验的增殖周期为40 d,与赵芮[22]、张玉杰[23]所得的结论一样,多代增殖效果的差异再次说明基因型的不同影响着猕猴桃的组织培养效果。
生根培养在组织培养中直接影响组培苗的移栽成活率。“1/2MS+IBA”对猕猴桃生根效果显著。黄胜男等[24]所做的“金魁”猕猴桃的最佳生根培养基为“1/2MS+ IBA 0.7 mg/L”;吕海燕等[25]所做的“东红”猕猴桃的最佳生根培养基为“1/2MS+ IBA 0.5 μg/mL”;本研究得出的最佳生根培养基为“1/2MS+ IBA 0.9 mg/L”,生根率、根数、根长均表现良好,移栽30 d后的苗根系明显更加健壮发达。因此,本研究可为“翠香”猕猴桃种苗快繁提供技术支持。

