人参皂苷Rg1对慢性应激小鼠抑郁样行为、海马突触蛋白及胶质细胞的作用
王 娟,申丰铭,张峥嵘,朱国旗
(安徽中医药大学新安医学教育部重点实验室,合肥230038)
抑郁症已经成为全球疾病负担的重要原因之一[1],目前尚无有效治疗手段。海马是一个重要的脑区,在情绪调节中发挥重要作用,同时也是抑郁研究较为广泛的脑区[2]。在抑郁症的病因学研究中,突触的作用已引起越来越多的关注。在抑郁动物模型中,突触可塑性的调节出现异常[3-4],以突触后致密蛋白-95(Postsynaptic density protein 95, PSD-95)、活性调节细胞骨架相关蛋白(Activity-regulated cytoskeleton-associated protein, Arc)和脑源性神经营养因子(Brain-derived neurotrophic factor, BDNF)等的表达下降为典型[5-6]。炎症是抑郁发病的另一个重要机理,已发现抑郁患者血清中炎症生物标志物水平增加[7-8],而星型胶质细胞和小胶质细胞活化是炎症发生重要的源头[5]。人参皂苷Rg1是中药人参的主要活性成分,具有调控可塑性、抗氧化、改善学习记忆等生物学活性[9]。研究表明人参皂苷Rg1具有改善小鼠抑郁样行为[10]。但是人参皂苷Rg1对抑郁干预的机理,特别是对海马突触可塑性和炎症反应的调节仍然未知。本研究通过慢性温和不可预见应激模型(Chronic unpredictable mild stress, CUMS)研究人参皂苷Rg1对抑郁样行为的干预作用,并利用免疫印迹以及免疫荧光等方法,从炎症反应和突触可塑性两个方面探讨人参皂苷Rg1干预CUMS小鼠抑郁样行为的机理。
1 材料与方法
1.1 动物与药物
30只雄性C57BL/6小鼠(2月龄,体重:20~25 g),购于安徽医科大学实验动物中心(SCXK(皖)2016-0009)。将小鼠饲养在温度为22 ℃±2 ℃,相对湿度为45%~65%的环境中,经历12 h的明/暗循环,可随意饮水和摄食。实验方案由安徽中医药大学伦理委员会监督。人参皂苷Rg1(HPLC ≥ 98%,源叶生物科技,上海,中国)。
1.2 动物分组、造模与给药
30只雄性C57小鼠喂养一周适应环境,然后将小鼠随机分为5组,每组6只小鼠(n=6),分别是正常组、CUMS模型组、CUMS+人参皂苷Rg1高、中、低剂量给药组(给药剂量分别是40、20 和10 mg/kg)。
在CUMS造模期间,一共使用8种刺激:夹尾5 min,饮食剥夺24 h,饮水剥夺24 h,昼夜颠倒24 h,束缚2 h,电击(3次,强度为1 mA,持续2 s),潮湿环境2 h,热刺激(45 ℃~50 ℃,5 min),每天随机抽取两种刺激,使小鼠无法预测刺激,共计28 d;人参皂苷Rg1组在第21天后开始进行腹腔注射给药(40、20 和10 mg/kg,每天1次),正常组和CUMS模型组腹腔注射等量的生理盐水。给药一周后进行行为学测试,收集海马组织(图1)。

图1 实验流程
1.3 实验观测指标
1.3.1 糖水偏好
每次测试时,将2个瓶子的位置进行颠倒。在小鼠适应期间,训练其品尝蔗糖水。待适应完成后,禁水24 h后进行蔗糖偏好测试。通过量筒记录糖水的消耗,每周测试一次。蔗糖偏好指数=蔗糖消耗量/饮水总量×100%。
1.3.2 体重变化
从第1周开始,称量小鼠体重,每隔1周测1次,共计5次,并记录数据进行分析。
1.3.3 悬尾实验(Tail suspension test,TST)
将小鼠放在测试房间中1 h适应环境。在安静的环境中进行TST,在小鼠尾端2 cm处固定,使小鼠保持倒挂状态,头部距台面约50 cm,两侧用板隔开动物视线。允许其运动6 min,并通过Supermaze软件(上海欣软信息科技)记录其行为。前2 min是适应期,记录后4 min小鼠的不动时间。
1.3.4 旷场实验(Open field test,OFT)
将小鼠置于立方体室的中心[400 mm(W)×400 mm(H)×400 mm(D)],并使其自由移动5 min。使用自动分析系统(上海欣软信息科技)比较各组之间的站立次数,中心路程与总路程的比值。
1.3.5 强迫游泳(Forced swimming test,FST)
将小鼠分别置于水温为22 ℃±3 ℃的2 000 mL玻璃容器中,允许动物运动6 min,并通过Supermaze软件(上海欣软信息科技)记录其行为。前2 min是适应期,记录后4 min小鼠的不动时间。
1.3.6 蛋白免疫印迹(Western Blot, WB)
从各组获得来自动物的海马组织,匀浆并裂解,使用BCA试剂盒(Beyotime Institute of Biotechnology)检测蛋白质浓度。蛋白样品通过十二烷基磺酸钠聚丙烯酰胺凝胶电泳(12%体积分数凝胶)在110 V下分离60 min,并在200 mA下转移到硝酸纤维素膜上2 h。在室温下,将膜用5%质量分数脱脂牛奶(溶于含0.1%体积分数Tween-20的PBS中)封闭2 h,然后在4 ℃下与相应抗体孵育过夜:PSD95(1∶ 1 000; Cell Signaling Technology, Danvers, MA, USA);Arc(1∶ 1 000; Synaptic Systems, Goettingen, Germany);GFAP(1∶ 1 000; Beyotime, Beijing, China);Iba1(1∶ 1 000; Beyotime, Beijing, China);BDNF(1∶ 1 000; Novus, Colorado, USA);NF-κB(1∶ 1 000; Cell Signaling Technology, Danvers, MA, USA);β-actin(1∶ 1 000; Cell Signaling Technology, Danvers, MA, USA),随后在室温下与过氧化物酶偶联的山羊抗兔IgG或山羊抗鼠IgG(1∶ 10 000; Zs-Bio, Beijing, China)孵育2 h。使用ImageJ软件对图像进行分析,计算条带的光密度值。
1.3.7 免疫荧光(Immunofluorescent staining)
全脑于4 ℃在质量分数4%的多聚甲醛中固定24 h后,在质量分数30%的蔗糖水中脱水24 h,并在冷冻切片机上切片,厚度为20 μm。将切片在含有体积分数10%山羊血清和体积分数0.4%Triton X-100的0.1 mol/L磷酸盐缓冲盐水(PBS)中封闭1 h。然后在4 ℃下与相应的一抗孵育过夜:GFAP(1∶ 100, Beyotime, Beijing, China)。将切片在PBS中洗涤3次(每次15 min)。并与荧光素(FITC)标记的山羊抗小鼠IgG H&L(Alexa Fluor®488)(1∶ 200, Life Technologies, Carlsbad, CA, USA)室温下孵育2 h,DAPI复染细胞核,封片。用FV1000 Olympus激光共焦扫描显微镜(Olympus, Tokyo, Japan)拍摄图像(放大倍数:×200)。
1.3.8 统计分析
应用统计学软件GraphPad Prism 5.0进行统计分析,数据用平均数±标准差表示,统计分析使用方差分析(ANOVA)进行,并使用Bonferroni分析组间差异,以P值小于0.05代表差异有统计学意义。
2 结果与分析
2.1 人参皂苷Rg1减轻CUMS诱导的抑郁样行为
第一周各组小鼠体重没有显著差异[图2(a),P>0.05)]。而在CUMS造模后的一周,除正常组外的小鼠体重均有下降趋势[图2(a)],而给予人参皂苷Rg1后,小鼠的体重较模型组有明显的上升趋势,其中以20 mg/kg组和40 mg/kg组小鼠体重上升较显著[图2(a),P<0.05]。与正常组相比,CUMS应激后的小鼠对糖水的喜好程度明显偏低(P<0.05);而与CUMS模型组比较,人参皂苷Rg1给药组对糖水的喜好程度有上升趋势,其中以20 mg/kg组和40 mg/kg组小鼠上升较为显著[图2(b),P<0.05]。
模型组小鼠较正常组小鼠在悬尾实验[图2(c)]和强迫游泳实验[图2(d)]中的不动时间均显著增加(vs 正常组,P<0.05)。人参皂苷Rg1组小鼠不动时间均显著减少(vs 模型组P<0.05)。旷场实验中,各组小鼠之间的站立次数[图2(e),P>0.05]及在中心路程与总路程之比无显著性差异[图2(f),P>0.05]。

(a)小鼠体重变化;(b)糖水偏好指数;(c)悬尾实验后4 min的不动时间;(d)强迫游泳实验后4 min的不动时间;(e)旷场实验中小鼠站立次数;(f)旷场实验中小鼠中心路程/总路程。每组6只(n=6), #:P<0.05 vs 正常组; *:P<0.05 vs 模型组
in CUMS mice
2.2 人参皂苷Rg1抑制CUMS诱导的海马突触相关蛋白表达下降
与正常组相比,CUMS小鼠海马PSD95、Arc和BDNF表达均下降(P<0.05)。人参皂苷Rg1能抑制CUMS小鼠PSD95[图3(a)]、Arc[图3(b)]和BDNF表达的下降[图3(c)],其中以20 mg/kg组和40 mg/kg组作用较为显著(vs 模型组,P<0.05)。
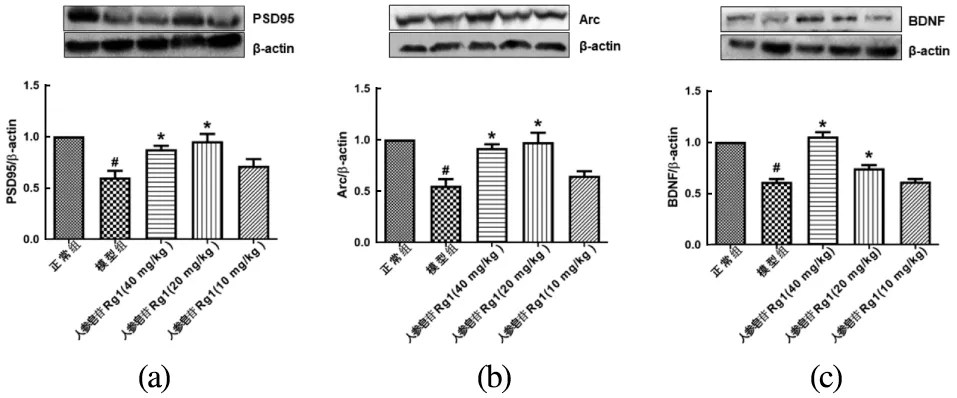
(a)PSD95表达水平;(b)Arc表达水平;(c)BDNF表达水平。每组n=5~6;#:P<0.05 vs 正常组; *:P<0.05 vs 模型组
2.3 人参皂苷Rg1下调CUMS诱导的海马胶质细胞标记物和NF-κB的表达
CUMS模型小鼠的海马星形胶质细胞的标志物GFAP表达上升(vs 正常组,P<0.05),而人参皂苷Rg1能抑制CUMS诱导的GFAP表达的上升[图4(a),vs CUMS,P<0.05]。与正常组比较,CUMS模型组小鼠海马小胶质细胞标记物Iba1的表达也升高,而人参皂苷Rg1能抑制CUMS诱导的Iba1表达上升[图4(b),vs CUMS,P<0.05)]。NF-κB相关通路与炎症密切相关,和正常组比较,CUMS模型组NF-κB表达显著增高,而人参皂苷Rg1显著抑制CUMS诱导的NF-κB表达[图4(c),vs CUMS,P<0.05)]。免疫荧光结果也显示,CUMS组小鼠海马齿状回(dentate gyrus, DG)区GFAP阳性细胞数量增加,而给予人参皂苷Rg1(40 mg/kg)可以抑制CUMS诱导的海马DG区星形胶质细胞的活化[图4(d),P<0.05]。
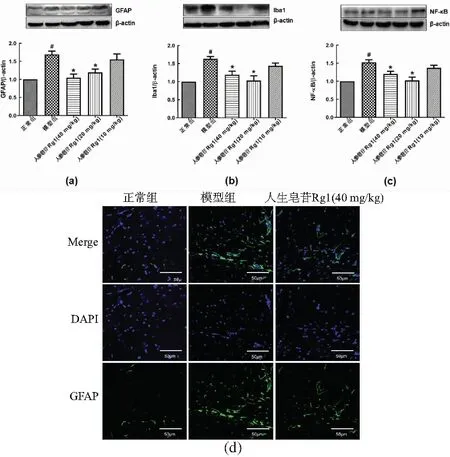
(a)GFAP表达水平;(b)Iba1表达水平;(c)NF-κB表达水平;(d)GFAP免疫荧光代表性图。每组n=5~6;#:P<0.05 vs 正常组; *:P<0.05 vs 模型组
3 讨论与总结
抑郁症是常见精神疾病之一,目前临床上常用的抗抑郁药仍以西药为主,如:三环类抗抑郁药,单胺氧化酶抑制剂等。尽管随机临床试验已经确定了抗抑郁药的疗效[11],但当前可用的抗抑郁药需要数周至数月才能产生治疗效果,有超过30%的患者对这些药物没有反应[12],并且大多数药物具有不良反应。中药以高安全性和耐受性为抑郁症治疗提供有希望的替代方法。人参皂苷Rg1是人参的主要活性成分之一,具有抗炎、神经保护等多种生物活性[13]。已有证据表明人参皂苷Rg1在抑郁的发生中起一定的保护作用[14],但有关人参皂苷Rg1对于抑郁调节机制,特别是对海马区神经突触可塑性和炎症反应的调控仍然未知。
研究采用CUMS诱导的小鼠抑郁模型,评价人参皂苷Rg1的抗抑郁作用。快感缺失是抑郁的一个重要表现,而糖水偏好实验是评价动物快感缺失程度的良好指标[15]。研究发现CUMS刺激后的小鼠对糖水的摄取量明显降低,而人参皂苷Rg1可显著增加抑郁小鼠的糖水摄取量。强迫游泳和悬尾实验是用来评价抗抑郁药疗效的另一重要指标,静止不动时间代表动物抑郁的程度[16]。CUMS小鼠在强迫游泳实验和悬尾实验中的不动时间均显著上升,人参皂苷Rg1给药明显缩短小鼠的不动时间。这些结果表明人参皂苷Rg1能保护CUMS诱导的抑郁样行为。研究还通过旷场实验观察各组小鼠自主活动的变化,各组小鼠的自主活动无显著性差异,表明人参皂苷Rg1治疗后对小鼠的行为学改变确实是由于其抗抑郁作用而不是受小鼠自主活动的影响。
突触可塑性是大脑动态适应外部刺激并调节突触强度最终形成网络功能的基本能力[17]。有研究表明突触可塑性的异常在抑郁的发病机理中起重要作用[18]。Arc是神经元表达活性调节的早期基因产物,在调节树突棘密度和重塑中起重要作用[19]。PSD95是突触后膜上重要且丰富的脚手架蛋白,对于突触可塑性调节起着重要的作用[20]。BDNF是中枢神经系统中非常重要的生长因子,对中枢神经系统中神经元生长、功能性神经元连接、突触形成和突触可塑性至关重要[21]。本研究发现慢性应激会导致这些重要的突触可塑性相关调节蛋白水平的下降,而给予人参皂苷Rg1显著改善这些突触相关蛋白的表达。系列结果均提示人参皂苷Rg1可能通过抑制CUMS诱导的突触相关蛋白的下降来发挥保护抑郁样行为的作用。
炎症在抑郁的发病机理中起着重要作用[22]。而小胶质细胞和星形胶质细胞作为大脑中主要的先天免疫细胞,它们会被感染、压力等引起中枢神经系统的损伤而导致神经炎症所激活[23-24]。活化的小胶质细胞会引发炎症级联反应,释放促炎性细胞因子、趋化因子、炎性介质等,并诱导星形胶质细胞的相互激活[25]。小胶质细胞和星形胶质细胞活化升高与抑郁的发病机制有关[24,25-27]。而抑制星形胶质细胞和小胶质细胞的激活可以改善动物抑郁样行为[29-30]。研究结果指出在CUMS诱发的抑郁模型中,海马中小胶质细胞与星形胶质细胞活化的升高有关。而人参皂苷Rg1可以抑制海马星形胶质细胞和小胶质细胞的活化。此外,研究结果还表明CUMS小鼠海马NF-κB的表达升高,而人参皂苷Rg1可抑制海马NF-κB的表达。NF-κB作为一种快速诱导转录因子,是机体免疫、炎症等过程的关键调节因子[31]。抑制NF-κB及其信号转导途径可以改善神经炎症[5],而炎症与抑郁密切相关。因此,人参皂苷Rg1的抗抑郁作用可能与抑制小鼠海马NF-κB表达从而减轻炎症反应有关,但本实验没有对炎症因子进行进一步的检测。本研究发现人参皂苷Rg1可以减轻CUMS诱发的小鼠抑郁样行为,其抗抑郁作用可能是通过促进海马突触相关蛋白表达以及抑制炎症反应相关。

