禽源Klebsiella variicola引起宿主血流感染的SNP筛选分析
尹 磊,沈学怀,张丹俊,赵瑞宏,戴 银,胡晓苗,周学利,潘孝成
(安徽省农业科学院 畜牧兽医研究所 安徽省畜禽疫病研究中心 畜禽产品安全工程安徽省重点实验室,安徽 合肥 230031)
Klebsiellavariicola是肺炎克雷伯菌复合体家族成员之一,作为一种新出现的人兽共患病原菌,它对宿主具有多种感染方式,其中最常见也是最严重的方式是血流感染(bloodstream infection,BSI)[1]。近年来,由Klebsiellavariicola引起的感染事件频繁发生,不仅严重威胁着人类的健康,而且对畜牧业的发展造成了巨大的经济损失[2]。Klebsiellavariicola的致病性主要依赖于自身携带的毒力因子,这与先前在肺炎克雷伯菌中描述的毒力因子是相对应的,主要有荚膜、脂多糖(LPS)、铁载体和菌毛等[3]。
BSI是细菌等病原微生物侵入血液生长繁殖并产生大量毒素和代谢产物,它会导致高度活跃的炎症免疫反应,随后诱导过多的炎性细胞因子或趋化因子,进而引起的严重全身性感染综合征,可导致感染性体克、急性呼吸窘迫综合征、弥散性血管内凝血甚至多器官功能障碍综合征等一系列并发症,是感染性疾病最严重的表现形式之一[4]。为了引起BSI,病原微生物必须避开血流中的多种宿主防御机制,包括吞噬作用、血清补体和抗菌肽的杀菌作用。事实上,抗血清杀菌能力已被证明是病原微生物的一个重要毒力特征[5]。研究表明,Klebsiella的致病特性与其血清抗性密切相关,荚膜和LPS在细菌抵抗血清杀菌活性中发挥着重要作用,其主要机理可能是通过限制C3补体蛋白在细菌表面的沉积、阻断膜攻击复合物或其他一些尚不清楚的机制来促进Klebsiella的血清抵抗力,从而引起宿主的BSI[6]。此外,动物血清中的铁被转铁蛋白等宿主化合物隔离,导致游离铁的浓度极低[7],由于铁是一系列细菌功能所必需的,因此,Klebsiellavariicola是否通过调控自身新陈代谢,以适应血清中可获得的营养物质,这一过程还有待研究探讨。
转录组测序(RNA-sequencing,RNA-Seq)可以对基因转录产物进行分类分析,确定功能基因的转录结构,常用于新基因的挖掘、已有基因结构的优化、可变剪接事件的寻找以及RNA水平上的单核甘酸多态性(SNP)筛查等[8],为进一步研究相关基因的功能提供参考。目前,关于Klebsiellavariicola在抵抗血清杀菌活性的研究国内外尚无报道,因此,本研究采用RNA-Seq技术比较了禽源Klebsiellavariicola在LB肉汤培养基和SPF鸡血清中的转录组SNP,筛选出Klebsiellavariicola在宿主血清中生存和发展相关的SNP位点,为进一步研究禽源Klebsiellavariicola导致宿主BSI的相关基因提供参考,从而为Klebsiellavariicola致病机理的研究提供理论依据。
1 材料与方法
1.1 菌株AHKv-S01分离自安徽某家禽养殖场,经全基因组测序鉴定为野生型致病性Klebsiellavariicola,由安徽省农业科学院畜牧兽医研究所保存,GenBank登录号为CP047360。
1.2 细菌培养挑取AHKv-S01的单菌落接种于LB肉汤中,37℃、150 r/min振荡过夜培养。次日,以1∶100比例分别接种于LB肉汤中和SPF鸡血清,振荡培养至菌液D600 nm值为0.4~0.6,4℃、5 000 r/min离心10 min,取上清液,菌体沉淀用无菌PBS洗涤3次,收集菌体沉淀,-80℃保存备用。
1.3 RNA-Seq测序提取LB组和SPF鸡血清组的总RNA,使用Illumina公司生产的Ribo-Zero Magnetic Kit(Bacteria,MRZB12424)消化核糖体RNA,加入打断试剂将RNA打断成短片段;以打断后的RNA为模板,用6碱基随机引物合成一链cDNA,然后配制二链合成反应体系合成二链cDNA。在cDNA二链合成时以dUTP代替dTTP,然后连接不同接头,再利用UNG酶法将含有dUTP的1条链进行消化,只保留连接链不同接头的cDNA一链;使用试剂盒纯化cDNA一链;纯化的cDNA一链再进行末端修复、加A尾并连接测序接头,然后进行片段大小选择,最后进行PCR扩增;构建好的RNA文库用Agilent 2100 Bioanalyzer质检合格后,使用Illumina测序仪进行测序。
1.4 数据分析测序所得的数据称为raw reads,随后对raw reads进行质控(QC),以确定测序数据是否适用于后续分析。质控合格后,将过滤之后的clean reads 比对到参考基因组上。通过统计比对率、reads在参考序列上的分布情况等,判断比对结果是否通过第2次质控(QC of alignment)。若通过,基于样本与参考基因组的比对结果,利用Samtools软件进行染色体坐标排序、去重等处理,再用Samtools、Bedtools等软件预测样本中的SNP位点。为了降低SNP检测的错误率,使用 QUAL(a quality score associated with the inference of the given allele) ≥20,且DP(combined depth across samples)≥4进行过滤结果。然后利用SnpEff等软件进行功能注释,对筛选出的SNP位点所对应的基因进行GO功能显著性富集分析、pathway显著性富集分析,筛选出与抗血清杀菌能力相关的基因。
1.5 qRT-PCR荧光定量验证随机选取7个SNP位点对应的基因,以GenBank公布的dnaE基因作为内参基因。用Primer(Version 5.0)软件分析并设计特异性引物,引物序列见表1。采用SYBR GreenⅠ方法进行mRNA表达量分析,数据采用2-ΔΔCt法进行处理。

表1 引物信息
2 结果
2.1 SNP筛选与分析以QUAL≥20且DP≥4为标准筛选SNP位点。相较于LB组,血清组分别获得210 434,195 472,150 845个SNP位点,通过韦恩图取3组的交集,获得143 682个SNP位点(图1),其中检测到单个碱基的转换(transition)有100 790个,颠换(transversion)42 890个,包括A-C(4 444个),A-G(24 078个),A-T(3 315个),C-A(4 576个),C-G(9 123个),C-T(26 181个),G-A(25 838个),G-C(9 398个),G-T(4 631个),T-A(3 116个),T-C(24 693个),T-G(4 287个)。在所有检出的SNP中,转换类型总数(A-G,C-T,G-A和T-C)极显著高于颠换类型总数(A-C,A-T,C-A,C-G,G-C,G-T,T-A和T-G)(P<0.01);而转换类型SNP中,A-G,C-T,G-A和T-C并不存在显著性差异(P>0.05,图2)。此外,对获得的SNP位点所在区域进行统计发现SNP主要集中在外显子区域(131 093个),这些SNP相较于其他区域的SNP更容易引起基因的有效突变,从而导致基因功能及菌株性状发生差异(图3)。
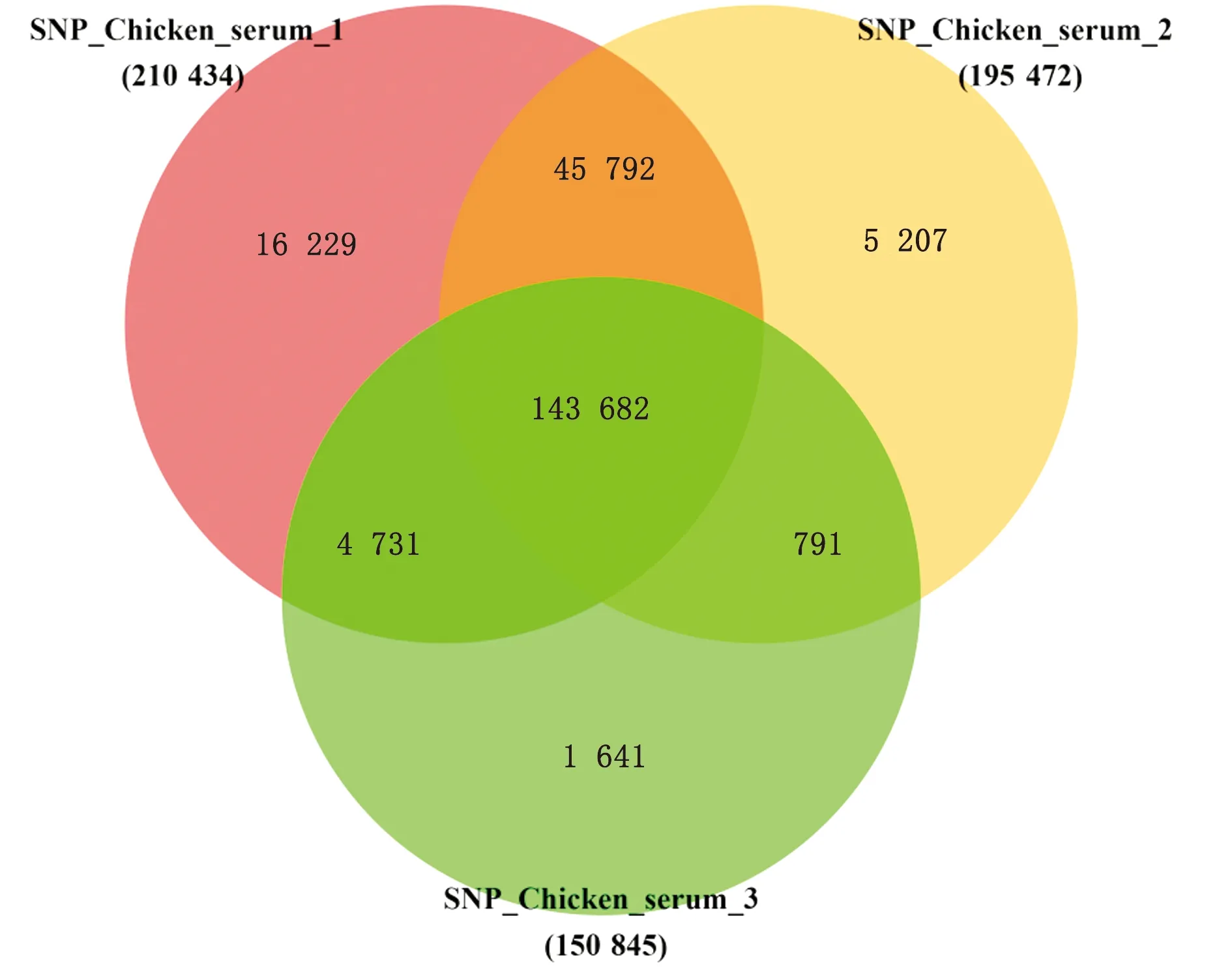
每部分中的数字表示不同血清组的SNP的数量
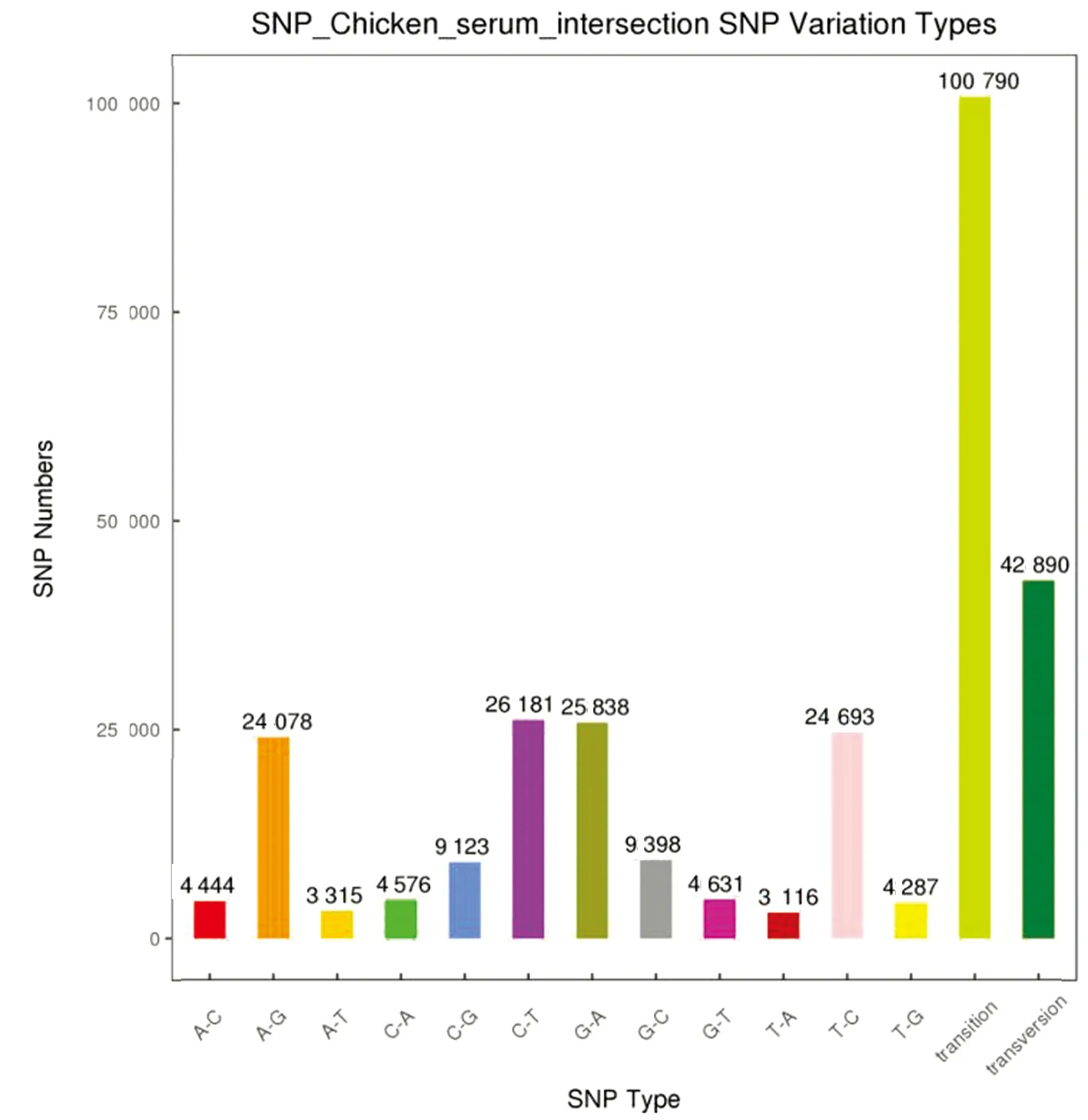
图2 SNP突变类型统计

图3 SNP所在区域统计
2.2 SNP对应基因的GO富集分析通过对SNP位点所在基因进行GO富集分析,筛选3种分类(biological process、cellular component、molecular function)中对应差异基因数目大于2的GO条目,按照每个条目对应的-log10Pvalue由大到小排序的各10条,筛选前30条GO条目(图4)。结果显示,基因参与的生物过程主要富集在DNA脱烷基化与DNA修复、DNA去甲基化、γ-氨基丁酸分解代谢过程、铁同化过程、蛋白水解过程等;细胞组分主要有细胞外膜的组成部分、硝酸还原酶复合物、核酸外切酶修复复合物、膜的组成部分、孔复合体等;分子功能主要有醇脱氢酶(NADP+)活性、甲基化DNA- [蛋白质]-半胱氨酸S-甲基转移酶活性、组氨酸磷酸转移激酶活性、镍阳离子跨膜转运蛋白活性、磷酸泛素结合等。

图4 GO富集分析图(Top 30)
2.3 SNP对应基因的KEGG富集分析将位于基因外显子区域的SNP结合RNA-Seq测序数据,进一步富集获得上述SNP位点所在的候选差异基因,在此基础上结合KEGG注释结果,利用KEGG数据库对其所在基因进行信号通路分析,发现SNP位点对应的基因主要富集在8个与宿主抗血清杀菌能力相关的通路上,其中ABC转运蛋白158个,铁载体基团非核糖体肽的生物合成5个,细菌的趋化性4个,二元调控系统63个,群体感应35个,磷酸转移酶系统25个,LPS生物合成7个,细菌分泌系统9个(图5)。

图5 KEGG通路富集
2.4 荧光定量PCR分析SNP对应基因的mRNA转录表达水平随机选择7个位于KEGG富集通路中的基因,通过荧光定量PCR比较LB组与SPF血清组各基因mRNA转录水平,结果表明(图6),相较于LB组,SPF血清组各基因mRNA转录水平显著上调(P<0.01)。

图6 qRT-PCR分析SNP对应基因mRNA转录表达水平
3 讨论
Klebsiellavariicola是革兰阴性机会性病原体,在人和动物感染中普遍存在,长期以来,Klebsiellavariicola和Klebsiellapneumoniae表现出相似的生化特征;因此,Klebsiellavariicola常被误认为是肺炎克雷伯菌,随着基因组测序技术和系统分型方法的发展,Klebsiellavariicola作为一种新的人兽共患病原菌被鉴定[9-10]。人感染Klebsiellapneumoniae的重要性已为所知,但对Klebsiellavariicola的相关知识还很匮乏。最新的研究表明,在成人患者中,由Klebsiellavariicola引起的BSI与30 d死亡率最高相关,而与Klebsiellapneumoniae感染相关的死亡率相比则较低,同时,在患有血流感染的宿主中,Klebsiellavariicola的临床分离率更高。相关研究显示,虽然Klebsiellavariicola的毒力不如典型的临床Klebsiellapneumoniae分离株,但由Klebsiellavariicola引起的感染会造成更为严重的后果[11]。迄今为止,很少有研究报道农场动物中存在Klebsiellavariicola感染,对农场动物健康生产的潜在风险知之甚少。本研究从安徽省某养禽场分离到1株禽源Klebsiellavariicola,该菌能造成雏鸡孵化率显著降低,其感染方式是BSI,通过RNA-Seq分析该菌在鸡血清中生存和生长的SNP位点来评判Klebsiellavariicola在发病机制中的重要作用,从而为防控Klebsiellavariicola提供新的策略。
在基因组水平上,由单个核苷酸变异引起的DNA序列多态性即称为SNP,SNP可进行复杂性状的关联分析,从而揭示相关性状的机理[12]。本试验利用血清这种生长条件来模拟Klebsiellavariicola在宿主感染期间遇到的条件,进而去洞察Klebsiellavariicola适应血清所需SNP位点对应的变化,从而为解析Klebsiellavariicola引起的BSI性状的调控机理提供理论参考。一直以来,Klebsiellavariicola被认为是开放性的基因组,其原因在于它能通过适应不同的环境条件来整合毒力因子的变异程度,从来增强自身的致病性[13]。本试验结果显示,血清组SNP位点的变化对应的基因主要富集在铁载体的生物合成,二元调控系统,群体感应系统,LPS的生物合成等,这与Klebsiellavariicola目前已鉴定出的毒力因子是相对应的,也提示了SNP位点的变化与Klebsiellavariicola对毒力基因的整合程度有一定的关联性。
病原菌在宿主体内生存繁殖的过程中,会不可避免的感受特定刺激信号的调控,通过激活一系列与毒力相关的基因来作出应答反应,形成复杂的级联式或特定的复合体式协同调控网络,耐受或逃避宿主的防卫机制,最终引发宿主致病[14]。在本研究中,Klebsiellavariicola适应宿主血清环境的过程中,SNP位点的变化涉及到多种信号调控网络的改变,包括二元调控系统、群体感应系统、细菌的化学趋化系统、磷酸转移酶系统、ABC转运蛋白、铁载体的合成以及LPS的生物合成等。二元调控系统是病原菌对各种环境信号作出反应的一个重要机制,病原菌通过感应外界环境的变化而产生相应的信号,通过二元调控系统接收信号进而启动一系列相关基因的转录、翻译和表达,发挥相应的生物学功能[15]。二元调控系统的存在使得病原菌在入侵宿主体内的过程中大大地降低了被宿主免疫系统清除的可能性,这一过程包括病原菌在宿主的血清环境[16]。本试验结果提示Klebsiellavariicola的二元调控系统在调控对宿主抗血清杀菌活性中发挥重要作用,但该信号的转导与Klebsiellavariicola毒力调节之间的关系还有待进一步的探讨。细菌的化学趋化性能确保其逃离不利的生存环境,从而增强生存上的竞争优势[17],这种竞争优势可能是Klebsiellavariicola能够在宿主血清环境中生存和发展的重要因素。群体感应系统是细菌群体对信号分子的协同应答,从而在多细胞水平上传递级联信号的过程,最终使细菌利用群体的力量来应付宿主的免疫清除。群体感应系统可以调控病原菌的多种生理学功能,其中最主要的是调控生物被膜的形成[18]。我们推测生物被膜的形成使Klebsiellavariicola能够形成协调的生存策略,从而适应宿主的血清环境并促进Klebsiellavariicola的存活,具体过程还有待后续进一步的验证。当病原菌内化到宿主细胞时,它们需要适应可利用营养物质的新陈代谢,主要是宿主细胞中的碳源。例如碳水化合物磷酸转移酶系统(PTS)主要是通过磷酸级联反应将各种糖及其衍生物进行磷酸化然后运输到胞内。其不仅参与碳、氮中心代谢,还调节铁、钾稳态,调控某些病原体的毒力,还能介导应激反应。在这些不同的调节过程中,信号由PTS组分的磷酸化状态提供,而该磷酸化状态根据PTS底物的可用性和细胞代谢状态的变化而变化[19]。在本研究中,PTS可能通过干扰Klebsiellavariicola的整体代谢来影响其在血清中的存活。据报道,病原菌在抵抗宿主的血清杀菌能力的过程中,LPS通过介导补体蛋白形成连锁反应在菌体表面聚集成复合物,从而保护细菌不被杀灭[20],此外,铁是细菌生长繁殖的关键分子,是许多细胞过程所必需的。然而,由于Fe3+在生理条件下的不溶性以及Fe2+和Fe3+对宿主的限制,导致血清中的游离铁很少。为了促进病原菌在血清中的存活力,因此,入侵的细菌病原体编码高亲和力的铁获取系统来抵消宿主的营养免疫过程[21]。铁载体是细菌内部合成的小分子,然后输出。在细胞外,铁载体以极高的亲和力结合环境中的铁,并被运回细胞内,为细菌提供生长所需的铁,在这个过程中,ABC转运蛋白系统发挥着重要的作用,致病菌分泌的铁载体的高亲和性铁离子-复合物分子通过ABC转运体的铁离子通道来实现重新吸收[22]。此外,本试验从上述SNP位点对应基因富集的信号通路中随机选取的7个基因,经qRT-PCR检测,发现在血清中Klebsiellavariicola基因的mRNA转录水平是显著上调的,这除了与先前的研究结果相兼容以外,对一些新的基因或调控系统在Klebsiellavariicola抗血清杀菌能力的解释中似乎也是合理的。
本研究利用RNA-Seq比较Klebsiellavariicola在LB肉汤培养基和SPF鸡血清中的SNP,发现筛选出的SNP所在的基因主要富集在二元调控系统、群体感应系统、细菌的化学趋化系统、磷酸转移酶系统、ABC转运蛋白、铁载体的合成以及LPS的生物合成等途径。本研究对禽源Klebsiellavariicola在宿主血液环境中生存和发展的分子机制进行了初步分析和探索,为进一步研究Klebsiellavariicola的致病机制提供理论依据。

