桔青霉产核酸酶P1酶分离纯化及其酶学性质
李 明,余华顺,喻 晨,吴 尧,龚大春,
(1.三峡大学生物与制药学院,湖北宜昌 443002;2.中国轻工业功能酵母重点实验室(三峡大学),湖北宜昌 443002;3.安琪酵母股份有限公司 特种酶制剂事业部,湖北宜昌 443003)
核酸酶P1,又名5’-磷酸二酯酶,它是一种含锌金属酶。桔青霉(Penicillium citrinum)来源的核酸酶P1,分子量约为44 kDa,由331个氨基酸多肽单链构成,含有2个二硫键,其活性中心存在一个三锌结构。核酸酶P1的作用为水解RNA和催化水解热变性DNA中的磷酸二酯键得到5’-核苷酸。5’-核苷酸具有很好的营养保健作用,其中5’-GMP和5’-AMP是天然的风味增强剂,能够显著提高产品的风味特征,还可以作营养补充剂、药物前体物质。随着人们对健康生活需求的提升,酶法水解核酸得到的天然核苷酸的需求不断增长,其广泛应用于食品、药品、保健品及饲料中[1-3]。核酸酶P1在核苷酸工业化生产中的应用至关重要。核酸酶P1还可以应用于分子生物学方面的研究,如测定病毒RNA的5’-末端核苷酸序列[4]。Bai等[5]利用核酸酶P1具有使适配体与磺胺二甲氧基形成偶联物的原理建立了一种检测磺胺二甲氧基的电化学检测方法。随着核酸酶P1在更多领域的应用,对该酶的分离纯化及其酶学性质开展研究,将对高纯度核酸酶P1工业化生产及其应用具有重要意义。
目前,有文献报道了对核酸酶P1菌株选育[6-10]和发酵工艺[11-14]的相关研究,李兆飞等[6]将桔青霉菌株经氯化锂-离子束复合诱变筛选得到核酸酶P1高产菌株;郑美娟等[7]以桔青霉AG-R1为出发菌株,研究了甲苯胺蓝-RNA平板筛选方法,为工业化快速选育产核酸酶P1菌种提供高效方法;田吕明等[12-13]以Logistic方程和Luedeking-Piret方程为基础,研究了桔青霉发酵生产核酸酶P1的发酵动力学特性,还运用响应面法和爬坡路径法等多种方法优化得到桔青霉产核酸酶P1的最佳发酵培养基;喻晨等[14]采用部分析因试验设计、中心组合实验设计和响应面分析法对桔青霉产核酸酶P1培养基进行优化研究。但对该酶的分离纯化及其酶学性质研究报道较少[15-16]。本研究拟通过脱色、盐析、凝胶层析等分离步骤将桔青霉产核酸酶P1浓缩液纯化后,测定核酸酶P1的酶学动力学常数Km、Vm、Kcat,并开展其酶学性质研究,为核酸酶P1的开发奠定了科学基础。
1 材料与方法
1.1 材料与仪器
核酸酶P1浓缩液 桔青霉发酵生产,由安琪酵母特种酶生产部提供;硫酸铵、活性炭、酵母RNA均为分析纯。
HiTripTMDesalting和SuperdexTM75 10/300 GL
美国GE AKTA;Pure 25 M1蛋白纯化仪 美国GE AKTA;UV-2802H紫外可见分光光度计 上海尤尼柯仪器有限公司;Pilot 2-4hH真空冷冻干燥机 北京博医康实验仪器有限公司;DYY-5电泳仪 北京市六一仪器厂。
1.2 实验方法
1.2.1 分离纯化工艺 核酸酶P1浓缩液→活性炭吸附脱色→硫酸铵分级沉淀→HiTripTMDesalting脱盐→SuperdexTM75 10/300 GL凝胶层析→纯化酶→冻干
活性炭吸附脱色:于8个三角瓶中称取一定量的核酸酶P1浓缩液,然后分别添加0.3%、0.5%、0.7%、0.9%、1.1%、1.3%、1.5%、1.7%的粉末活性炭,于60 ℃机械搅拌1 h。去除活性炭残渣后,将脱色酶液在420 nm下测定OD,计算脱色率[17]。选择脱色最理想的活性炭用量,将核酸酶P1浓缩液脱色处理,得到脱色酶液。
硫酸铵分级沉淀[18]:量取上述脱色酶液,逐级添加硫酸铵,使其饱和度依次达到40%、50%、60%、65%、70%、75%、80%、85%,收集各级沉淀。
HiTripTMDesalting脱盐:将上述比酶活最高的沉淀用醋酸缓冲液(10 mmol/L,pH5.5)溶解,上HiTripTMDesalting柱,上样量为0.5 mL,用醋酸缓冲液(10 mmol/L,pH5.5)洗脱,选择合适的流速(流速初设为0.5 mL/min),收集主要蛋白峰,根据在线监测电导率,验证脱盐效果[19],将收集的目的峰样品冻干保存。
SuperdexTM75 10/300 GL凝胶层析:将脱盐后的冻干样品用醋酸缓冲液(10 mmol/L,pH5.5)溶解,用SuperdexTM75 10/300 GL凝胶柱层析,上样量为0.5 mL,流速为0.8 mL/min,用醋酸缓冲液(10 mmol/L,pH5.5)洗脱,分段收集第一个蛋白峰,每分钟收集1管,依次收集5管,将收集的样品冻干,得到纯化酶。
冻干:将需要冻干保存的样品放在真空冷冻干燥机样品盘内,经过预冻、升华干燥、解析干燥得到冻干纯化酶。
1.2.2 分析检测方法
1.2.2.1 蛋白浓度测定 用考马斯亮蓝法(Bradford法)[18],以考马斯亮蓝R-250溶液为显色剂,通过可见光分光光度法,参照牛血清蛋白制作的标准曲线测定每个样品的蛋白浓度。
1.2.2.2 SDS-PAGE电泳分析 使用SDS-PAGE连续电泳,按要求配制分离胶、浓缩胶、染色液及脱色液。以考马斯亮蓝R-250为染色液,标准蛋白Marker的分子量分别为5、15、30、35、50、65、95、130 kDa。上样样品的蛋白浓度均稀释至1~2 mg/mL范围内再处理上样。
1.2.2.3 核酸酶P1酶活检测 采用紫外分光光度法[7],以酵母RNA为底物,在68 ℃水浴中与稀释酶液反应,用核酸沉淀剂终止反应后,在260 nm波长下测OD260,以先加沉淀剂者为对照,计算光密度差(△OD)。在上述条件下,每分钟生成的核苷酸使260 nm处的光密度差值为1.0时的酶量为一个酶活单位。
1.2.3 酶学特性研究
1.2.3.1 最适pH和pH稳定性 在pH4.0、4.5、5.0、5.5、6.0、6.5环境下分别检测纯酶酶活,研究该酶最适pH;将纯酶分别在pH3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0 醋酸缓冲液体系中静置1 h后检测残余酶活,研究该酶的酸碱耐受度。
1.2.3.2 最适温度和温度稳定性 在40、50、60、65、70、75、80、85、90、95 ℃温度条件下测定纯酶酶活,研究该酶最适温度;将纯酶分别在40、50、60、65、70、75、80、85 ℃几个温度条件下保温1 h后检测残余酶活,研究该酶耐热特性。
1.2.3.3 金属离子的影响 将纯酶分别用终浓度为1、5、10、50 mmol/L的金属离子(Ni2+、Fe2+、Cu2+、Zn2+、Mg2+、Mn2+、Ca2+、Co2+、Pb2+)溶液溶解,于25 ℃静置60 min后测定残余酶活,将不外加金属离子时的酶活设置为100%。
1.2.3.4 动力学参数米氏常数Km、最大反应速度Vm和催化常数Kcat的测定 以酵母RNA为底物,分别在底物浓度为1.52、2.28、3.04、3.81、4.57 mmol/L测定反应时间分别为5、7、9、11、13、15 min的酶活,绘制每个底物浓度下酶活-反应时间图,拟合趋势线,求出斜率即为该底物浓度下的酶促反应速率[20],再依据Lineweaver-Burk作图法[21-24]作图,由米氏方程的变形式得出米氏常数Km和最大反应速度Vm。Km表示酶与底物的亲和能力,Km值越小,亲和能力越强。催化常数Kcat(s-1)是酶的催化常数,表示单位时间内每一活性中心或每分子酶所能转换的底物分子数,反映了酶催化特定底物的能力大小。根据每秒钟核酸酶P1蛋白分子数所能转化的核酸RNA分子数的比值[25-27],计算出Kcat。
1.3 数据处理
本研究用OriginPro 9.0和Excel 2007进行数据处理。
2 结果与讨论
2.1 核酸酶P1的纯化
2.1.1 活性炭用量对核酸酶P1脱色效果的影响 由图1可知,当活性炭用量小于0.9%时,脱色率随着活性炭用量的增加而急剧增加,当活性炭用量大于0.9%时,脱色率缓慢增加,当活性炭用量达到1.5%,再继续增大用量,脱色效果增加不明显。因此活性炭用量1.5%为最佳用量,此时脱色率达到91%。

图1 不同活性炭用量对脱色效果的影响Fig.1 Effect of diffrent amount of activated carbon on decolorization
2.1.2 硫酸铵浓度对核酸酶P1的分级沉淀效果的影响为了考察硫酸铵的浓度对核酸酶P1的沉淀效果,按照1.2.1进行分级沉淀,实验结果见表1。由表1可知,在脱色酶液中逐级添加硫酸铵,上清液比酶活逐渐减小,沉淀比酶活先增后减,当硫酸铵饱和度达到65%时,收集的沉淀酶的比酶活最高,可以达到15157 U/mg,后期再增加硫酸铵浓度会导致部分酶失活,比酶活反而下降。
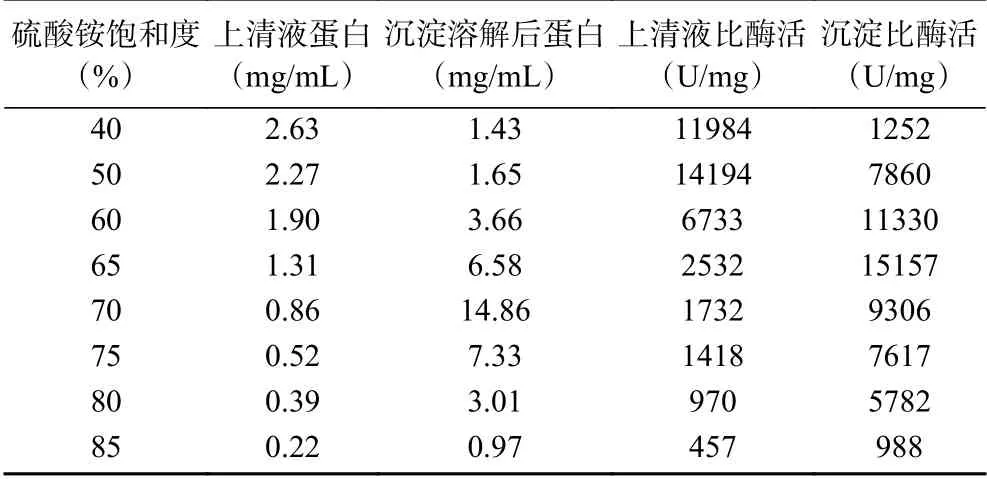
表1 不同浓度硫酸铵分级沉淀的比酶活Table 1 The specific enzyme of (NH4)2SO4 fractionation
2.1.3 HiTripTMDesalting脱盐效果 利用美国GE公司蛋白质纯化仪,采用脱盐柱HiTripTMDesalting,上样量为0.5 mL,用醋酸缓冲液(10 mmol/L,pH5.5)洗脱,当流速为0.5 mL/min时,盐分与目的蛋白峰很难分开,当流速为0.3 mL/min时,样品中的盐分与目的峰(第一个蛋白峰)有效分开,收集第一个蛋白峰洗脱液,见图2。第一个含盐较少的蛋白峰收集样电导率为0.85 mS/cm,第二个蛋白峰电导率为7.45 mS/cm。由此可见,该脱盐柱可将盐析沉淀样中的大部分盐分除去。
2.1.4 SuperdexTM75 10/300 GL凝胶层析 由图3可知,将脱盐后的冻干样经过SuperdexTM75 10/300GL凝胶层析(该层析柱对球状蛋白最佳分离范围是3~70 kDa),共收集到两个蛋白峰,其中,第一个蛋白峰酶活最高,将该蛋白峰依次收集的5管样品冻干后分析,其中第3管如图4泳道4所示,主带清晰,且比酶活最高,达到33967 U/mg。
2.1.5 SDS-PAGE电泳实验 在上样前将各个样品的蛋白浓度稀释至1~2 mg/mL范围内,然后再进行处理,上样。纯化效果如图4所示,泳道1为核酸酶P1发酵浓缩液。发酵浓缩液经过活性炭脱色、硫酸铵沉淀、脱盐柱层析及SuperdexTM75 10/300 GL凝胶层析后,获得纯化酶(图4泳道4所示),该纯化酶电泳条带清晰且杂带较少,分子量约为44 kDa。
按照1.2.1的方法,将核酸酶P1浓缩液经过脱色、盐析、脱盐、凝胶层析等分离纯化过程,其中,分别将盐析沉淀稀释至120 mL,脱盐收集酶液冻干后稀释至60 mL,凝胶层析收集酶液冻干后稀释至40 mL,再进行蛋白浓度及酶活力测定,结果见表2。从表2中可以看出,经过5步分离纯化后,比酶活达到33967 U/mg,纯化倍数为8.48倍。

图2 HiTripTM Desalting脱盐图谱Fig.2 The desalination spectrum of HiTripTM Desalting
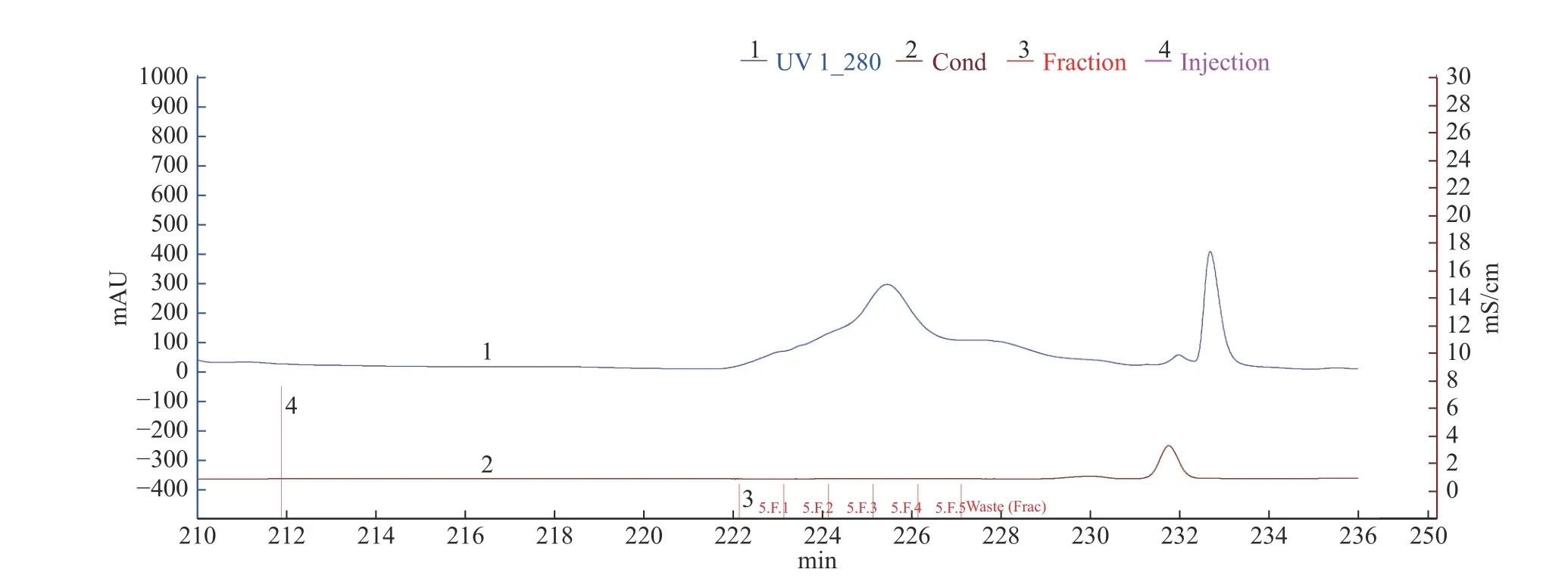
图3 SuperdexTM 75 10/300 GL凝胶层析图谱Fig.3 The chromatogram of SuperdexTM 75 10/300 GL

图4 核酸酶P1纯化SDS-PAGE电泳图Fig.4 SDS-PAGE electrophoresis of purification of the nuclease P1
2.2 核酸酶P1酶学特性分析
2.2.1 pH对核酸酶P1酶促反应的影响 按照1.2.3方法,开展核酸酶P1对不同酸度的耐受度。pH对核酸酶P1酶促反应影响如图5所示,核酸酶P1最适反应pH为5.5,该酶作用pH偏酸性且范围较广,在pH4.0~6.0环境中仍然具有80%以上的相对酶活。
2.2.2 温度对核酸酶P1酶促反应的影响 温度对核酸酶P1酶促反应的影响如图6A所示,短时间内核酸酶P1的最适反应温度为75 ℃。核酸酶P1的一级结构中有54%为疏水性氨基酸,从而形成较为紧密的结构,这种结构可能使其具有良好的热稳定性[14]。通过将纯酶置于40~85 ℃条件下,且pH5.5,处理1 h后检测残余酶活,研究其稳定性,结果见图6B。从图中可以看出,该酶在65 ℃以下储存稳定性很好,高于65 ℃其酶的稳定性开始下降,70 ℃时候酶活下降到相对酶活的80%。本研究表明综合考虑酶活损失与催化效率,该核酸酶P1在核苷酸生产工艺中适宜温度范围为60~75 ℃之间。

表2 各分离步骤的纯化结果Table 2 Purification result of each separation step

图5 核酸酶的最适pH和pH稳定性Fig.5 Optimum pH and pH stability of nuclease P1

图6 核酸酶P1最适反应温度和温度稳定性Fig.6 Optimum reaction temperature and temperature stability of nuclease P1
2.2.3 金属离子对酶活性的影响 金属离子对核酸酶P1催化水解RNA反应的影响如图7所示。从图7中可以看出,在1 mmol/L条件下Zn2+对核酸酶P1有明显激活作用,Mg2+、Mn2+、Ca2+在1 mmol/L条件下有轻微激活作用,而Ni2+、Fe2+、Cu2+、Mn2+、Co2+在50 mmol/L条件下有明显的抑制作用,酶活分别下降到64%、55%、3%、67%和55%,特别是Cu2+在1~50 mmol/L之间有酶活明显下降趋势,说明Cu2+对核酸酶P1具有强烈抑制作用。因此在核苷酸生产过程中可以添加适当浓度的Zn2+,但应当避免接触含铜、钴离子的化合物,其他离子应控制在10 mmol/L以下。
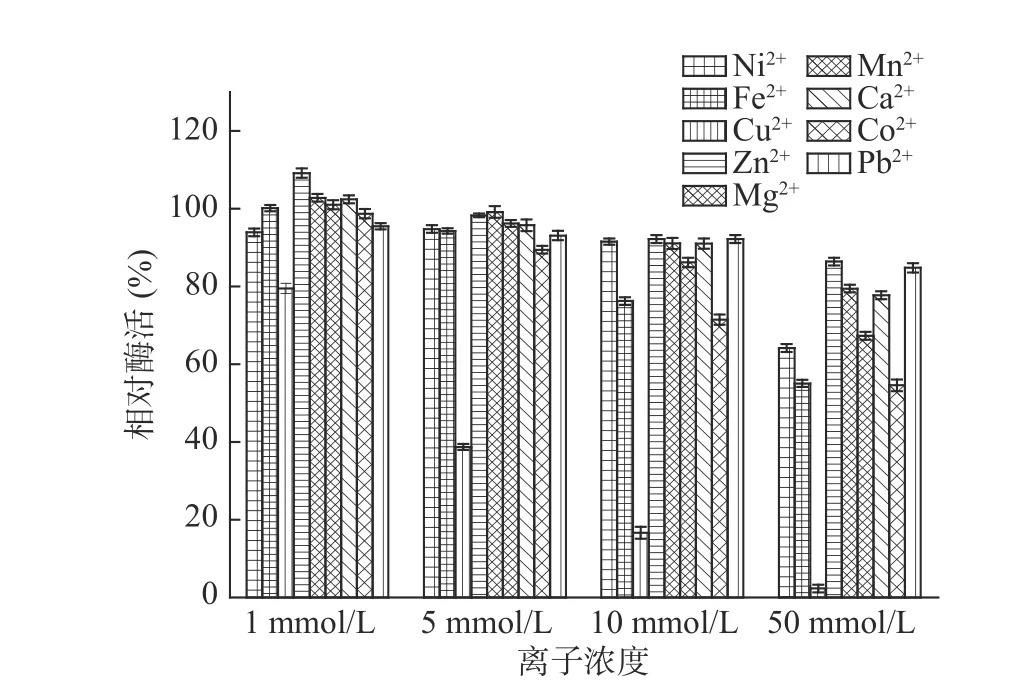
图7 金属离子对核酸酶P1活性的影响Fig.7 The effect of metal ion on nuclease P1 activity
2.2.4 核酸酶P1动力学参数Km、Vm和Kcat的测定由图8可得该酶的最大反应速度Vm为0.0864 mmol/(mL·min),米氏常数Km为2.50 mmol/L,根据核酸酶P1的分子量和底物浓度得出催化常数Kcat为252.43 s-1,即理论上该核酸酶P1每秒钟可以将252个RNA底物分子周转化成产物。

图8 核酸酶P1的动力学参数测定双倒数图Fig.8 Double-reciprocal plot for determination of nuclease P1 dynamics parameters
3 结论
本研究设计的纯化方法简单、快速,利用脱色、盐析、色谱分离等手段纯化得到核酸酶P1纯组分,酶蛋白经SDS-PAGE电泳分析,呈现单一主带,该核酸酶P1组分比酶活为33967 U/mg,纯化倍数为8.48倍;测定了该酶的米氏常数Km、最大反应速度Vm和催化常数Kcat,分别为2.50 mmol/L、0.0864mmol/(mL·min)和252.43 s-1;该 酶 在60~70 ℃,pH4.0~6.0条件下仍具有较高相对酶活。与其他核酸酶P1相比,该核酸酶P1具有较好的热稳定性及更广的应用pH范围,且与底物RNA有更强的亲和能力。Zn2+对该酶有很好的激活作用,Cu2+对其有抑制作用,该酶可广泛应用于酵母深加工和核苷酸生产领域。
近几年,核酸酶P1除了应用于核苷酸生产中,还被应用于分子生物学及检测方法等方面的研究,如测定病毒RNA的5’-末端核苷酸序列,检测磺胺二甲氧基的电化学检测方法。随着对核酸酶P1越来越深入的研究,它将具有更广阔的应用前景,同时,也对核酸酶P1提出了更高的要求,需要进一步探究并开发高品质产品。

