银杏多糖对小鼠淋巴细胞免疫调节作用的研究
金 鑫,李敬双,王一伦,李 贤,李凤娇,于 洋
(锦州医科大学 食品科学与工程学院,辽宁锦州 121001)
银杏,又名白果,在中国历史上作为一种药食同源的中药早有使用,如银杏果药用早在元代《日用本草》中出现过,明代李时珍的《本草纲目》中也有“银杏,气薄、味厚,性涩而收,益肺气,定咳嗽,缩小便,能杀虫消毒”的记载[1]。
银杏多糖(Ginkgobilobapolysaccharides,GBP)是银杏中一种重要的活性成分。近年来研究发现,银杏多糖具有免疫调节[2]、抗肿瘤[3]、抗炎[4]、抗氧化[5]、降低血糖[6]等多种活性作用。Ren Q等[2]利用DEAE-Sepharose Fast Flow离子交换层析柱对银杏叶粗多糖进行了系统的分离纯化与单糖组成分析,并通过对巨噬细胞的吞噬能力,NO、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1、IL-6的分泌量等指标来评定其免疫功能,结果显示,银杏叶粗多糖由甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成并显示出较好的免疫促进作用。孟秀彦等[7]用银杏多糖制成灭活的传染性法氏囊超强毒(vvIBDV)GX8/99细胞适应株佐剂疫苗,对公雏鸡进行免疫接种,疫苗的效果通过IL-2和IFN-γ分泌量、血清抗体、外周血淋巴细胞转化率、外周血CD4+和CD8+T淋巴细胞数量等指标来评定,结果显示,以银杏叶多糖为佐剂的疫苗显示出较好的免疫促进作用。银杏多糖作为一种天然活性物质,具有免疫调节、抗肿瘤、抗氧化等生物活性,且具有毒副作用小、安全性高、来源广泛等优点。我国银杏种植面积已达260万亩,总产量已占世界90%以上,正可以作为一种潜在的免疫调节剂,在医药、功能性食品等领域均有较好的应用前景,因此,对银杏多糖的进一步综合开发利用是十分有意义的。然而目前有关多糖结构和活性关系以及具体的作用机制的研究相对较少,在解析其结构、阐明其银杏多糖的免疫调节作用机制等方面仍需进一步深入探索。
体外细胞试验具有干扰因素少、易于控制,可进行代谢和机制研究的优点,因此,为探讨银杏多糖的免疫调节活性,本实验体外观察了银杏多糖体外对小鼠脾淋巴细胞增殖、细胞周期、细胞因子分泌及其mRNA表达的影响,以期为银杏多糖的进一步开发和利用提供理论依据。
1 材料和方法
1.1 材料与仪器
Balb/c小鼠 SPF级,体重(20±2) g,6-8周龄,锦州医科大学生命科学院,生产许可证号 SCXK(辽)2014-0004;银杏多糖 晨光生物技术有限公司,纯度≥90%;胎牛血清 浙江天杭生物科技有限公司产品;甲基噻唑蓝(methyl thazolyl tetrazolium,MTT)、台盼蓝、RPMI-1640培养基、二甲基亚砜(dimethyl sulfoxide,DMSO)、三羟甲基氨基甲烷(trismetyl aminomethane,Tris)和磷酸盐缓冲溶液(phosphate buffered solution,PBS) 北京索莱宝科技有限公司;小鼠细胞周期试剂盒 德美天旎生物技术有限公司;小鼠IL-4,IFN-γ细胞因子检测试剂盒 上海酶联生物科技有限公司;TaKaRa逆转录试剂盒、TB GreenTMPremix Ex TaqTMII(Tli RNaseH Plus)试剂盒 宝生物工程(大连)有限公司。
Varioskan FlashT多功能酶标仪 Thermo Fisher Scientific;超净工作台 苏州净化设备有限公司,SW-CJ-1F型;倒置显微镜 日本OLYMPUS公司,CKX41SF;低速离心机 湖南赫西仪器装备有限公司,TD5A;96孔或24孔板台式离心机 上海安亭(TDL80-2B);CO2培养箱 日本SHELLAB;FA2004N型电子天平 上海精密科学仪器有限公司;BD FACSCelesta型流式细胞仪 美国BD公司;Mastercyler ep realplex4型实时荧光定量PCR仪、AG 22331 Hamburg型PCR扩增仪、BioPhotometer plus型蛋白核酸分析仪 德国Eppendorf公司;全自动凝胶成像系统 中国Tanon2500。
1.2 实验方法
1.2.1 淋巴细胞悬液制备 参考桑卡娜等[8]、马玉芳等[9]实验方法,小鼠用颈椎脱臼法处死后,拿镊子夹住小鼠耳部在75%的酒精中浸泡1~2 min进行消毒,在无菌超净工作台内将脾取出,放入装有PBS的培养皿中浸泡1~2 min后转移到RPMI-1640培养基中,用注射器拉杆末端研磨透过200目滤网塞。将滤液吸出至离心管,1500 r/min 4 ℃离心5 min,弃上清后加入红细胞裂解液 3 mL裂解红细胞,静置5 min再离心,再弃上清,重复操作直至红细胞完全裂解。用RPMI-1640完全培养基重悬沉淀细胞并过滤,台盼蓝染色后用倒置显微镜观察,调整细胞活力达95%以上并加入RPMI-1640完全培养液使细胞密度达5×106个/mL,制成淋巴细胞悬液。

表1 实验中小鼠IL-4、IFN-γ和内参ACTB引物序列Table 1 Mouse IL-4、IFN-γ and internal reference ACTB primer sequences in the experiment
1.2.2 实验分组与处理 实验设空白对照组、阳性对照组、银杏多糖处理组。空白对照组每孔加入RPMI-1640完全培养基,阳性对照组每孔加入含5 μg/mL左旋咪唑的RPMI-1640完全培养基,银杏多糖处理组每孔加入含不同浓度银杏多糖(25、50、100、200、400 μg/mL)的RPMI-1640完全培养基。将淋巴细胞悬液接种于24孔细胞培养板,每组设3个复孔,每孔加入1 mL淋巴细胞悬液和1 mL相应的RPMI-1640完全培养基;接种于96孔细胞培养板,每组设5个复孔,每孔加入100 μL淋巴细胞悬液和100 μL相应的RPMI-1640完全培养基。
1.2.3 MTT法检测银杏多糖对淋巴细胞增殖的影响 参考张思哲等[10]实验方法,将淋巴细胞悬液接种于96孔细胞培养板,按1.2.2实验分组及处理。在37 ℃ 5% CO2条件下培养48 h后每孔再加入20 μL MTT液,继续培养4 h后弃上清,每孔再加入150 μL DMSO,将酶标仪设置为570 nm后测OD值。小鼠的脾淋巴细胞增殖率以增殖指数(PI)来表示。
1.2.4 流式细胞术检测银杏多糖对淋巴细胞周期的影响 参考骆梅等[11]实验方法,将淋巴细胞悬液接种于24孔细胞培养板,按1.2.2实验分组及处理。37 ℃ 5% CO2培养48 h后,以1200 r/min离心3 min,每孔加入1 mL PBS重悬细胞,离心弃上清,轻轻弹击离心管底以适当分散细胞,避免细胞成团。加入1 mL预冷70%乙醇中,轻轻吹打混匀,4 ℃固定过夜。将已固定的细胞以1200 r/min离心3 min,弃上清后,每管加入1 mL预冷的 PBS,重悬细胞,离心弃上清,每管再加入0.5 mL的碘化丙啶染色液,37 ℃避光孵育30 min,用流式细胞仪检测及Modifit分析。
1.2.5 ELISA法检测银杏多糖对淋巴细胞分泌细胞因子的影响 参考Xie等[12]实验方法,将淋巴细胞悬液接种于96孔细胞培养板,按1.2.2实验分组及处理。37 ℃ 5% CO2培养48 h后,1500 r/min 4 ℃离心5 min,收集上清。用ELISA法检测银杏多糖对淋巴细胞IL-4、IFN-γ分泌的影响,具体操作参考小鼠细胞因子试剂盒说明书进行。
1.2.6 qRT-PCR法检测银杏多糖对IL-4、IFN-γmRNA表达的影响 参考Pan等[13]实验方法,将淋巴细胞悬液接种于24孔细胞培养板,按1.2.2实验分组及处理。37 ℃ 5% CO2培养48 h。弃上清,用PBS清洗2次,每管加1 mL Trizol,使细胞完全裂解,换EP管,以12000 r/min,4 ℃离心10 min,弃沉淀,每管加入500 μL的三氯甲烷,上下剧烈摇晃30 s,冰浴10 min。以12000 r/min,4 ℃离心10 min,弃上清,再加入500 μL的异丙醇,上下颠倒8次,冰浴10 min,以12000 r/min,4 ℃离心15 min,小心吸除上清液,将管底沉淀留存下来。每管分别加入1 mL 75%冰乙醇,上下颠倒混匀,以12000 r/min,4 ℃离心10 min,弃去上清液,再加入1 mL 75%冰乙醇,上下颠倒混匀,以 12000 r/min,4 ℃离心5 min后再弃上清,室温放置30 min。加入RNase-free水20 μL溶解沉淀。将上述溶解的RNA溶液取出1 μL在超微量紫外/可见分光光度计260 nm及280 nm处测定吸光度比值,并将其Total RNA的浓度记录下来,比值在1.8~2.1之间,表明提取的RNA未污染,质量好。
按照TaKaRa逆转录试剂盒的说明配制反应体系:1 μL gDNA Eraser,2 μL 5×gDNA Eraser Buffer,6 μL Rnase Free dH2O,1 μL Total RNA,总体系为10 μL,混合均匀,室温放置20 min后,加入1 μL Primescript RT Enzyme Mix I,1 μL RT Primer Mix,4 μL 5×PrimeScript Buffer 2,4 μL Rnase Free dH2O,总体系为20 μL。在37 ℃条件下反应15 min,85 ℃反应5 s,最终得到cDNA样品放于-80 ℃保存。参考谢婵[14]、Khatlani等[15]引物设计,并对所用的PCR引物进行预试验。
采用TB GreenTMPremix Ex TaqTMII(Tli RNaseH Plus)试剂盒的说明配制反应体系:12.5 μL 2×TB Green Premix Ex Taq II,1 μL上游引物,1 μL下游引物,2 μL cDNA模板,8.5 μL灭菌水,共25 μL,混合均匀,进行Real time PCR反应,按照扩增试剂盒的程序设置为95 ℃ 30 s预变性、95 ℃ 5 s变性、60 ℃ 30 s退火,40个循环。以ACTB作为内参,扩增完后采用 2-ΔΔCt方法进行数据分析以得到目的基因的相对表达量。
1.3 数据处理

2 结果与分析
2.1 银杏多糖对淋巴细胞增殖的影响
机体最主要的免疫细胞正是淋巴细胞,分为B淋巴细胞和T淋巴细胞。由表2可知,与空白组相比,阳性组和银杏多糖处理组淋巴细胞增殖指数均极显著升高(P<0.01);银杏多糖处理组在25~200 μg/mL浓度范围内,淋巴细胞增殖指数随银杏多糖浓度的升高而升高,呈良好的剂量-效应关系,继续升高银杏多糖浓度至400 μg/mL,淋巴细胞增殖指数反而显著下降(P<0.05),说明银杏多糖对淋巴细胞增殖呈双向调节作用。与阳性组相比,银杏多糖处理组在25、50、100、400 μg/mL时淋巴细胞增殖指数极显著低于阳性组(P<0.01),银杏多糖处理组为200 μg/mL时淋巴细胞增殖指数低于阳性组,但无统计学意义(P>0.05)。已有研究表明,多糖主要通过影响淋巴细胞增殖能力、亚群结构、细胞因子的分泌、NO的释放能力等对淋巴细胞产生调节作用[16]。另有研究表明商陆均一多糖对小鼠脾淋巴细胞增殖产生显著促进作用[17]、杏鲍菇菌糠多糖对小鼠脾指数、脾淋巴细胞增殖及免疫因子均有调节作用[18]。这与本研究结果一致,因此提示银杏多糖与左旋咪唑均能通过促进小鼠脾淋巴细胞的增殖产生免疫调节作用。

表2 银杏多糖对淋巴细胞增殖的影响Table 2 Effects of GBP on lymphocyte
2.2 银杏多糖对淋巴细胞周期的影响
细胞周期对细胞增殖又有着缜密的调控作用,在细胞周期中,G1期为DNA合成的准备期,S期涉及DNA合成,G2为有丝分裂做准备,M期为分裂期[19]。由表3可知,与空白组相比,阳性组和银杏多糖处理组G0/G1期细胞占比均极显著降低,S期+G2/M总占比均极显著升高(P<0.01),且银杏多糖对淋巴细胞周期呈双向调节作用。与左旋咪唑组相比,银杏多糖处理组在25、50、100、400 μg/mL时G0/G1期占比极显著高于阳性组、S期+G2/M期细胞总占比极显著低于阳性组(P<0.01),而200 μg/mL银杏多糖处理组的G0/G1期占比极显著低于阳性组、S期+G2/M期细胞总占比极显著高于阳性组(P<0.01)。已有研究表明,G0/G1期细胞是细胞周期增殖过程的启动点,细胞周期由G1期进入S期存在G1→S阻滞点,一旦G1期受阻,细胞则不能顺利进入S期进行DNA复制,淋巴细胞的生长就会受到抑制[20-22]。上述结果表明,银杏多糖与左旋咪唑均能诱导淋巴细胞通过G1→S阻滞点,顺利进入S期完成DNA复制,进行有丝分裂,进而促进淋巴细胞的生长发育。
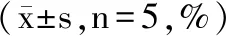
表3 银杏多糖对淋巴细胞周期的影响Table 3 Effects of GBP on lymphocyte
2.3 银杏多糖对淋巴细胞IFN-γ、IL-4分泌的影响
正常情况下,T细胞按一定比例向Th1和Th2细胞分化,两者处于动态平衡,调节正常的免疫应答。IFN-γ能够诱导Th0细胞分化为Th1细胞,Th1细胞又可以分泌IFN-γ、IL-12、IFN-γ等细胞因子同时可抑制过度的Th2细胞介导的免疫反应;IL-4能够刺激Th0细胞分化为Th2细胞,Th2细胞又可以分泌IL-4、IL-6、IL-10等细胞因子同时可抑制过度的Th1细胞介导的免疫反应[23-25],因此,IFN-γ和IL-4之间既相互抑制又自身促进,不仅维持自身平衡对维持Th1和Th2的平衡也有重要作用[26]。由表4可知,与空白组相比,阳性组和银杏多糖处理组的细胞因子IFN-γ、IL-4分泌量极显著增加(P<0.01);与阳性组相比,银杏多糖处理组为200 μg/mL时细胞因子IFN-γ、IL-4的分泌量低于阳性组,但无统计学意义(P>0.05)。与空白组相比,阳性组、25、100、200 μg/mL银杏多糖处理组的IFN-γ/IL-4比值均低于空白组,且阳性组、100、200 μg/mL银杏多糖处理组与空白组的差异有统计学意义(P<0.01),银杏多糖处理组在50、400 μg/mL时IFN-γ/IL-4比值高于空白组,且400 μg/mL银杏多糖处理组与空白组的差异有统计学意义(P<0.01);与阳性组相比,100、200 μg/mL银杏多糖处理组IFN-γ/IL-4比值低于阳性组,但无统计学意义(P>0.05)。银杏多糖处理组IFN-γ/IL-4比值从25 μg/mL起始,到50 μg/mL时上升,到100 μg/mL时下降,直至400 μg/mL时再度上升,形成了IFN-γ/IL-4(Th1/Th2)动态平衡。已有研究对正常BALB/c小鼠分别灌胃银杏外种皮多糖(GBEP)10.00、3.33、1.11 g/kg后,IFN-γ/IL-4比值先降低后升高,且比对照组低[27]。这与本研究结果有一致之处,因此提示银杏多糖能够通过促进细胞因子IFN-γ、IL-4的分泌、维持IFN-γ/IL-4(Th1/Th2)动态平衡,对小鼠的细胞免疫产生一定的促进作用。

表4 银杏多糖对淋巴细胞IFN-γ、IL-4分泌的影响Table 4 Effects of GBP on IFN-γ、IL-4 secretion in
2.4 银杏多糖对淋巴细胞IFN-γ、IL-4 mRNA表达的影响

表5 银杏多糖对淋巴细胞IFN-γ 和IL-4 mRNA的影响Table 5 Effects of GBP on IFN-γ and IL-4 mRNA in
2.4.1 银杏多糖对淋巴细胞IFN-γmRNA表达的影响 由表5和图1可知,与空白组相比,阳性组和银杏多糖处理组IFN-γ细胞因子mRNA表达量均极显著上升(P<0.01);银杏多糖处理组在25~200 μg/mL范围内随银杏多糖浓度的上升其mRNA的表达量持续增加,继续升至400 μg/mL反而下降,说明银杏多糖对诱导淋巴细胞IFN-γmRNA的表达呈双向调节作用。与阳性组相比,银杏多糖处理组在25、50、100、400 μg/mL时,IFN-γmRNA相对表达量极显著低于阳性组(P<0.01),银杏多糖处理组在200 μg/mL时,IFN-γmRNA相对表达量低于阳性组,但无统计学意义(P>0.05)。已有研究发现,海胆多糖体外可以上调小鼠脾淋巴细胞Th1细胞因子IL-2、TNF-α和IFN-γmRNA表达[28]。上述结果表明,银杏多糖可能通过调控IFN-γmRNA表达水平,来调节细胞因子的分泌量,从而对机体免疫功能产生促进作用。
2.4.2 银杏多糖对淋巴细胞IL-4 mRNA表达的影响 由表5和图2可知,与空白组相比,阳性组和银杏多糖处理组IL-4细胞因子mRNA表达量均极显著上升(P<0.01);银杏多糖组在25~200 μg/mL浓度范围内随银杏多糖浓度的上升其mRNA的表达量持续增加,继续升至400 μg/mL反而下降,说明银杏多糖对诱导淋巴细胞IL-4 mRNA的表达量呈双向调节作用。与阳性组相比,银杏多糖处理组在25、50、100、400 μg/mL时,IL-4 mRNA相对表达量极显著低于阳性组(P<0.01),银杏多糖处理组在200 μg/mL时,IL-4 mRNA相对表达量低于阳性组,但无统计学意义(P>0.05)。朱轶锋等[29]研究发现APS的浓度为80~320 μg/mL时对外周血、胸腺、脾脏和法氏囊淋巴细胞增殖,细胞因子IL-2、TNF-β、IFN-γ、IL-4、IL-6的分泌以及相关基因mRNA的表达有显著的促进作用。上述结果表明,银杏多糖可能通过调控IL-4 mRNA表达水平,来调节细胞因子的分泌量,从而对机体免疫功能产生促进作用。

图1 IFN-γ mRNA电泳结果Fig.1 Electrophoresis results of IFN-γ mRNA

图2 IL-4 mRNA电泳结果Fig.2 Electrophoresis results of IL-4 mRNA注:ACTB组:1. marker,2. 空白组,3. 左旋咪唑组,4. 25 μg/mL银杏多糖组,5. 50 μg/mL银杏多糖组,6. 100 μg/mL银杏多糖组,7. 200 μg/mL银杏多糖组,8. 400 μg/mL银杏多糖组;IFN-γ组:9. 空白组,10. 左旋咪唑组,11. 25 μg/mL银杏多糖组,12. 50 μg/mL银杏多糖组,13. 100 μg/mL银杏多糖组,14. 200 μg/mL银杏多糖组,15. 400 μg/mL银杏多糖组;IL-4组:9. 空白组,10. 左旋咪唑组,11. 25 μg/mL银杏多糖组,12. 50 μg/mL银杏多糖组,13. 100 μg/mL银杏多糖组,14. 200 μg/mL银杏多糖组,15. 400 μg/mL银杏多糖组。
3 结论
本文通过体外观察银杏多糖对小鼠脾淋巴细胞增殖、细胞周期、细胞因子分泌及其mRNA表达的影响,表明银杏多糖能够提高小鼠脾淋巴细胞体外免疫活性,其作用机制可能是通过上调IFN-γ和IL-4 mRNA表达来调节细胞因子的分泌量,进而维持IFN-γ/IL-4(Th1/Th2)动态平衡;诱导细胞通过G1-S期关卡,顺利进入S期,DNA复制起始,细胞进行生长与增殖,从而发挥其提高机体免疫功能的作用。对阐明银杏多糖的免疫调节作用机制及开发银杏多糖类的保健功能食品具有一定的参考价值。本文探讨了银杏多糖对小鼠淋巴细胞的免疫调节作用,因此,今后的研究应重点关注银杏多糖在体内的免疫调节作用、其药理活性与多种信号通路关系及如何调控这些信号分子。

