绿原酸通过增强RsmA的表达抑制铜绿假单胞菌生物被膜的形成
唐小丽, 韦俊彬, 封毅, 乐宁, 梁丹娜, 卓少元, 尚立国
1. 广西中医药大学护理学院,广西 南宁 530200; 2. 广西中医药大学教学与实验中心,广西 南宁 530200; 3. 广西中医药大学基础医学院,广西 南宁 530200; 4. 广西中医药大学赛恩斯新医药学院,广西 南宁 530222
铜绿假单胞菌(Pseudomonasaeruginosa)是常见的人类条件致病菌之一,能引起多种感染。其可在病灶处形成生物被膜,使其产生耐药性并逃避人体免疫系统的攻击而导致慢性难治性感染,常规抗菌药物很难将其根除[1-2]。铜绿假单胞菌生物被膜形成的调控机制非常复杂,其中转录后调控因子RsmA发挥关键作用。RsmA主要通过两种途径抑制生物被膜的形成。① RsmA与胞外多糖合成相关基因mRNA的Shine-Dalgarno(SD)序列结合抑制该基因的翻译,最终胞外多糖合成量降低,生物被膜的形成也被抑制[3]。② RsmA与环二鸟苷酸(cyclic dimeric guanosine monophosphate,c-di-GMP)合成酶基因mRNA的SD序列结合抑制该基因的表达,也可在转录水平抑制该基因的表达,导致细胞内c-di-GMP水平降低。c-di-GMP是生物被膜形成中起关键调控作用的第二信使分子,其水平降低会导致生物被膜形成能力下降[4,5]。
随着铜绿假单胞菌生物被膜基础研究的不断深入,生物被膜的抑制剂备受关注,其可通过多个途径来发挥抑制作用。主要包括:①抑制菌体的运动和黏附能力;②抑制胞外多糖等胞外基质的合成;③诱导生物被膜的解体;④抑制群体感应系统[6-9]。生物被膜的抑制剂种类及其来源非常丰富,包括抗菌药物、化学合成药物、微生物次级代谢产物、动植物天然化学产物。绿原酸是植物中存在的一类酚酸类物质,由咖啡酸与奎尼酸结合而成。多种中草药如金银花、杜仲、菊花、蒲公英中绿原酸含量丰富,不少研究表明绿原酸是这些中草药的重要药效成分[10]。温红侠等[11]研究发现,亚抑菌浓度的绿原酸可显著抑制铜绿假单胞菌生物被膜的形成,这与绿原酸抑制群体感应系统有关。铜绿假单胞菌生物被膜的形成不仅受群体感应系统的调控,还受Gac-Rsm系统、c-di-GMP系统以及其他系统的调控,但绿原酸是否可通过群体感应系统之外的其他途径影响生物被膜的形成尚不清楚。因此,本研究重点探讨了绿原酸对Gac-Rsm系统中的关键组分RsmA以及非编码RNA RsmZ和RsmY表达的影响,并对细胞内c-di-GMP水平进行检测,结果发现绿原酸可通过增强RsmA的表达来抑制铜绿假单胞菌生物被膜的形成,为采用绿原酸辅助治疗铜绿假单胞菌感染提供了理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒铜绿假单胞菌为本实验室保存的PAO1菌株,大肠埃希菌为DH5α菌株,于37 ℃培养。β-半乳糖苷酶活性测定中使用的pDG926载体为lacZ融合广宿主载体,蛋白质印迹法中使用的pLAFR3质粒为低拷贝广宿主表达载体,三亲结合实验中所用的辅助质粒pRK2013质粒由本实验室保存。
1.1.2 引物聚合酶链反应(polymerase chain reaction,PCR)引物由华大基因公司合成,引物序列见表1。
1.1.3 培养基和试剂将铜绿假单胞菌PAO1和大肠埃希菌于 LB培养基中进行常规培养。在生物被膜定量测定、实时PCR、胞外多糖测定等实验中均采用Jensen培养基(氯化钠 85.6 mmol/L,磷酸氢二钾 14.4 mmol/L,谷氨酸钠 92 mmol/L,缬氨酸 24 mmol/L,苯丙氨酸 8 mmol/L,葡萄糖 70 mmol/L,硫酸镁 1.33 mmol/L,氯化钙 0.14 mmol/L,硫酸亚铁 0.003 9 mmol/L,硫酸锌 0.008 5 mmol/L,pH=7.3)。抗生素在培养基中的浓度:卡那霉素(kanamycin,Km)50 mg/L;氨苄青霉素(ampicillin,Amp)50 mg/L;四环素(tetracycline,Tc)在铜绿假单胞菌中用100 mg/L,在大肠埃希菌中用10 mg/L。限制性DNA内切酶购于宝日医生物技术(北京)有限公司,高保真DNA聚合酶、DNA消化与RNA反转录试剂盒、实时PCR试剂盒、质粒提取试剂盒、DNA纯化试剂盒购于南京诺维赞生物科技股份有限公司。化学试剂均为分析纯级别,购于北京索莱宝科技有限公司以及国药集团化学试剂北京有限公司。

表1 PCR引物序列
1.2 方法
1.2.1 绿原酸最低抑菌浓度(minimum inhibitory concentration,MIC)的测定采用2倍稀释法测定绿原酸对铜绿假单胞菌PAO1的MIC,主要步骤如下。将新鲜活化的PAO1菌株接种于LB液体培养基,37 ℃,220 r/min培养过夜。5 000 r/min离心后收集菌体,弃上清液,用无菌生理盐水悬浮菌沉淀后再次离心,然后用Jensen培养液悬浮菌体,并适当稀释至OD600=0.05。吸取5 mL菌液加入玻璃试管中,再加入适量的绿原酸乙醇溶液(100 mg/mL),使绿原酸工作浓度为10、5、2.5、1.25、0.625、0.312 5 mg/mL。每个实验浓度设置3个生物学重复。将试管于37 ℃静置培养24 h。观察各试管菌液浑浊情况,判断绿原酸对PAO1菌株的抑菌效果,将菌液未见浑浊的绿原酸最低浓度记为MIC。
1.2.2 菌体生长曲线测定菌体生长曲线测定主要步骤如下。将新鲜活化的PAO1菌株接种于LB液体培养基,37 ℃,220 r/min培养过夜。5 000 r/min离心,收集菌体,弃上清液,用无菌生理盐水悬浮菌沉淀后再次离心,然后用Jensen培养液悬浮菌体,并适当稀释至OD600=0.1。吸取20 mL菌悬液加入100 mL三角瓶中,37 ℃,220 r/min振荡培养,每间隔2 h吸取1 mL菌液测定OD600。为研究亚抑菌浓度的绿原酸对PAO1菌株生长的影响,在振荡培养前向实验组三角瓶中加入绿原酸乙醇溶液,使其工作浓度为0.5 mg/mL,对照组加入等体积无水乙醇。对照组和实验组设置3个生物学重复。
1.2.3 生物被膜测定采用结晶紫染色法定量测定生物被膜[12],主要步骤如下。将新鲜活化的PAO1菌株接种于LB培养液,37 ℃,220 r/min培养过夜。5 000 r/min离心,收集菌体,用灭菌生理盐水洗涤沉淀后再次离心,然后用Jensen培养液悬浮菌体,并适当稀释至OD600=0.1。吸取150 μL菌悬液加入96孔塑料培养板中,用封口膜密封防止水分挥发,37 ℃静置培养24 h。每个样品设置4个生物学重复。吸取培养板中的菌液,适当稀释后测定OD600,加入生理盐水轻轻洗涤培养孔内壁,除去多余的菌体。加入160 μL 0.1%结晶紫乙醇染液,于室温静置染色10 min。除去染液,用蒸馏水轻轻洗涤培养板多次,直到洗涤液不再显蓝色。向每个培养板孔中加入160 μL 30%乙酸溶液,静置10 min,用移液器吹吸几次,确保生物被膜吸附的结晶紫充分溶解于乙酸溶液中,获得结晶紫乙酸洗脱液。吸取150 μL经过适当稀释的结晶紫乙酸洗脱液,用酶标仪测定OD560。生物被膜形成量的计算公式:biofilm biomass =(OD560×稀释倍数)/(OD600×稀释倍数)。为研究亚抑菌浓度的绿原酸对PAO1菌株生物被膜形成的影响,于生物被膜静置培养前向实验组菌悬液中添加一定体积的绿原酸乙醇溶液,使绿原酸工作浓度为0.5 mg/mL,对照组加入等体积无水乙醇溶液。生物被膜测定至少进行3次独立重复实验。
1.2.4 实时PCR用细菌总RNA提取试剂盒提取细菌总RNA,用DNA消化与RNA反转录一体试剂盒对细菌总RNA进行反转录,获得cDNA。对内参基因16 s以及待测基因进行荧光引物设计,利用美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)网站的Primer-BLAST (http://www.ncbi.nlm.nih.gov/tools/primer-blast/)对荧光引物进行扩增效率和特异性检测。实时PCR程序为:95 ℃预变性5 min,95 ℃ 10 s、60 ℃ 30 s共40个循环。以16 s为内参基因,用2-ΔΔCt法分析不同实验条件下待测基因的相对表达情况。实时PCR至少进行3次独立重复实验。
1.2.5 胞外多糖含量测定采用硫酸苯酚法对细菌胞外总多糖含量进行测定[13]。利用Jensen培养液摇床培养PAO1菌株以进行胞外多糖提取,主要步骤如下。将新鲜活化的PAO1菌株接种于LB液体培养液,37 ℃,220 r/min培养过夜。5 000 r/min离心,收集菌体,用灭菌生理盐水洗涤沉淀后再次离心,然后用Jensen培养液悬浮菌体,并适当稀释至OD600=0.1。吸取20 mL菌液加入100 mL三角瓶,37 ℃,220 r/min培养24 h。为研究亚抑菌浓度的绿原酸对PAO1菌株胞外多糖合成的影响,在开始振荡培养前向实验组三角瓶中加入一定体积的绿原酸乙醇溶液,使绿原酸的工作浓度为0.5 ml/mL,对照组三角瓶加入等体积无水乙醇。实验组和对照组各设置3个生物学重复。振荡培养结束后,吸取10 mL菌液,用涡旋仪剧烈振荡后高速离心(13 000 r/min,30 min),收集上清液,加入三倍体积无水乙醇。4 ℃静置过夜,13 000 r/min离心10 min,收集沉淀,用10 mL蒸馏水悬浮沉淀,获得胞外多糖粗提液。胞外多糖提取至少进行3次独立重复实验。硫酸苯酚法测定胞外多糖含量的操作如下:向试管中加入适量胞外多糖粗提液,空白组用蒸馏水,标准组用葡萄糖标准液(C标=0.1 g/L);依次加入5%苯酚水溶液和2.5 mL浓硫酸,混匀,40 ℃水浴锅加热15 min;取出试管,室温冷却,吸取150 μL溶液,用分光光度计测定OD490。胞外多糖含量的计算公式为:C测=OD490测/OD490标×C标。
1.2.6 β-半乳糖苷酶活性测定首先,构建lacZ-cdrA融合表达载体。利用铜绿假单胞菌基因组序列设计引物(lacZ-cdrA-F/R)对cdrA基因启动子(500 bp)进行扩增,用DNA重组酶将获得的目标DNA整合到自身不含启动子的lacZ表达载体pGD926上,通过三亲结合方式导入铜绿假单胞菌PAO1中。三亲结合的主要步骤为:将包含pGcdrA质粒的大肠埃希菌、铜绿假单胞菌PAO1以及含有pRK2013辅助质粒的大肠埃希菌接种于LB培养基,摇床培养过夜;三种菌液等比例混合后,3 000g离心5 min,收集菌沉淀,用无菌生理盐水悬浮后再次离心,用50 μL生理盐水悬浮菌体并滴于LB固体培养平板,37 ℃静置24~48 h;刮下菌苔,用无菌生理盐水悬浮,吸取100 μL菌悬液涂布于含Tc和Cm的LB固体培养板,37 ℃培养 24~48 h,挑出单菌落进行质粒提取和PCR验证,以确保成功获得了含pGcdrA的铜绿假单胞菌。然后,测定β-半乳糖苷酶活性,主要操作步骤如下[14]。用Jensen培养液培养含lacZ-cdrA表达载体的铜绿假单胞菌,每个菌株设置3个生物学重复。培养条件为37 ℃,220 r/min摇床培养10 h,测定OD600。将菌液置于EP离心管,离心后收集菌体,无菌生理盐水洗涤菌体1次后用Buffer Z悬浮菌体。向菌悬液中加入2~3滴氯仿,混匀,37 ℃保温40 min,随后加入200 μL(4.0 g/L)邻硝基苯-β-D-半乳吡喃糖苷(o-nitrophenyl-β-D-galactopyranoside,ONPG)溶液并混匀,37 ℃继续保温,记录反应起始时间。待样品溶液显黄色,加入Na2CO3溶液以终止反应,记录反应终止时间,用酶标仪测定OD420和OD550。按以下公式计算β-半乳糖苷酶的活性:Units=1 000×(OD420-1.75×OD550)/T×V×OD600(T:反应时间,单位为min;V:菌体体积,单位为mL)。β-半乳糖苷酶活性测定至少进行3次独立重复实验。
1.2.7 蛋白质印迹法检测RsmA-flagpLAFR3-RsmA-flag表达载体的构建如下。根据rsmA基因全长序列(包含500 bp启动子)设计引物,设计下游引物时去除rsmA基因的终止密码子并添加flag标签序列。以铜绿假单胞菌基因组DNA为模板进行PCR扩增,获得含500 bp启动子和flag序列的RsmA-flag DNA片段,用EcoR I和BamH I对广宿主质粒pLAFR3进行双酶切线性化,RsmA-flag片段与线性化载体pLAFR3在重组酶的作用下连接获得pLAFR3-RsmA-flag表达载体。通过三亲结合实验,将pLAFR3-RsmA-flag转移到铜绿假单胞菌PAO1中。蛋白质印迹法检测RsmA-flag步骤如下。用Jensen培养液培养含pLAFR3-RsmA-flag质粒的PAO1菌株,培养条件为37 ℃,220 r/min,培养10 h后离心,收集菌体。为探究绿原酸对铜绿假单胞菌细胞内RsmA蛋白水平的影响,实验组添加一定体积的绿原酸乙醇溶液,使绿原酸终浓度为0.5 mg/mL,对照组添加等体积无水乙醇。对照组和实验组各设置3个生物学重复。用超声波细胞破碎仪将收集的细胞破碎(破碎仪的工作条件设置为:30%功率,工作3 s,停歇10 s,共45个工作循环)。细胞破碎后,于4 ℃以 13 000 r/min离心15 min,收集上清液,即为总蛋白抽提液,用考马斯亮蓝法对上清液进行蛋白浓度测定。将总蛋白抽提液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),上样蛋白总量为20 μg。为检测电泳后的蛋白条带,用考马斯亮蓝染色,同时采用湿式转移法将蛋白条带转移到硝酸纤维膜上,5%脱脂牛奶低温封闭过夜。加入以1∶5 000 稀释的flag鼠源单克隆抗体(Sigma公司,美国)10 mL,室温摇动孵育1 h,用含吐温20的Tris缓冲液(Tris buffered saline with Tween 20,TBST)洗膜4次,每次10 min。加入以1∶2 000 稀释的辣根过氧化酶(horseradish peroxidase,HRP)偶联的抗鼠第二抗体IgG(CST公司,美国)10 mL,室温摇动孵育1 h,用TBST洗膜4次,每次10 min。用超敏型增强化学发光(enhanced chemiluminescence,ECL)底物(北京索莱宝科技有限公司)孵育膜,Bio-Rad化学发光检测系统检测膜上的化学发光信号。
1.3 统计学分析
用Excel作图,SPSS 17.0统计软件进行数据分析,均数比较采用独立样本t检验(n=3),P<0.05为有显著性差异。
2 结果
2.1 绿原酸抑制PAO1菌株生物被膜的形成
已有文献表明绿原酸具有抑制细菌生长的作用,本研究首先通过试管2倍稀释法测定绿原酸对PAO1菌株的MIC为2.5 mg/mL,与温红侠等[11]报道的3 mg/mL接近。为研究亚抑菌浓度的绿原酸对PAO1菌株的作用,选择0.5 mg/mL(1/5 MIC)为其工作浓度。从生长曲线来看,该浓度的绿原酸在Jensen培养基中并不影响菌体生长,但在生长后期小幅提高了菌体密度(如图1所示)。
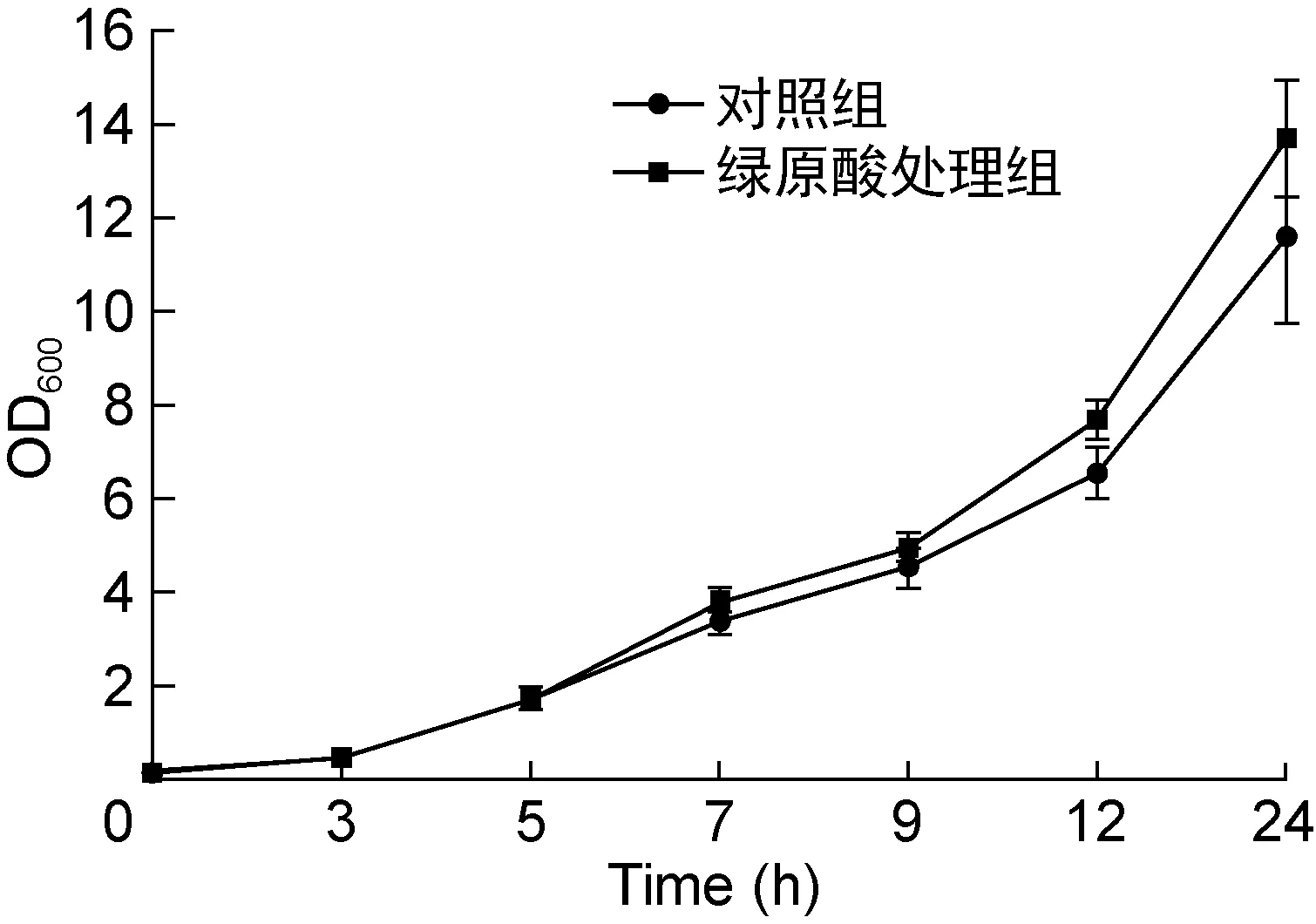
图1 绿原酸对PAO1菌株生长的影响
结晶紫染色法结果显示,绿原酸显著抑制PAO1菌株的生物被膜形成(约31%)(如图2所示)。

注:**P<0.01。
2.2 绿原酸降低PAO1菌株胞外多糖的合成
细菌胞外多糖的合成能力是影响生物被膜形成的重要因素,绿原酸降低PAO1菌株生物被膜形成的可能原因之一是其抑制了菌株胞外多糖的合成。为验证这一猜想,本研究采用乙醇沉淀法分离提取PAO1菌株的胞外总多糖进行含量测定,结果显示绿原酸使PAO1菌株胞外多糖合成量下降了47.3%(如图3所示)。铜绿假单胞菌主要合成三种胞外多糖,分别为alginate、psl和pel,PAO1菌株几乎不合成pel,主要合成psl以及少量alginate[15]。采用实时 PCR检测psl合成关键基因pslA的相对表达量,结果显示绿原酸并未显著改变pslA的表达量(如图4所示),表明其可能通过转录后水平调控方式调节胞外多糖合成基因的表达。虽然本研究构建了含lacZ-pslA融合表达载体的PAO1菌株并检测了其内β-半乳糖苷酶活性,但可能因为pslA启动子活性过低,未检测到β-半乳糖苷酶活性。

注:** P<0.01。
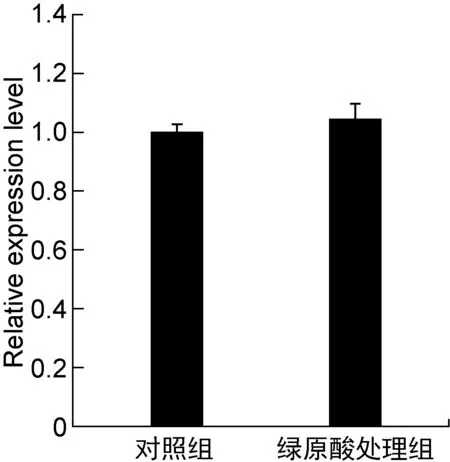
图4 绿原酸对pslA基因表达水平的影响
2.3 绿原酸增强PAO1菌株RsmA的表达
Gac-Rsm系统是调控铜绿假单胞菌生物被膜形成的关键系统,其中RsmA蛋白是RNA结合蛋白,可通过转录后水平调控胞外多糖合成基因pslA的表达,非编码RNA RsmY和RsmZ则通过与RsmA竞争性结合而抑制RsmA的功能[16]。为探究绿原酸是否通过Gac-Rsm系统参与PAO1菌株胞外多糖合成的调控,本研究检测了绿原酸对rsmA、rsmY和rsmZ基因转录的影响。实时PCR结果显示,绿原酸使rsmA转录水平升高了2.39倍,而rsmY和rsmZ转录水平的变化并不显著(如图5所示)。为进一步探究绿原酸对PAO1菌株细胞内RsmA蛋白水平的影响,本研究构建了在RsmA的C端添加flag标签的表达载体,导入野生型菌株,蛋白质印迹法结果显示绿原酸增强了RsmA-flag的蛋白表达水平(如图6所示)。据此推测,绿原酸可通过增强RsmA表达来抑制pslA基因的翻译,进而降低PAO1菌株胞外多糖合成量。已有文献显示铜绿假单胞菌中rsmA的转录水平随菌体密度的增加而增加,表明rsmA的转录是群体感应依赖型的[17]。用实时PCR检测铜绿假单胞菌中三种群体感应系统基因的相对转录水平,结果发现绿原酸作用下las系统以及rhl系统的转录水平有所升高,但没有显著性差异(低于2倍),pqs系统中的pqsA转录水平下降约50%,也没有显著性差异,表明绿原酸并未在转录水平对群体感应系统相关基因的表达进行显著调控(如图7所示)。因此,绿原酸对rsmA转录的调控还需进一步探究。
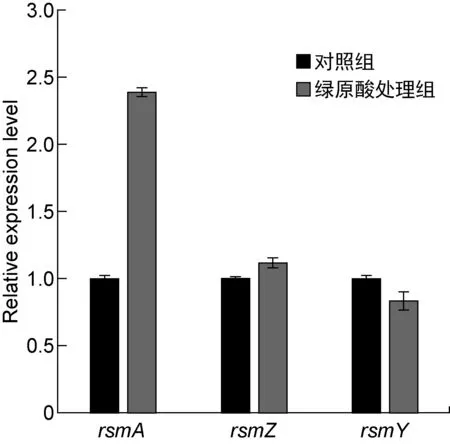
图5 绿原酸对Gac-Rsm系统基因转录水平的影响
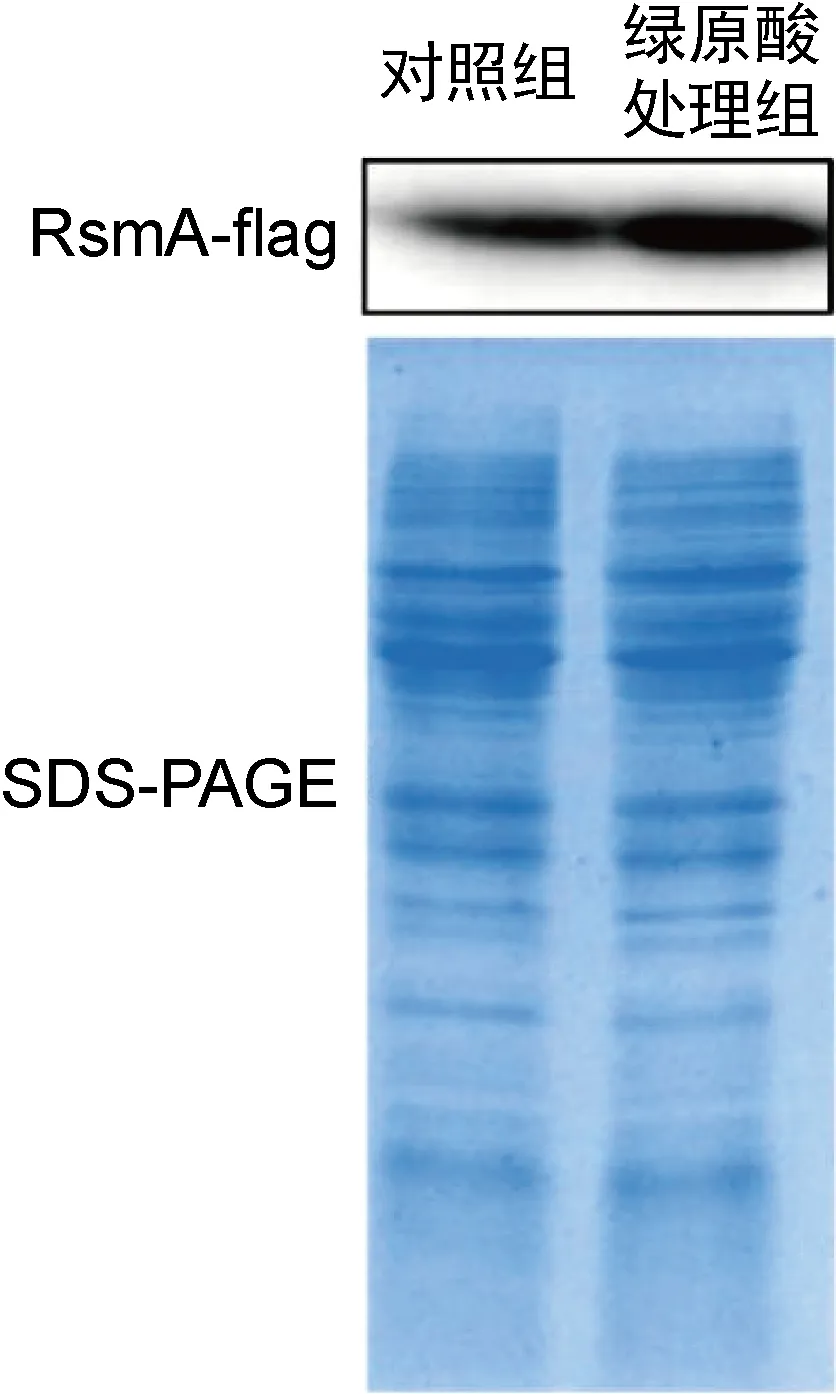
图6 绿原酸对RsmA蛋白表达水平的影响
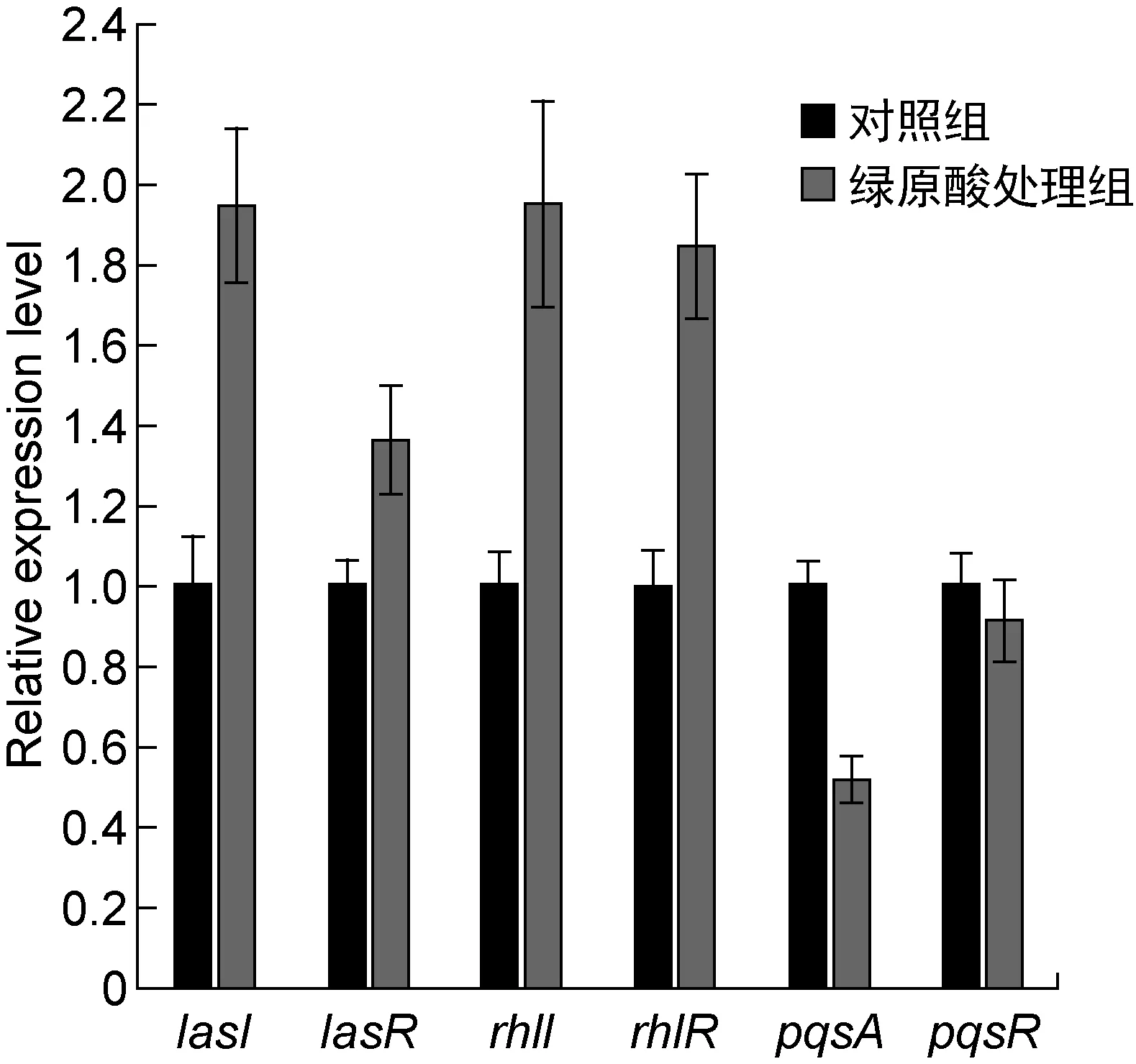
图7 绿原酸对群体感应系统基因转录水平的影响
2.4 绿原酸降低PAO1菌株细胞内c-di-GMP水平
c-di-GMP在铜绿假单胞菌生物被膜形成中起关键调控作用,其胞内含量往往与生物被膜形成量呈正相关,有文献报道RsmA可负调控c-di-GMP水平[4]。本研究也检测到绿原酸可增强PAO1菌株RsmA表达,据此推断其可能也通过RsmA抑制c-di-GMP合成。CdrA是铜绿假单胞菌中与生物被膜形成关系密切的V型蛋白分泌系统的组成成分,cdrA基因的启动子活性可被c-di-GMP显著激活,因此可通过lacZ-cdrA启动子融合载体检测β-半乳糖苷酶活性来测定细胞内c-di-GMP的相对水平[18-19]。结果显示,cdrA启动子活性在正常条件下为133.12,绿原酸导致其下降到77.49,表明绿原酸能显著降低细胞内c-di-GMP水平(如图8所示)。
3 讨论
铜绿假单胞菌对抗生素产生耐药性的原因之一是生物被膜的形成,因此研制生物被膜抑制剂来治疗其感染已经成为非抗生素治疗的重要方向。我国在用中药抑制铜绿假单胞菌生物被膜形成以辅助抗生素治疗方面取得了不少进展,例如陈一强等[20]发现金银花水煎液可显著抑制铜绿假单胞菌的菌体黏附作用与生物被膜形成,与头孢他啶联同可增强头孢他啶对生物被膜内菌体的杀灭作用。进一步研究发现,绿原酸作为金银花的主要有效成分,可抑制铜绿假单胞菌生物被膜的形成,这可能是通过抑制菌体群体感应系统来实现的[21]。本研究在此基础上探究了绿原酸抑制铜绿假单胞菌的作用机制。

注: **P<0.01。
值得指出的是,本研究培养铜绿假单胞菌生物被膜采用96孔微量塑料培养板,操作简单,形成生物被膜的时间短,8~24 h内就可获得成熟的生物被膜,是培养铜绿假单胞菌生物被膜的最常见方法之一。本研究采用结晶紫染色法对PAO1菌株生物被膜进行定量测定,结果显示绿原酸显著降低了PAO1菌株胞外多糖合成以及生物被膜形成,与陈一强的研究结果相似。有趣的是,胞外多糖合成的关键基因pslA的表达未受影响,暗示绿原酸通过转录后调控方式来发挥调控作用。在原核生物中,基因表达的调控方式主要包括转录调控和转录后调控,转录调控占主要地位。但是随着研究的深入,研究者发现越来越多的转录后调控在细菌的各种生理活动中发挥重要作用。到目前为止,铜绿假单胞菌中Gac-Rsm系统是研究的最为深入的转录后调控系统,它在次级代谢产物合成、致病性、氧化胁迫耐受、生物被膜、群体感应等方面都发挥重要作用[16, 22]。本研究通过实时PCR和蛋白质印迹法检测发现绿原酸在mRNA水平和蛋白水平提高了rsmA基因表达,而非编码RNArsmY和rsmZ的转录不受影响。由此推断,在绿原酸存在的条件下,细胞内有更多的RsmA蛋白,这些蛋白通过抑制pslA的翻译而抑制psl的合成,还可通过抑制c-di-GMP的合成来抑制胞外多糖的合成以及生物被膜的形成。值得指出的是,最近Wang等[23]报道绿原酸可通过抑制铜绿假单胞菌群体感应系统来降低菌体的毒性和致病性,但本研究未检测到绿原酸对群体感应系统基因(lasI、rhlI和pqsA)的表达有显著影响,可能原因主要有两个。①本研究采用的培养基为Jensen培养基,是以葡萄糖为碳源的限制性合成培养基,而Wang等的研究选用了营养更加丰富的LB培养基。菌体在不同培养基中生长,众多基因的表达模式发生了显著变化,其中就可能包括群体感应系统相关基因。②本研究与Wang等使用的绿原酸浓度有很大差异,Wang等使用的绿原酸浓度为2.56 mg/mL,比本研究使用的0.5 mg/mL高得多。不少抗菌药物对细菌生理活动和基因表达的调控与其工作浓度密切相关,绿原酸发挥功能的方式复杂而多样,在较高浓度与低浓度下并不一致,暗示其可通过多种途径来抑制铜绿假单胞菌生物被膜的形成。

