猕猴桃溃疡病枝条挥发物的GC-MS分析
周良强 汪洋 张景荣 陈莉 唐立忠 李臻 卓明 黄昭贤

摘 要 为了研究猕猴桃感染溃疡病后枝条挥发物的组分特征,给探索猕猴桃溃疡病的病理和抗性机制提供参考,应用气相色谱-质谱联用(GC-MS)技术鉴定健康枝条和感病枝条挥发物的化学成分,采用离子流峰面积归一化法计算各成分的相对含量。结果:从猕猴桃健康和感病枝条的挥发物中分别鉴定出73 和 67个挥发性化合物,合计81种成分,二者相同组分59个,包括烷烃类、烯烃类、醇类、酚类、醛类、酮类、苯环类化合物、杂环类化合物、呋喃类和含氮化合物,其中烷烃类化合物和苯环类化合物为猕猴桃枝条的主要成分。进一步比较发现,感病枝条中含有2-乙基甲苯、2,3,5,6-四甲基苯酚等8种特有物质,且4-乙基甲苯、十八烷等物质比健康枝条含量明显降低。
关键词 猕猴桃溃疡病;枝条;挥发物;GC-MS分析
中图分类号:S436.634 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2021.10.001
猕猴桃(Actinidia Lindl.)富含多种氨基酸、矿物质和维生素C,具有较高的营养价值与保健功效,现已成为许多地区的经济支柱产业[1-3]。猕猴桃果肉颜色多样,其中,红心猕猴桃口感佳、色彩美,颇受消费者青睐。自1997年世界上首个红心猕猴桃品种——中华猕猴桃‘红阳育成以来,红肉品种的选育成为了研究热点。尔后,以‘红阳猕猴桃为材料选育出一系列红肉新品种,如‘红华‘晚红‘东红‘红什1号 [4-7],已作为我国猕猴桃育种中最主要的骨干亲本[8]。红心类型的猕猴桃品种,虽然其食用品质优异,但大多对溃疡病敏感[9],目前,主流学者认为该病由丁香假单胞杆菌猕猴桃致病变种(Pseudomonas syringae pv. Actinidiae,Psa)引起。猕猴桃溃疡病具有传播快、致病力强、难治愈等特点,是一种毁灭性的病害,可导致短期内大面积植株死亡,给生产造成重大经济损失[10]。四川是全国猕猴桃主要产区之一,近年全省猕猴桃种植面积逐年增加,产量位居全国前列,其中,红心猕猴桃产量占全国红心猕猴桃的90%以上[11]。猕猴桃溃疡病在四川省各大栽培区均有发现,近年来呈现逐步蔓延、病情不断加重的趋势。以往对猕猴桃溃疡病的研究多侧重于防治策略,包括农业防治、化学防治和生物防治方法[12-13]。最近,李亚巍等对该病菌在田间感病猕猴桃植株上的分布情况及侵染后的传播规律进行了报道[14];李靖等鉴定了四川主栽猕猴桃品种对溃疡病的抵抗能力[15]。
猕猴桃溃疡病会导致植株产生抗感生理反应,引起体内代谢产物的变化。迄今对猕猴桃组织中挥發性病理产物的研究尚未见报道。本研究运用气相色谱-质谱联用仪(GC/MS System)分别分析了‘红阳猕猴桃健康植株枝条与感溃疡病枝条的韧皮部、木质部及髓心组织中挥发性次生代谢产物的种类和含量差异,旨在为探索猕猴桃溃疡病的病理和抗性机制提供参考。
1 材料与方法
1.1 试验材料
2020年3—5月,值猕猴桃溃疡病高发期,分别于雅安市的名山区、雨城区、芦山县采集‘红阳猕猴桃感病枝条;在成都双流一个9年未发生溃疡病的猕猴桃园区采集健康枝条。采后,先用超纯水洗去枝条表面的灰尘和杂质,待晾干后在健康和染病枝条部位分离出韧皮部、木质部、髓部三类组织,染病枝条在节间处病斑取样,对照选取与感病枝条同等枝龄和粗度的健康枝条。
1.2 试验方法
1.2.1 样品处理
每个样品取0.2 g放入装有吸附剂PorapakQ80/100的提取管中,密闭吸附48 h后,去除样品,加入适量正己烷浸泡30 min。取上清液再经微孔过滤膜过滤后置于进样瓶中待测。
1.2.2 挥发物检测
采用安捷伦7890B-7000D气相色谱-三重四级杆质谱联用仪,色谱柱为HP-5MS (30 m×250 μm×0.25 μm),进样量为1 μL,升温程序为40 ℃保持3 min,之后以每分钟上升6 ℃到280 ℃,保持3 min,最后以每分钟上升6 ℃到310 ℃,保持10 min。载气为高纯氦气。离子源温度为280 ℃,质谱扫描范围m/z为50~500。
1.2.3 挥发物定性与半定量
根据GC/MS总离子图,对各色谱峰对应的质谱图进行解析,通过检索比对标准质谱图谱数据库(NIST14),并结合匹配分数、各成分的保留时间、质谱裂片图及文献查对,鉴定其化学成分。采用离子流峰面积归一化法计算各挥发物组分的相对含量。
2 结果与分析
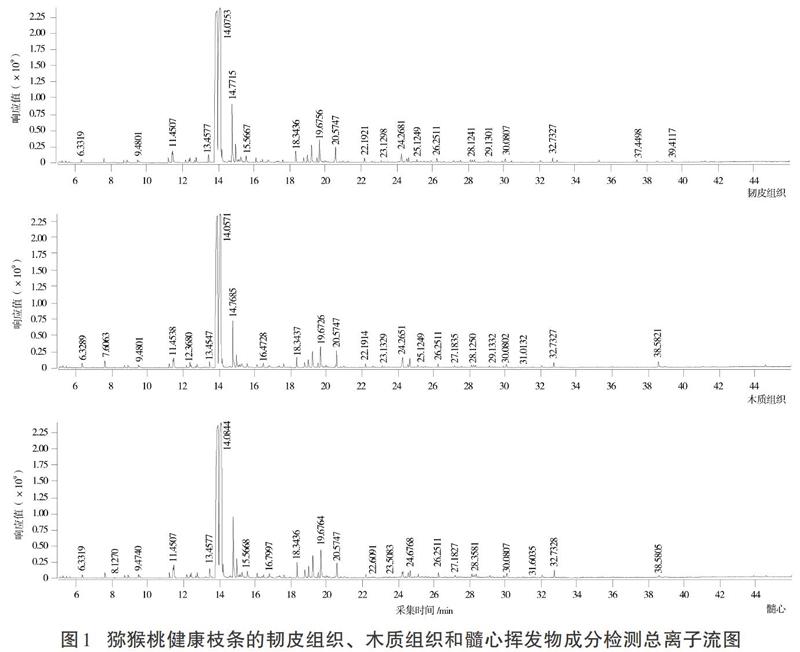
2.1 健康和溃疡病猕猴桃枝条挥发物总离子流图
通过动态顶空吸附法+气相色谱-质谱法分离到多种化学成分,得到健康和溃疡病猕猴桃枝条的韧皮组织、木质组织和髓心样品挥发物成分检测的总离子流图(见图1、图2)。
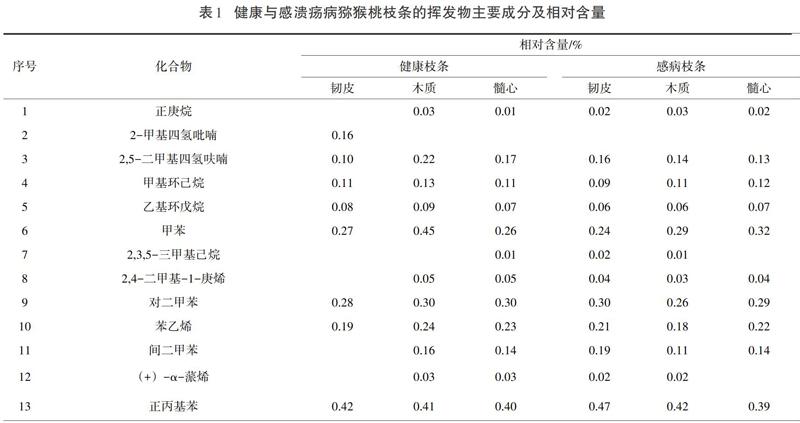
通过CAS号检索和文献核对,在健康枝条和溃疡病枝条的韧皮组织、木质组织和髓心中共鉴定出81个化合物(见表1),其中苯环类化合物25个、烷烃类23个、烯烃类11个、醇类4个、酚类4个、酯类3个、呋喃类3个、杂环类化合物2个、酮类2个、醛类2个,含氮和含碘化合物各1个。按离子流峰面积归一化计算各挥发物组分的相对含量,结果显示在健康和感病枝条的韧皮组织、木质组织和髓心中,均以1,2-二乙苯含量最高,达65%以上。
2.2 健康与感病枝条挥发性化合物组分差异
由表1可知,健康枝条与感病枝条3种不同组织的化学成分组成存在明显差异的有22个,包括苯环类化合物、醇类、酚类、烷烃类、烯烃类,其中,4-丙基甲苯(C10H14)、1-丁烷-2-基-2,4-二甲基苯(C12H18)、香芹酚(C10H14O)、乙酸橙花叔醇酯(C17H28O2)、柏木脑(C15H26O)和3,4-环氧四氢呋喃(C20H30O4)等14个成分仅存在于健康猕猴桃枝条中,而2-乙基甲苯(C9H12)、1-甲基-4-(1-甲基乙烯基)苯(C10H12)、5-甲基-2,3-二氢-1H-茚(C10H12)、2,3,5,6-四甲基苯酚(C10H14O)和2,6,11,15-四甲基十六烷(C20H42)等8个化合物仅存在于溃疡病猕猴桃枝条中。
2.3 健康与感病枝条挥发性化合物相同组分含量变化
健康猕猴桃枝条与溃疡病猕猴桃枝条共有59个相同挥发性化合物,其中有些成分的含量在二者中存在较大的差异。与健康枝条相比,在感病枝条中,对二乙基苯(C10H14)含量大幅增高,而4-乙基甲苯(C9H12)、3-乙基苯甲醛(C10H12)、4-异丙基苯甲醇(C10H14O)、正十七烷(C17H36)和正十八烷(C18H38)等含量明显降低。
3 结论与讨论
本研究采用顶空固相微萃取与气质联用(GC-MS)的方法,分析了猕猴桃健康和感溃疡病枝条挥发物的成分。从健康和感病枝条中,共测定出苯乙烯(C8H8)、正丙基苯(C9H12)、油酸酰胺(C18H35NO)等81种挥发物组分,结果表明健康和感溃疡病猕猴桃枝条挥发物的主要成分为1,2-二乙苯(C10H14)、2,4-二甲基苯乙烯(C10H12)和对乙基苯乙酮(C10H12O),二者挥发性化学物种类差异较大,且部分相同化合物的含量也存在明显差异。在枝条的木质组织中,挥发物中的萘(C10H12)、油酸酰胺(C18H35NO)和2,6-二叔丁基-4-甲基苯酚(C15H24O)3种物质含量感病枝比健康枝低,感病枝分别为健康枝的23%、19%和16%。而2-乙基甲苯(C9H12)、1-甲基-4-(1-甲基乙烯基)苯(C10H12)、2,3,5,6-四甲基苯酚(C10H14O)、5-甲基-2,3-二氢-1H-茚(C10H12)等8个化合物仅在感病枝中检测出。由此可见,猕猴桃枝条感染溃疡病后其挥发物的含量发生了明显的变化。有研究表明,植物受到病虫害的侵害时,会产生许多次生代谢物质来进行调节,以抵抗病虫害的侵袭[16]。
关于猕猴桃溃疡病的致病机制,普遍认为是丁香假单孢细菌感染所致。而本研究中,在染病枝条中还发现真菌侵染。本文发现的差异挥发物可能是猕猴桃在遭受病原侵害后的病理代谢产生,也可能由病原代谢的合成或降解所产生。有研究者在感病枝条中普遍发现小蠹虫,从而认为该病害是由小蠹虫为害引起[17]。大量的研究证实,植物挥发物对昆虫产生引诱或驱避作用[18-20]。本研究中,感染溃疡病后枝条的特有挥发物质,也可能与植物驱避小蠹虫等昆虫的生理生化作用有关。有关上述问题的科学解答,还需要进一步研究。
参考文献:
[1] Kim JH, Kim JW, Kim SC, et al. Kiwifruit (Actinidia chinensis) extract annuls chronic insulininduced insulin resistance in l6 skeletal muscle cells [J]. Food Science and Biotechnology, 2013, 22(04): 1091.
[2] Oh HJ, Jeon SB, Kang HY, et al. Chemical composition and antioxidative activity of kiwifruit in different cultivars and maturity [J]. Journal of the Korean Society of Food Science and Nutrition, 2011, 40(03): 343.
[3] 张迪,高小宁,赵志博,等.陕西省猕猴桃细菌性溃疡病菌(Pseudomonas syringae pv. actinidiae) Rep-PCR的遗传多样性分析[J].果树学报,2016,33(03):340-349.
[4] 王明忠,唐伟,侯仕宣.红肉猕猴桃新品种‘红华的选育[J].中国果树,2005(04):7.
[5] 贾谭科,党宽录.猕猴桃新品种‘晚红的选育[J].山西果树,2011(04):11.
[6] 钟彩虹,黄宏文.红心猕猴桃新品种‘东红[J].中国果业信息,2016,33(12):61.
[7] 王麗华,郑晓琴,庄启国,等.红肉猕猴桃新品种‘红什1号[J].园艺学报,2016,43(01):193-194.
[8] 姜志强,贾东峰,廖光联,等.中国育成的猕猴桃品种(系)及其系谱分析[J].中国南方果树,2019,48(06):142-148.
[9] 方金豹,钟彩虹.新中国果树科学研究70年——猕猴桃[J].果树学报,2019,36(10):1352-1359.
[10] 高小宁,赵志博,黄其玲,等.猕猴桃细菌性溃疡病研究进展[J].果树学报,2012,29(02):262-268.
[11] 马利,尹勇,封传红,等.四川省猕猴桃溃疡病发生现状及绿色防控技术体系的建立[J].中国植保导刊,2017,37(11):80-83.
[12] 钟彩虹,李黎,潘慧,等.猕猴桃细菌性溃疡病的发生规律及综合防治技术[J].中国果树,2020(01):9-13,18.
[13] 陈虹君,杨国安,迟旭春.猕猴桃溃疡病致病因素与防治经验探讨[J].南方农业,2018,12(17):1-2.
[14] 李亚巍,王小洁,吴群,等.猕猴桃溃疡病菌的田间分布及其传播规律[J].生物学杂志,2019,36(02):46-50.
[15] 李靖,涂美艳,钟程操,等.6个猕猴桃品种抗溃疡病差异及生理机制研究[J].西南农业学报,2019,32(11):2579-2585.
[16] Seskar M, Shulaev V, Raskin I. Endogenous Methyl Salicylate in Pathogen-Inoculated Tobacco Plants[J]. Plant Physiology,1998, 116: 387-392.
[17] 黄昭贤.猕猴桃现代栽培与园区化管理技术[M].成都:四川科学技术出版社,2017:228-234.
[18] Du JW. Current and future prospects for insect behavior-modifying chemicals in China[J]. Agric Chem Biotech, 2000, 43(04): 222-229.
[19] Dickens JC. Orientation of Colorato potato beetle to natural and synthetic blends of volatiles emmited by potato plants Agric Chem Biotech[J]. Agri For Entomol, 2000, 02(03): 167-172.
[20] 刘婷,李为争,游秀峰,等.常见植物挥发物对烟蚜的驱避和抑制定殖活性[J].中国烟草学报,2013,19(02):77-84.
(责任编辑:丁志祥)

