蔬菜体内多环芳烃(PAHs)的调控机制研究
巫桂芬,龙明华,乔双雨
(1广西大学农学院,南宁 530004;2广西民族师范学院,广西崇左 532200)
0 引言
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)主要是煤、石油、木材、烟草、有机高分子化合物等有机物不完全燃烧时产生的挥发性碳氢化合物[1]。迄今已发现有200多种PAHs,欧美32个国家在欧洲环境会议上正式将其中危害较大的16种PAHs化合物列入优控的名单中(基本信息见表1)[1-2],其中有相当部分具有致癌性,如苯并α芘、苯并α蒽等[3]。植物可以从土壤和空气中吸收外源的PAHs,也可以体内合成少量的PAHs,并在体内发生转移或者转化作用[4]。在PAHs胁迫下,蔬菜的生长、元素的吸收及其品质指标都发生较大的改变[5]。研究表明,PAHs能促进部分植物的根对土壤中N、P、K和S的吸收同化,并加速其向茎叶的转移[6]。而上述这些元素在植物的生存生长中发挥了极其重要的作用,能直接影响植物的新陈代谢以及物质的转移。蔡顺香等[7]研究表明,芘对茎叶粗蛋白含量、粗纤维和可溶性糖含量有影响。以上研究结果表明,PAHs与蔬菜体内营养成分间存在一定的关联性。而关于蔬菜体内PAHs调控机制还少见相关报道。本研究以6种具有一定代表性的蔬菜品种为材料,研究其体内PAHs与蛋白质、脂肪、VA、VB1、VC、VE、Ca2+、Fe2+、Na+和K+等物质的互作关系,以期揭示PAHs在蔬菜体内的调控机制,为降低蔬菜体内多环芳烃的含量提供理论指导。

表1 16种优控PAHs相关信息
1 材料与方法
1.1 材料与试剂
1.1.1 材料 以玻璃生菜(Lactucasativavar.capitata)、包心芥菜(Brassicajuncea)、日本冬瓜(Benincasahispida)、金韩密本南瓜(Cucurbitamoschata)、‘桂丰3号’四棱豆(Psophocarpustetragonolobus‘GuifengⅢ’)、‘桂豇2号’豇豆(Vignaunguiculata‘Guijiang Ⅱ’)为供试材料。
1.1.2 试剂与仪器 16种PAHs混合标样,2000 μg/mL(美国AccuStandard公司);乙腈、二氯甲烷、正己烷均为色谱纯;无水硫酸钠为分析纯;高效液相色谱仪(美国Waters 2695,含2998紫外检测器),色谱柱(250 mm×4.6 mm,5 μm,美国色谱科公司)。弗罗里硅土SPE柱(1000 mg/6 mL,德国SimonAldrich公司)。
1.2 试验方法
1.2.1 试验设计 生菜、芥菜、冬瓜、南瓜、四棱豆和豇豆等蔬菜样品均栽培于广西大学农学院基地。主要采用以上蔬菜生长期为60天的食用部位作为检测样品。每种蔬菜随机抽取15株植株的样品混样。采回样品用自来水冲洗2~3次再用蒸馏水洗2次,滤纸吸干表面水分后将每种蔬菜样品分成2份,一份用于蛋白质(PR)、脂肪(fat)、VA、VB1、VC、VE、Ca2+、Fe2+、Na+和K+等成分的测定,另一份用于PAHs测定。PAHs测定的样品晾干约20%水分后置于烘箱中烘干(烘箱温度设为恒温55℃)。烘干的样品用研钵研磨成粉末,保存于4℃冰箱,待用。试验中涉及的含量测定均设3次生物学重复。
1.2.2 试验方法
(1)PAHs提取与净化。称取2.00 g粉末样品于离心管中,加入10.00 g的无水硫酸钠,再加入30 mL二氯甲烷于超声波中萃取30 min(萃取重复2次),萃取液经5000 r/min离心,取上清液于旋转蒸发仪上蒸发至干,用30 mL正己烷溶解。
(2)磺化。加入3 mL 60%浓硫酸,震荡5 min,待出现乳化现象,加入30 mL2%无水硫酸钠溶液破乳,静置分层后弃去下层水相,用超纯水洗涤有机相至中性后过无水硫酸钠柱,浓缩至3 mL,进行固相萃取净化。
(3)净化。样品过容量为5 mL正己烷活化的弗罗里硅土小柱,采用12 mL洗脱液(V正己烷:V二氯甲烷=2:8)洗脱,收集液旋转蒸发至干,再加入1.5 mL乙腈充分溶解,并过0.22 μm有机滤膜后用于HPLC/UV检测。
(4)样品PAHs检测。样品进样量为30 μL,检测波长254 nm,柱温为30℃,流动相为水和乙腈。为了有利于16种PAHs有效分离以及减少分析所用时间,试验采用梯度洗脱方式(表2),采用外标法进行PAHs定量。
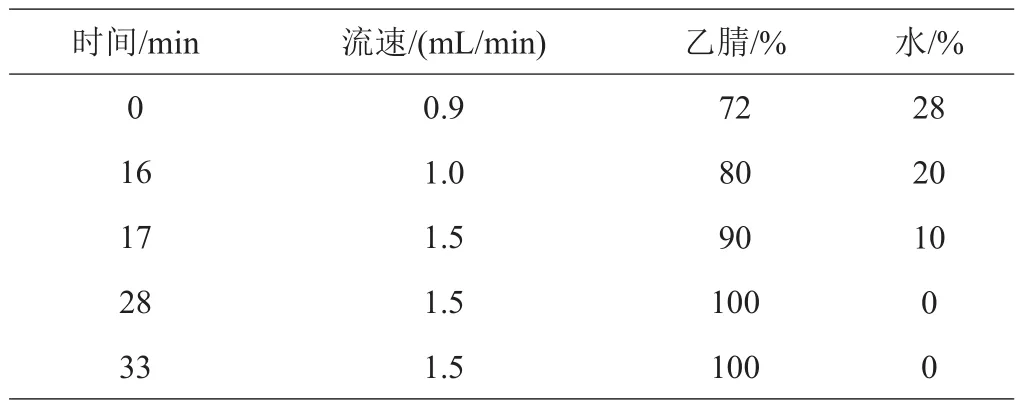
表2 流动相梯度洗脱程序
1.3 质量控制与数据分析
质量保证与质量控制按照文献[8]进行。通过空白加标(用等量的石英砂代替分析的样品,加入PAHs混合标样)和基质加标(PAHs混合标样加入实际空白样品)进行回收率测定分析,加标水平为1000 μg/kg,平行测定5次。
蔬菜体内蛋白质含量测定参照文献[9],脂肪测定方法参照文献[10]进行,VA、VB1、VC、VE、Ca2+、Fe2+、Na+和K+等物质含量由广西质检院代测。
研究过程所涉及的物质含量、平均值、求和等运算采用Excel 2013,涉及的显著性和相关性分析采用SPSS 18.0。
2 结果与分析
2.1 质量控制与方法回收率
16种PAHs各组分在50~5000 μg/L范围内线性关系良好,检出限范围为0.5~6.0 μg/kg(表3)。空白试验中各目标化合物低于检出限;5次空白加标和基质加标16种PAHs的平均回收率为61.74%~100.00%和69.01%~149.26%;最后结果经过空白扣除。本试验设计进行的方法回收率试验为样品检测的准确性和可靠性提供了基本的保障。
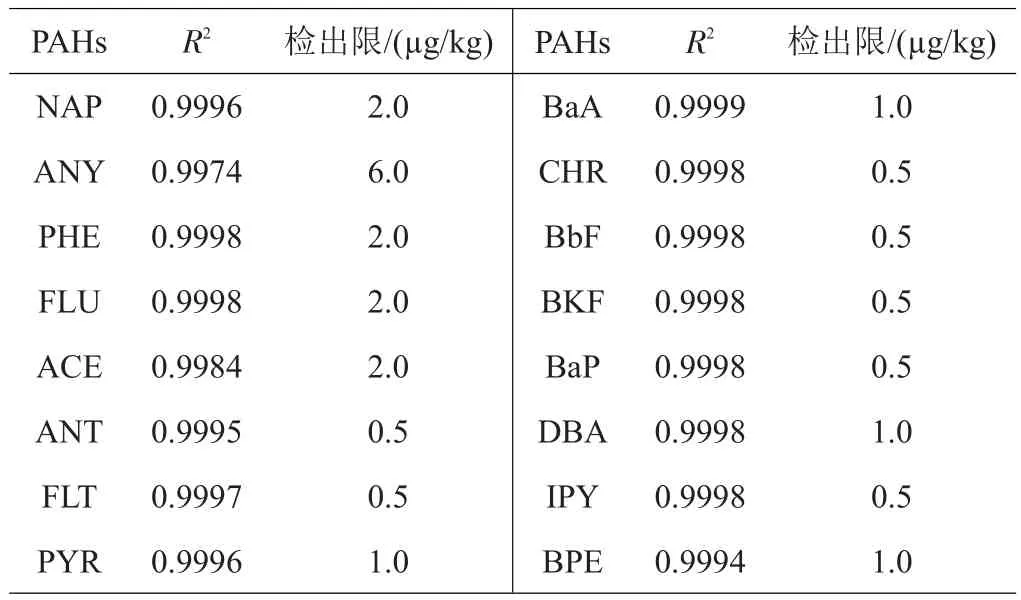
表3 16种PAHs相关系数及其检出限
2.2 蔬菜体内16种PAHs单体含量分布
结果表明,生菜、芥菜、冬瓜、南瓜、四棱豆和豇豆体内及其栽培土壤中PAHs的种类和含量不同(图1)。土壤中仅检测出5种PAHs。蔬菜中叶类菜含有12~14种,瓜类含有11种,豆类含有5~7种。蔬菜体内PAHs以2~4环为主,5、6环的PAHs则表现为选择性的存在部分蔬菜体内。16种优控的PAHs中,NAP和ANY在生菜、芥菜、冬瓜、南瓜、四棱豆和豇豆中都能检测到,其含量在10.35~77.75 μg/kg之间,说明蔬菜较容易吸收或合成这2种物质。

图1 蔬菜体内PAHs的含量分布
2.3 不同蔬菜体内∑PAHs含量分布及差异分析
不同类别蔬菜∑PAHs含量(∑PAHs指16种优控PAHs的含量之和)不同。芥菜体内的∑PAHs含量最高,为958.59 μg/kg;其次是南瓜,含量为765.36 μg/kg;最低的是生菜,含量为212.37 μg/kg。芥菜中∑PAHs含量分别是生菜中的4.5倍和四棱豆的3倍。四棱豆和豇豆体内的∑PAHs含量分别为316.81和325.32 μg/kg,两者间差异未达到显著性(P<0.05)。此外,其余蔬菜间∑PAHs含量均达到显著性差异。
2.4 蔬菜体内营养成分含量及其差异分析
不同蔬菜其体内成分不同,因而吸收和运输PAHs的能力不同。6种蔬菜中蛋白质、VA、Ca2+和K+的含量都相对较高,VB1含量最低。Na+和K+的含量表现出明显的品种差异,且达到显著性差异(P<0.05)。蛋白质的含量最高的为豆类,含量最低的为瓜类。芥菜中VA和Ca2+的含量比其余5种的高;四棱豆中的脂肪含量最高,是南瓜的11倍。蔬菜体内脂肪含量高有利于脂溶性物质的吸收与运输。蔬菜体内Na+、VB1、VC、VE、Fe2+的含量比蛋白质、脂肪、VA、K+、Ca2+的低,且范围在几倍到几十万倍之间(图3)。可见,不同蔬菜体内成分含量不同,同一种蔬菜不同成分含量也表现出明显的差异性,这与蔬菜自身的生长需要有关。
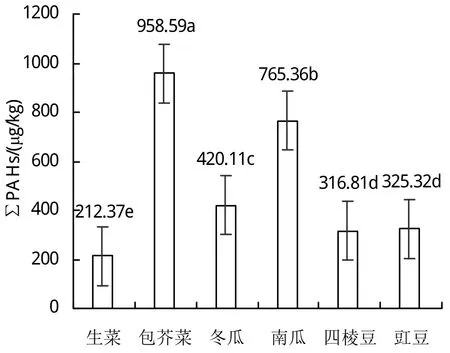
图2 蔬菜体内的∑PAHs含量分布及差异性分析

图3 6种蔬菜营养成分含量分布
2.5 蔬菜体内PAHs与其营养成分相关性分析
通过对每种蔬菜体内蛋白质、脂肪、VA、VB1、VC、VE、Ca2+、Fe2+、Na+和K+等10种营养成分与16种PAHs单体进行两两相关性分析,表明16种PAHs中有9种与部分营养成分相关性达到显著水平。其中表现为正相关类型多于负相关。蛋白质、VE、VB1、Fe2+与BaP有显著相关性;VA、Ca2+、Na+与ANY、ACE、PHE、FLU、CHR、BKF、PYR、BPE等有显著的相关性,其相关系数分布情况如图4。
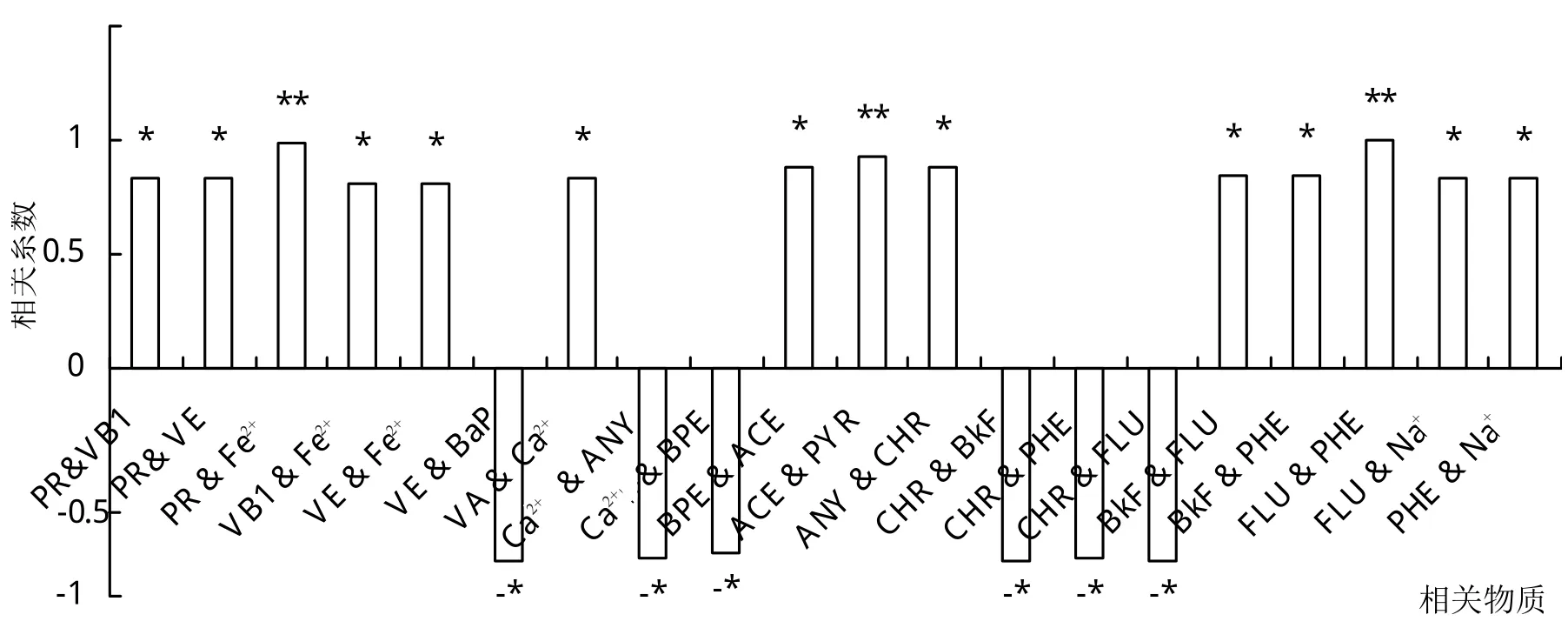
图4 蔬菜体内营养成分与PAHs相关性
3 结论
(1)蔬菜体内PAHs以2~4环为主,5、6环的PAHs则表现为选择性的存在某些蔬菜体内。在蔬菜生长时间及生长环境相同的情况下,其体内PAHs种类及含量由多到少表现为叶类菜>瓜类>豆类。
(2)蔬菜体内的营养成分不仅为人类提供营养,而且对PAHs有积极的调节作用。蛋白质、VE、VB1、Fe2+对BaP具有协同的抑制作用,VA、Ca2+对ANY、ACE、PHE、FLU、CHR、BKF、PYR、BPE等有直接或间接的抑制作用,而Na+促进了BKF、FLU和BPE在蔬菜体内的积累。
4 讨论
4.1 蔬菜体内PAHs含量分布特征
本研究通过对6种不同蔬菜体内PAHs检测分析,得出叶类菜PAHs种类比瓜类和豆类多。该结果与乔双雨等[12]研究结果一致。蔬菜的叶面积大小和气孔数量直接影响了空气中PAHs吸收和积累[8,11]。因此叶类菜的PAHs不仅含量高种类也多。而16种优控PAHs中,低环PAHs主要存在于大气中,这些PAHs更容易与植物叶片接触。单位质量下,瓜类和豆类的果实与大气的接触面积相对较小,直接吸收PAHs的量比叶片少。其二,不同的器官或组织对PAHs的积累或转化有差别[13]。四棱豆中PAHs种类比其他蔬菜少,且∑PAHs也相对较低,这可能是四棱豆中某些物质具有分解PAHs或抑制PAHs生成的作用。同是叶类菜,芥菜中∑PAHs的含量是生菜的4.5倍。这可能跟物种间结构和成分及生长发育阶段不同有关。蔬菜体内PAHs的含量不仅与检测部位有关,还与蔬菜自身的形态和生理的差异有关[14]。因此不同类别蔬菜或不同组织器官对于PAHs吸收、运输和积累等具有一定的选择和调控作用。
蔬菜不同器官结构和功能不同,体内成分不同,其对PAHs的吸收、合成、积累或转化的能力不同。有研究表明PAHs可通过根、茎、叶等器官进入蔬菜体内,并在不同器官中发生转移或转化[13-14]。孔祥胜[15]的研究表明南宁市大气中∑PAHs浓度范围在174.59~581.06 ng/(m2·d)。按以上研究结果,空气中的PAHs全部被吸收到蔬菜体内,那么蔬菜生长期间(60天)单位面积(1 m2)能接收到的PAHs含量范围为10.48~34.86 μg。而检测蔬菜样品接触空气的面积远小于1 m2。以最大值计算,土壤和空气中∑PAHs含量之和小于南瓜器官中的含量。说明蔬菜体内具有一定的合成或转化功能,同时该过程受到体内成分的调节作用。
4.2 蔬菜体内营养成分与PAHs的调控机制
不同种类蔬菜体内成分及含量不同。同一机体内,物质间既分工又合作,它们共同承担机体的正常运行。研究表明,植物体内的PAHs吸收或合成受到体内成分的调控[16]。根据相关性分析得出2个关联类群(图5)。类群1由蛋白质、VB1、VE、Fe2+共同抑制蔬菜体内BaP的含量变化,BaP受到VE的直接抑制作用,同时受到蛋白质、VB1、Fe2+的间接调控。类群2表明VA、Ca2+对蔬菜体内 ANY、ACE、PHE、FLU、CHR、BKF、PYR、BPE等有抑制的作用,而Na+能促进蔬菜体内BKF、FLU和BPE吸收与积累。

图5 蔬菜体内部分PAHs的调控路径
蔬菜生理结构及成分差异使其在外界不良入侵时,表现出了不同的反应。类群1中蛋白质作为其中心调节元,具有免疫、调节机体的生命活动和运输载体的功能,是组成细胞或组织的重要成分。机体所有活动几乎都需要蛋白质的参与[17],蛋白质通过直接影响VB1、Fe2+和VE来调控具有强致癌性的BaP。由于活体蔬菜中富含VB1和VE,所以在活体蔬菜中难以检测到BaP,而在烧烤的食物中却容易检测出较高的含量。VB1主要作用是协调碳水化合物的新陈代谢和能量的产生[18],VB1含量高有利于植物的代谢活动,为蛋白质的合成提供能量[19]。Fe2+是多种蛋白酶的重要组成成分,蛋白质的含量增加对Fe2+的要求也随之增加。而Fe2+的还原性及VA和VC的活性在VE的作用下得以保持相对平衡的水平[20]。VE除了具有抗氧化的作用,还具有清除自由基的能力,对BaP自由基的清除起到了积极的作用[21]。
类群2中,VA具有很强对抗自由基的作用,可有效去除机体内PAHs自由基,它能促进蔬菜体内Ca2+的吸收[22],并抑制PAHs的相互转化。Ca2+是植物细胞壁和胞间层的组成成分,其对碳水化合物和蛋白质的合成以及植物体内生理活动的平衡等起着重要作用[23]。Ca2+能促进原生质胶体凝聚,降低水合度,使原生质粘性增大,减少植株体内营养物质外渗[24]。因此蔬菜可通过Ca2+含量调节其体内水合度和粘性,并影响PAHs的吸收、转移和转化[25]。Na+和K+的含量一定程度上影响了蔬菜的气孔开闭[26-27],从而直接或间接地影响了蔬菜体内PAHs的分布情况。在蔬菜体内PAHs,除CHR对BkF、FLU和PHE有抑制的作用外,ANY与CHR存在相互促进作用,同时BPE与ACE、PYR及BkF与PHE、FLU也表现为促进的作用。说明在植物体内的PAHs除了自身合成和体外吸收外,部分PAHs间还可以发生相互转化。
4.3 展望
本研究从6种常见蔬菜营养成分在代谢过程中起的作用及蔬菜体内营养成分含量与PAHs含量变化关系,探讨蔬菜体内PAHs调控机制。这为降低蔬菜体内PAHs含量提供了一种新的方法。本研究涉及的成分较多,而结果中未对相关性较弱的物质进行进一步分析,因此可能漏掉一些非关键的辅助成分,这些物质也会影响蔬菜体内PAHs含量变化。所以在后续的研究中应考虑弱相关物质对PAHs的影响,从而建立起更完善的调控路线。

