Box-Behnken响应面法优化白藜芦醇Labrasol/P407混合胶束处方工艺及体外评价
韩德恩 ,申延利,田 萍,位恒超,祝侠丽,贾永艳 *
1.河南中医药大学药学院,河南 郑州 450046
2.河南省中药特色炮制技术工程研究中心,河南 郑州 450046
3.河南省中医药研究院,河南 郑州 450004
白藜芦醇(resveratrol)是一种天然脂溶性的非黄酮类多酚化合物,广泛存在于葡萄、桑葚、虎杖、决明等多种植物之中[1]。白藜芦醇具有抗肿瘤[2-4]、抗氧化[5]、抗衰老[6]、保护心血管[7]等作用,具有很好的药用价值和保健功能。但白藜芦醇在水中的溶解度低、稳定性差、代谢消除快、生物利用度低,严重限制其应用[8]。研究发现,白藜芦醇是尿苷二磷酸葡萄糖醛酸转移酶(uridine diphosphate glucuronidase transferase,UGT)的底物,在肠道和肝脏发生葡萄糖醛酸化代谢,生成白藜芦醇-葡萄糖苷酸结合物,导致极低的白藜芦醇血药浓度,生物利用度不足1%[9-11]。
聚合物胶束具有特殊的“核-壳”结构,可增加药物的溶解度,进一步提高药物的生物利用度,因此被广泛应用于难溶性药物的口服给药系统[12-14]。然而单一聚合物形成的胶束体系存在载药量低、稳定性差、稀释不稳定等诸多问题[15-17]。近年来,由不同嵌段聚合物[18]、聚合物/表面活性剂[19]或聚离 子复合物[20]组成的混合胶束,发挥多种材料的协同作用,使胶束具有更大的稳定性、更高的载药量和更强的抗稀释能力,引起越来越多的关注。李金凤等[21]制备的泊洛沙姆403/407 混合聚合物胶束,提高白藜芦醇溶解度约197 倍,且具有很强的抗稀释能力和显著的缓释效果,然而目前仍缺乏有效的方法来克服白藜芦醇口服给药的首关代谢效应。辛酸癸酸聚乙二醇甘油酯(Labrasol)为非离子型表面活性剂,对口服难溶性药物有极强的增溶能力[22-23]。且已有研究表明,Labrasol 可抑制白藜芦醇葡萄糖醛酸化代谢,提高白藜芦醇的口服生物利用度约5.6倍[24]。泊洛沙姆407(P407)是一种两亲性的三嵌段共聚物,具有较强的亲水性、良好的生物相容性、低免疫原性等优点,常被用作聚合物胶束或混合胶束的载体材料[25]。
本实验选用Labrasol 和P407 作为载体材料,采用薄膜分散-探头超声法制备Res-Labrasol/P407混合胶束(Res-Labrasol/P407-MM),以期望通过胶束增溶与Labrasol 抑制UGT 代谢的双重作用提高白藜芦醇的溶解度与生物利用度,从而更好地发挥白藜芦醇的药效作用。采用Box-Behnken 响应面法优化Res-Labrasol/P407-MM 的最佳处方,并对其外观形态、粒径分布、Zeta 电位、体外释放进行评价。
1 仪器与材料
1.1 仪器
Waters 2695 高效液相色谱仪,美国沃特世科技(上海)有限公司;MS105DU 十万分之一分析天平,瑞士梅特勒-托利多仪器有限公司;斜式N-1100S-W旋转蒸发仪,埃朗科技国际贸易(上海)有限公司;UPD-Ⅱ-107 优普系列超纯水机,成都超纯科技有限公司;JY92-IIN 超声波细胞粉碎机,宁波新芝生物科技股份有限公司;SHA-C 型水浴振荡器,巩义市予华仪器有限公司;HJ-4D 数显恒温测速磁力加热搅拌器,江苏省金坛市友联仪器研究所;VORTEX3旋涡混匀器,德国IKA 公司;DZF-6020 型真空干燥箱,宁波江南仪器厂;JW-3021HR 低温高速离心机,安徽嘉文仪器装备有限公司;Nano-ZS90 电位及粒度分析仪,英国马尔文仪器有限公司;Tecnai F30 高分辨透射电子显微镜(TEM),荷兰Philips- FEI 公司;FD-1A50 真空冷冻干燥机,北京博医康实验仪器有限公司;DSC1 差示扫描量热仪,瑞士梅特勒-托利多仪器有限公司。
1.2 试剂
Labrasol,批号N1805070014,南京都莱生物技术有限公司;P407,批号196801,大连美仑生物技术有限公司;白藜芦醇对照品,批号wkq180608,质量分数>98%,购自四川省维克奇生物科技有限公司;甲醇、乙腈,美国赛默飞世尔科技有限公司;透析袋MD25,截留相对分子质量8000~14 000,北京索莱宝生物科技有限公司。
2 方法与结果
2.1 Res-Labrasol/P407-MM 与Labrasol/P407-MM的制备
采用薄膜分散-探头超声法制备Res-Labrasol/ P407-MM。精密称取适量白藜芦醇、P407、Labrasol于50 mL 圆底烧瓶中,加入10 mL 甲醇超声使其完全溶解,40 ℃减压旋转蒸发除去甲醇,减压真空干燥2 h(30 ℃)以除去残留溶剂并形成干燥透明分散薄膜。在40 ℃水浴条件下水化洗膜10 min,探头超声(260 W,工作3 s,间歇3 s)5 min 使其分散均匀。于4 ℃、12 000 r/min 离心10 min,取上清液经0.45 μm 微孔滤膜滤过,滤液即为蓝色透明的 Res-Labrasol/P407-MM,同法制备空白胶束Labrasol/P407-MM(不含白藜芦醇)。按《中国药典》2020年版甲醇量检测法测定以上样品,甲醇体积分数<0.05%。
2.2 白藜芦醇载药量、包封率测定
HPLC 法测定载药胶束中的白藜芦醇含量[26]。色谱柱为Diamonsil C18柱(150 mm×4.6 mm,5 µm);检测波长306 nm;流动相为甲醇-水(55∶45);柱温25 ℃;体积流量1 mL/min;进样量10 µL。在该条件下理论塔板数大于3000。
精密量取Res-Labrasol/P407-MM 溶液1 mL 于10 mL 棕色量瓶中,加入甲醇9 mL,细胞破碎仪超声2 min(功率200 W,工作3 s,间歇3 s)。吸取超声后甲醇溶液1 mL 置于低温高速离心机中,15 000 r/min 离心10 min,取上清液注入HPLC,测定胶束中白藜芦醇含量,图1 显示空白胶束对白藜芦醇含量测定无干扰,专属性良好。
取2 mL 的Res-Labrasol/P407-MM 溶液置于低温高速离心机中,15 000 r/min 离心30 min,用蒸馏水超声分散沉淀的胶束,重复离心3 次,最后用0.22 μm 微孔滤膜滤过,分别按如下公式计算包封率和载药量[27]。
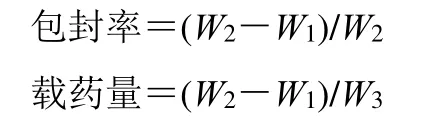
W1为测得的游离白藜芦醇含量,W2为白藜芦醇总投药量,W3为Res-Labrasol/P407-MM 总量
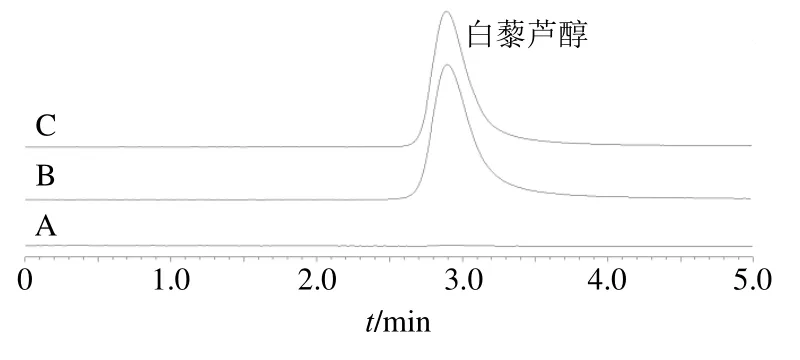
图1 空白胶束 (A)、白藜芦醇对照品 (B) 和Res-Labrasol/ P407-MM (C) HPLC 图Fig.1 HPLC of blank micelle (A), resveratrol (B) and Res-Labrasol/P407-MM (C)
2.3 药物沉降率测定
药物沉降率是指在一定条件下一定时间内从胶束制剂中析出药物的量,用于评价制剂的稳定性[28]。将所制备的胶束置于4 ℃下放置48 h,12 000 r/min离心10 min,分离析出的药物,取适量上清液,加甲醇稀释至适当倍数,按“2.2”项下进样测定药物含量,计算药物沉降率。
沉降率=(新制备胶束中的药物含量-放置48 h 离心后胶束中的药物含量)/新制备胶束中的药物含量
2.4 单因素考察
2.4.1 Labrasol与P407的比例考察 载体材料总量为200 mg,白藜芦醇投药量为40 mg,甲醇与水化体积均为10 mL,其他条件同“2.1”项下,考察P407占载体材料的质量比分别为0.25、0.50、0.75 时对粒径、载药量和包封率的影响。结果显示,随着P407比例的增大,胶束的粒径逐渐减小但稳定性下降,载药量和包封率均呈现先增加后基本不变的趋势。综合考虑各因素,当Labrasol 与P407 比例为1∶1时,得到的胶束粒径较小,载药量和包封率较高,且样品稳定性良好。因此,确定Labrasol 与P407比例为1∶1 进行后续Box-Behnken 响应面法实验。
2.4.2 投药量考察 固定载体材料Labrasol与P407均为100 mg,甲醇与水化体积均为10 mL,其他条件同“2.1”项下,考察白藜芦醇投药量为30、35、40、45 mg 时对粒径、载药量和包封率的影响。结果显示,随着投药量增加,胶束粒径和载药量随投药量的增加而增大,包封率随投药量的增大而减小;当投药量为45 mg 时,胶束的包封率急剧下降,载药量也有所减小。综合以上考察,将投药量20~40 mg 设为待优化项进行Box-Behnken 响应面法实验。
2.4.3 旋蒸温度考察 固定载体材料Labrasol 与P407 均为100 mg,白藜芦醇投药量为30 mg,甲醇与水化体积均为10 mL,其他条件同“2.1”项下,考察30、40、50、60 ℃水浴条件对粒径、载药量和包封率的影响。结果显示,旋蒸温度对胶束粒径、载药量和包封率影响不大;但旋蒸温度为60 ℃时,载药量和包封率明显减小。综合考虑,确定旋蒸温度为40 ℃进行后续Box-Behnken 响应面法实验。
2.4.4 水化洗膜温度考察 固定载体材料Labrasol与P407 均为100 mg,Res 投药量为30 mg,甲醇与水化体积均为10 mL,其他条件同“2.1”项下,考察30、40、50、60、70 ℃水浴条件对粒径、载药量和包封率的影响。结果显示,随着水化温度的提高,胶束粒径变化不大,载药量和包封率逐渐增大;但到70 ℃时,载药量和包封率开始下降。因此,将40~60 ℃设为待优化项进行Box-Behnken 响应面法实验。
2.4.5 水化体积考察 固定载体材料Labrasol 与P407 均为100 mg,白藜芦醇投药量为40 mg,甲醇为10 mL,其他条件同“2.1”项下,考察水化体积分别为8、10、12 mL 时对粒径、载药量和包封率的影响。结果显示,水化体积对粒径、载药量和包封率的影响较大;随着水化体积的增加,胶束粒径逐渐减小,载药量和包封率逐渐增加。因此将8~12 mL 的水化体积作为待优化项进行Box-Behnken响应面法实验。
2.5 Box-Behnken 响应面法优化处方
在单因素实验结果的基础上选择投药量(X1)、水化体积(X2)和水化温度(X3)为考察因素,低、中、高3 个水平,以胶束样品的质量浓度(Y1)和药物沉降率(Y2)为评价指标进行Box-Behnken 响应面法实验设计[29]。Box-Behnken 试验设计方案和结果见表1。
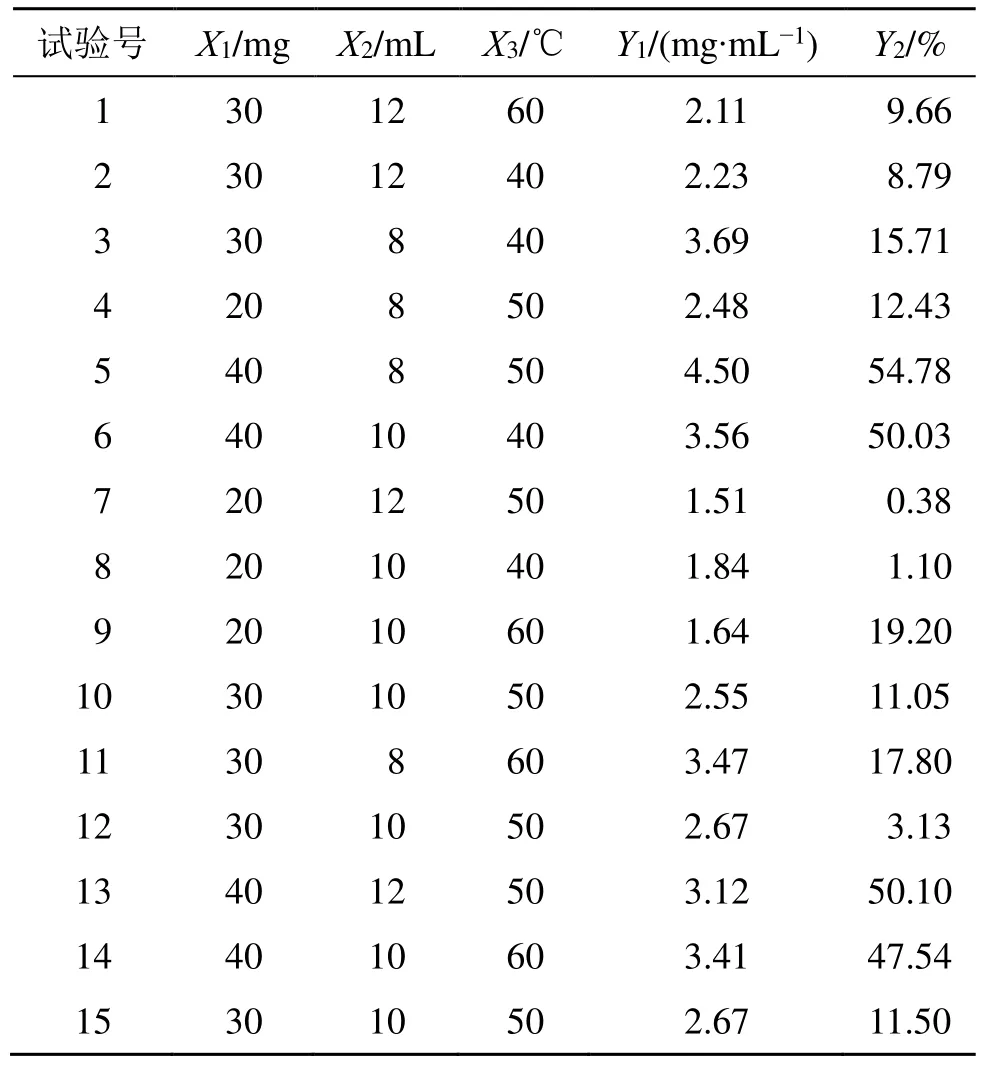
表1 Box-Behnken 响应面法实验设计及结果Table 1 Design and results of Box-Behnken response surface method
通过Design-Expert 8.0.6 软件,对表1 数据进行多元回归拟合,得到2 项式拟合方程。F值与相关系数(R2)结果表明方程的拟合效果准确可靠,使用模拟方程代替真实的实验点进行结果预测是可行的,2 项式拟合方程如下:Y1=2.63+0.89X1-0.65X2-0.086X3-0.10X1X2+0.013X1X3+0.025X2X3+5.003X12+0.27X22-0.022X32,F=140.79,R2=0.989 0;Y2=8.56+21.17X1-3.94X2+2.36X3+1.84X1X2-5.15X1X3-0.23X2X3+18.63X12+2.23X22+2.28X32,F=31.41,R2=0.951 3。
回归模型的方差分析结果见表2。P<0.05 表明考察因素对于响应值具有显著性。进一步分析各方程中的各项,X1、X2、X3、X22对Y1有显著性影响;X1、X2、X12对Y2有显著性影响。应用Design-Expert 8.0.6 软件绘制不同考察因素对于各响应值的3D 响应面图。3D 响应面图可用来评价各考察因素之间的交互作用以及确定各因素的最佳范围。不同考察因素对Y1、Y2的影响结果如图2 所示。综合考虑上述Box-Behnken 模型拟合与分析结果,期望得到质量浓度较大同时沉降率较小的白藜芦醇混合胶束。通过Design-Expert 8.0.6 软件的优化模块得到白藜芦醇混合胶束的最优处方为白藜芦醇投药量28 mg,水化体积9 mL,水化温度40 ℃;预测样品质量浓度为2.91 mg/mL,沉降率为6.66%,载药量为11.58%,包封率为93.54%。
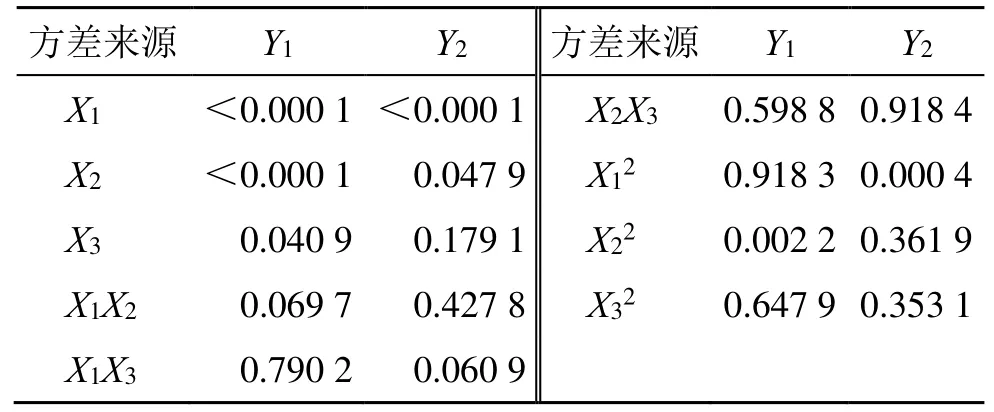
表2 回归模型方差分析Table 2 Variance analysis of regression model
2.6 最优处方的验证试验
按照上述最优处方条件制备3 批Res-Labrasol/ P407-MM,测定白藜芦醇质量浓度、沉降率、胶束粒径,根据白藜芦醇浓度计算载药量和包封率。结果见表3,平均载药量为11.62%、平均包封率为93.96%、胶束平均粒径为69.00 nm,样品质量浓度和沉降率的实测值与预测值偏差较小,RSD 在5.5%以内,表明模型预测性良好,制备工艺稳定。
2.7 Res-Labrasol/P407-MM 胶束的表征
2.7.1 粒径分析 取Res-Labrasol/P407-MM 胶束溶液5 mL,适当稀释,采用Nano ZS90 电位及粒度分析仪测定胶束的粒径、聚合物分散性指数(PDI)及Zeta 电位(图3)。Res-Labrasol/P407-MM 胶束平均Zeta 电位为(-21.25±0.18)mV,平均粒径为(69.00±1.58)nm,PDI 为0.25±0.03。结果表明,胶束带负电荷,且粒径分布均匀。
2.7.2 微观形态观察 胶束外观见图4-a,白藜芦醇混悬液(左)明显有悬浮药物颗粒和药物沉淀;Res-Labrasol/P407-MM(右)可见溶液呈蓝色乳光,澄清透明。TEM观察胶束粒子形态。将Res-Labrasol/ P407-MM 溶液适当稀释后滴至铜网上,晾干后用 2%磷钨酸染色,染色15 s 后吸取多余的溶液,自然晾干,TEM 观察,结果见图4-b,载药胶束呈类球形,大小均匀,并具有胶束经典的核-壳结构。
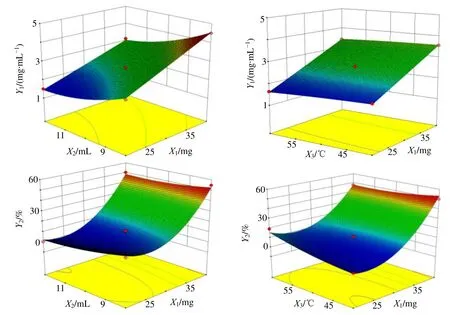
图2 各因素对考察指标的效应面图Fig.2 Effects of factors on response surface
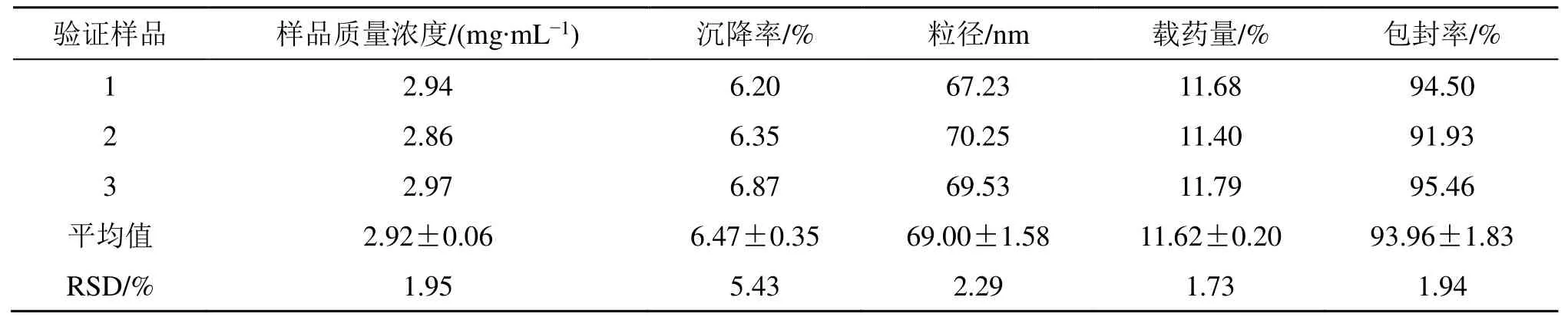
表3 最优处方的验证试验Table 3 Three batches samples for verification of optimized formulation
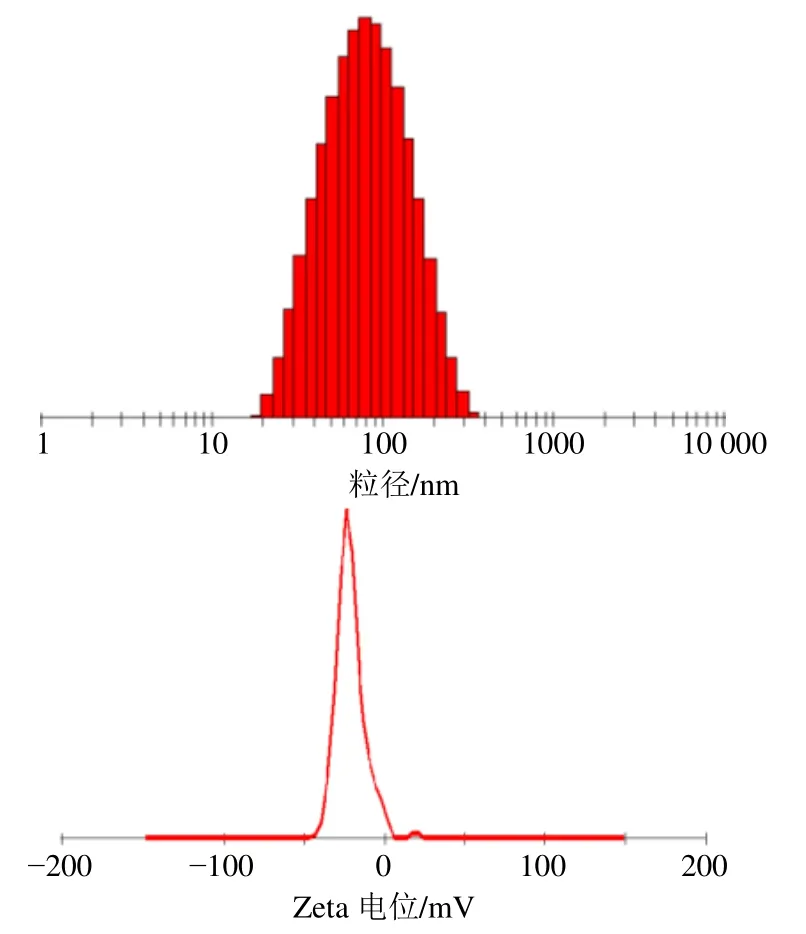
图3 载药胶束粒径分布 (a) 与Zeta 电位 (b)Fig.3 Particle size distribution (a) and Zeta potential (b) of resveratrol micelles
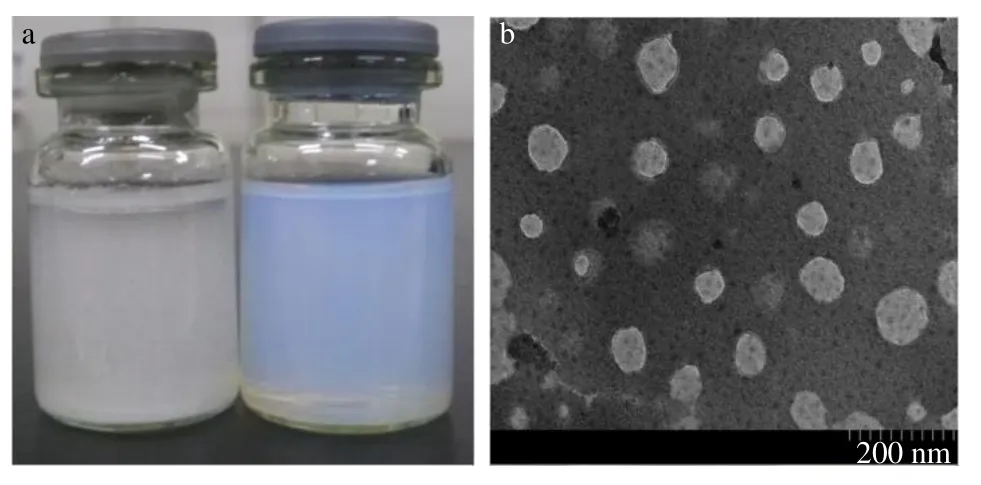
图4 载药胶束外观 (a) 和透射电镜 (b) 图Fig.4 Appearance (a) and TEM image (b) of resveratrol micelles
2.8 Res-Labrasol/P407-MM 体外释放
采用动态透析法研究Res-Labrasol/P407-MM的体外释放行为。取2 mL 载药胶束溶液置于透析袋中(截留相对分子质量为8000~12 000),将透析袋密封后分别置于装有150 mL 人工胃液和人工肠液中的锥形瓶中。白藜芦醇在水中的溶解度极低,为保证释放药物在释放介质中能够被完全溶解,本实验人工胃液和人工肠液含有0.5%聚山梨酯-80。置于37 ℃、100 r/min 水浴摇床中震摇,0.5、1、2、4、6、8、10、12、24 h 取样2 mL,并及时补加等体积等温度的释放介质。用相同的方法测定3 次,绘制胶束体外累积释药曲线(图5)。结果显示,白藜芦醇混悬液在4 h 时释放达到76%,Res-Labrasol/ P407-MM 在12 h 处释放达到最大88%,之后释药量略微增加,缓慢释放达到24 h。表明Res-Labrasol/ P407-MM 具有明显的缓释效应。
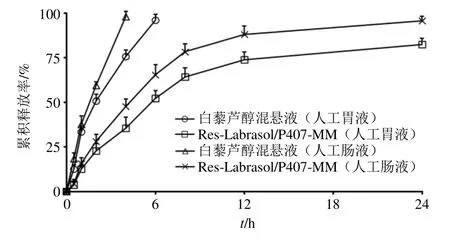
图5 白藜芦醇体外释放曲线 (n = 3)Fig.5 In vitro release curves of resveratrol (n = 3)
3 讨论
制备胶束常用的方法有薄膜分散法、直接溶解法、乳化-溶剂挥发法、透析法、微相分离法等。薄膜分散法制备过程简单易操作,重现性好,所得胶束载药量和包封率较高。将水化液进行探头超声处理,载药通过疏水作用吸附于材料疏水段,将药物包载其中,进一步发生链间纠缠,缔合形成稳固结构的胶束。超声能够极大程度地将水化液分散成较小的纳米粒子,得到粒径小且分布均匀的混合胶束。纳米颗粒的粒径是评价药物制剂的关键指标之一,口服聚合物纳米颗粒粒径通常小于100 nm。本研究采用薄膜分散-探头超声法制备白藜芦醇聚合物混合胶束,粒径约69 nm,符合胶束制剂要求。
在制备过程中,首先通过单因素试验考察非连续变量载体材料比例和成膜温度,确定Labrasol/ P407 比例为1∶1,成膜温度为40 ℃。采用Box- Behnken 响应面法优化对胶束制备工艺影响较大的因素,投药量、水化体积和水化温度,得到最优的处方制备工艺。在Box-Behnken 设计处方优化实验中,改用样品浓度、沉降率为评价指标,而未将包封率、载药量、粒径作为指标,原因在于:在单因素考察实验中发现,制备得到的胶束粒径均较小且分布均匀,包封率及载药量均较高。而本研究的关键是要得到增溶倍数高、稳定性好的胶束体系,因此直接以样品浓度和沉降率为评价指标,更便于筛选出符合要求的最优处方。样品浓度的高低直接反映白藜芦醇溶解度的提高倍数,沉降率则直接反映胶束的稳定性。浓度越大,沉降率越小,则得到的胶束制剂溶解度越大,稳定性越好。
采用动态透析法考察载药胶束的体外释放行为。白藜芦醇是从植物中提取分离出的天然产物,水溶性极差[30],难以达到释放的漏槽条件,经文献调研[31]及实验考察,本实验人工胃液和人工肠液含有0.5%聚山梨酯-80。体外释放曲线可知,Res- Labrasol/P407-MM 具有显著的缓释效果。缓释效果可能是由于白藜芦醇的多羟基与载体材料结构上的羰基形成了氢键,致使药物从胶束的疏水核心扩散到释放介质的过程更加缓慢,保证药物不发生严重渗漏,从而达到持续给药、提高药物吸收量的目的。
综上所述,本研究通过单因素实验与Box- Behnken 响应面法实验得到Res-Labrasol/P407 的最优处方,成功制备了载药胶束,与白藜芦醇混悬液相比具有明显缓释特征。后继本课题组采用外翻肠囊法评估Res-Labrasol/P407-MM 对白藜芦醇葡萄糖醛酸化代谢的影响,并探讨其在大鼠体内的药动学过程。
利益冲突所有作者均声明不存在利益冲突

