加味半夏厚朴汤干预慢性阻塞性肺疾病急性加重期合并阻塞性睡眠呼吸暂停低通气综合征30例临床研究
蒋紫云 连乐燊 钱旭胜 刘小虹 朱碧媛 李碧芳 陶海澜
(1.广州中医药大学东莞医院,广东东莞523000;2.广州中医药大学第一附属医院,广东广州510080)
慢性阻塞性肺疾病(COPD)是一种气流持续受限的慢性气道炎症疾病,而气道炎症会因环境污染、感染、接触过敏原等诸多因素诱发加重,称为慢性阻塞性肺疾病急性加重期(AECOPD)[1]。AECOPD是COPD病程中的重要事件,体现在其造成症状的明显加重,加速了病程发展,并且增加再次急性加重的风险[1]。而阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是指患者在睡眠过程中反复出现呼吸暂停和低通气,临床上可表现为打鼾,且鼾声不规律,患者自觉憋气,甚至反复被憋醒,常伴有夜尿增多、晨起头痛、头晕、口咽干燥等一系列症候群,常合并肺动脉高压与肺源性心脏病、高血压、冠心病、心律失常、缺血性脑卒中及2型糖尿病与胰岛素抵抗等[2]。两者均存在明显的缺氧状态,AECOPD与OSAHS重叠综 合 征(AECOPD and OSAHS Overlap Syndrome,以下简称OS)患者缺氧问题更为突出[3]。因此采用有效措施干预OS患者,纠正缺氧及缺氧引起的一系列病理机制,对提高疗效有着重要的临床意义。目前西医治疗OS常规使用抗生素、激素及机械通气,但存在一些不良反应或者患者不能耐受[4],影响了治疗效果。笔者前期运用加味半夏厚朴汤治疗OSAHS获得了较好的疗效[5],也有相关报道该方对AECOPD患者也有良好效果[6],但对其治疗OS的临床研究较少,更鲜有涉及对缺氧诱导因子调控机制影响的研究。本研究观察了在西医常规治疗基础上加用加味半夏厚朴汤对OS患者的疗效,并探讨其对HIF-1α水平及HIF-1α调控下的炎症反应、血管内皮功能的影响,现报道如下。
1 临床资料
1.1 一般资料 选择2019年7月至2020年12月期间东莞市中医院总院及分院呼吸科住院部收治的62例OS患者,按照计算机随机分组的结果分为治疗组与对照组,每组31例。研究期间因患者自动出院脱落2例,2组最终各完成30例。治疗组男17例,女13例;平均年龄(65.93±7.82)岁;平均病程(9.76±3.81)年;COPD病情分级Ⅰ、Ⅱ、Ⅲ、Ⅳ级各2、2、8、18例;OSAHS严重程度分级轻度、中度、重度各1、15、14例。对照组男19例,女11例;平均年龄(65.14±8.22)岁;平均病程(10.10±3.71)年;COPD病情分级Ⅰ、Ⅱ、Ⅲ、Ⅳ级各0、3、7、20例;OSAHS轻度、中度、重度各0、14、16例。2组患者性别、年龄、病程等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究方案经东莞市中医院伦理委员会批准通过(伦理审批号:伦审〔2019〕20号)。
1.2 诊断标准
1.2.1 西医诊断标准 AECOPD诊断标准按照《慢性阻塞性肺疾病急性加重(AECOPD)诊治中国专家共识(2017年更新版)》[1]。OSAHS诊断标准按照《阻塞性睡眠呼吸暂停低通气综合征诊治指南(基层版)》[2]。
1.2.2 中医辨证标准 参照《慢性阻塞性肺疾病中医诊疗指南(2011版)》[7]及国家中医药管理局重点专科协作组制定的《鼾证(阻塞性睡眠呼吸暂停低通气综合征)中医诊疗方案(试行)》,符合“痰瘀阻肺证”辨证标准。主证:咳嗽,咳痰,痰白或黄而黏稠,喘促,动则喘甚;睡眠时有鼾声,鼾声响亮,时时憋醒,口干,胸闷呕恶,晨起头晕,健忘,记忆力下降。次证:发热,气短,痰多,咯痰不爽,咯血,疲惫乏力,汗多,水肿,纳差,腹胀腹痛。舌脉:舌质暗红或有瘀斑,苔薄润或黄腻,脉滑数或者涩。
1.3 纳入标准 符合AECOPD、OSAHS西医诊断标准;符合痰瘀阻肺证辨证标准;年龄≤80岁;自愿参加本研究并签署知情同意书。
1.4 排除标准 合并感染性休克者;严重呼吸衰竭需要气管插管者;严重肝肾功能衰竭者;不能配合治疗者。
1.5 脱落与剔除标准 患者拒绝配合治疗;病情出现明显变化,如出现严重并发症者需要转重症监护室,出现病情加重需要气管插管机械通气。
2 治疗方法
2.1 对照组 根据专家共识及指南[1-2]予西医常规治疗。吸氧;根据细菌培养结果选择抗感染治疗方案;使用吸入用复方异丙托溴铵溶液(勃林格翰公司,国药准字H20120544)0.5 mg、吸入用布地奈德混悬液(阿斯利康公司,国药准字H20140475)1 mg,氧气驱动雾化,3次/d;使用盐酸氨溴索注射液(勃林格翰公司,国药准字H20030360)30 mg,静脉推注,2次/d;注射用甲泼尼松龙琥珀酸钠(辉瑞制药公司,国药准字H20080284)40 mg,静脉滴注,1次/d;使用无创呼吸机(凯迪泰FLEXO ST30)双水平气道正压通气(BiPAP),3次/d,每次2 h,采用同步触发模式,吸气压18 cmH2O(1 cmH2O≈0.098 kPa),呼气压4 cmH2O,备用呼吸频率18次/min,吸气灵敏度及呼气灵敏度设置自动。
2.2 治疗组 在对照组治疗的基础上加用中药汤剂加味半夏厚朴汤口服。药物组成:法半夏10g,厚朴10g,茯苓15g,生姜10g,紫苏子10g,葶苈子10g,莱菔子10g,桃仁10g,海蛤壳30g(先煎),甘草6g。每日1剂,由东莞市中医院中药房统一水煎煮为400 mL汤剂,分早晚饭后温服。
2组疗程均为14 d。
3 疗效观察
3.1 观察指标
3.1.1 中医证候积分 参照《中药新药临床研究指导原则(试行)》[8],对2组患者治疗前后咳嗽、咯痰、气短、发热、喘息、胸闷、咯血、多汗、口干、水肿、腹胀腹痛、纳呆、夜间憋醒、恶心、打鼾、日间疲惫、记忆力下降、晨起头晕等18项证候按“无、轻、中、重”分别计0、1、2、3分。
3.1.2 实验室指标 治疗前后检测2组患者外周血白细胞计数(WBC)、C-反应蛋白(CRP)、低氧诱导因子-1α(HIF-1α)、白细胞介素-6 (IL-6)、肿瘤坏死因子-α(TNF-α)、血浆内皮素-1(ET-1)、血管内皮生长因子(VEGF),以及动脉血气分析指标氧分压(PaO2)、二氧化碳分压(PaCO2),彩超检测肺动脉收缩压(PASP)。
3.2 临床证候疗效评定标准 参照《中药新药临床研究指导原则(试行)》[8]中的疗效判定标准。临床控制:临床症状、体征消失或者基本消失,证候积分减少率≥90%;显效:临床症状、体征明显改善,证候积分减少率≥70%、<90%;有效:临床症状、体征均有好转,证候积分减少率≥30%、<70%;无效:临床症状、体征无明显好转,甚至加重,证候积分减少率<30%。证候积分减少率=(治疗前证候总积分-治疗后证候总积分)/治疗前证候总积分×100%。
3.3 统计学方法 所有数据采用SPSS 25.0统计软件进行统计分析。首先运用Shapiro-Wilk正态分布检验所得数据是否符合正态分布,符合正态分布的计量数据采用(±s)进行统计描述,并进行方差齐性F检验,若方差齐,则采用独立样本t检验,若方差不齐,则采用两独立样本t'检验;不符合正态分布的计量数据采用平均秩次和四分位数表示。组间均值比较采用Mann-Whitney U检验,组内自身前后采用配对秩和检验。计数资料以频数表示,2组小样本等级资料采用Mann-Whitney U检验。检验水准为α=0.05。P<0.05为差异具有统计学意义。
3.4 治疗结果
3.4.1 2组患者治疗前后中医证候总积分、临床证候疗效比较 治疗前2组患者中医证候总积分比较差异无统计学意义(P>0.05),治疗后组内及组间比较见表1。治疗组临床证候疗效等级分布优于对照组,差异有统计学意义(P<0.05),见表1。
3.4.2 2组患者治疗前后外周血WBC、CRP及PaO2、PaCO2、PASP比较 治疗前2组患者外周血WBC、CRP及PaO2、PaCO2、PASP指标比较,差异无统计学意义(P>0.05);治疗后组内及组间比较见表2。
3.4.3 2组患者治疗前后血HIF-1α、IL-6、TNF-α、ET-1、VEGF水平比较 治疗前2组患者血HIF-1α、IL-6、TNF-α、ET-1、VEGF水平比较,差异无统计学意义(P>0.05);治疗后组内及组间比较见表3。

表1 治疗组与对照组患者治疗前后中医证候总积分、临床证候疗效比较
表2 治疗组与对照组患者治疗前后外周血WBC、CRP及PaO2、PaCO2、PASP水平比较(±s)

表2 治疗组与对照组患者治疗前后外周血WBC、CRP及PaO2、PaCO2、PASP水平比较(±s)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,△P<0.05。1 mmHg≈0.133 kPa。
组别 例数 时间 WBC/(×109/L) CRP/(mg/L) PaO2/mmHg PaCO2/mmHg PASP/mmHg治疗组 30 治疗前 12.04±3.65 75.41±19.49 63.72±10.12 60.57±9.12 58.20±9.01 30 治疗后 8.76±2.45*△ 21.65±4.65*△ 79.66±10.07*△ 44.24±5.01*△ 49.17±7.09*△images/BZ_40_967_2623_967_2625.png对照组 30 治疗前 13.15±3.65 76.22±17.04 62.89±10.67 59.98±10.02 57.90±10.67 30 治疗后 10.04±2.16* 40.54±6.11* 75.47±6.46* 51.25±6.15* 53.93±9.78*
表3 治疗组与对照组患者治疗前后血HIF-1α、IL-6、TNF-α、ET-1、VEGF水平比较(±s)
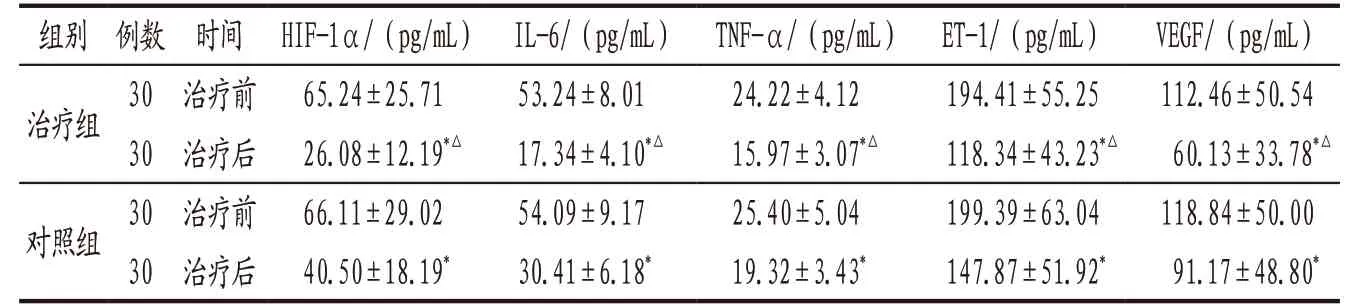
表3 治疗组与对照组患者治疗前后血HIF-1α、IL-6、TNF-α、ET-1、VEGF水平比较(±s)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,△P<0.05。
组别 例数 时间 HIF-1α/(pg/mL) IL-6/(pg/mL) TNF-α/(pg/mL) ET-1/(pg/mL) VEGF/(pg/mL)治疗组 30 治疗前 65.24±25.71 53.24±8.01 24.22±4.12 194.41±55.25 112.46±50.54 30 治疗后 26.08±12.19*△ 17.34±4.10*△ 15.97±3.07*△ 118.34±43.23*△ 60.13±33.78*△对照组 30 治疗前 66.11±29.02 54.09±9.17 25.40±5.04 199.39±63.04 118.84±50.00 30 治疗后 40.50±18.19* 30.41±6.18* 19.32±3.43* 147.87±51.92* 91.17±48.80*
4 讨论
COPD增加了OSAHS发病率,反之亦然,两者之间存在互相作用,两者合并存在称之为重叠综合征[9],近年来OS发病率逐渐升高,普通成年人中发病率达到1%[9],造成了极大的社会经济负担。OS患者存在更明显的缺氧状态,急性加重期更是如此,缺氧是呼吸衰竭的核心病理机制,缺氧引发一系列病理生理反应,HIF-1α在其中起到了重要作用[10-11]。HIF-1α普遍存在于人和哺乳动物细胞内,只有在缺氧情况下才可稳定表达,HIF-1α依赖的适应性信号及其对相关下游因子的调控在COPD和OSAHS发病机制中起了重要作用[10-11],这在一些临床研究中也得到了验证,如血清中HIF-1α表达升高与AECOPD动脉血氧分压呈明显负相关关系[12],与OSAHS患者的认知功能下降也具有相关性[13],说明HIF-1α表达水平与AECOPD、OSAHS患者的病情程度和预后有一定的相关性。AECOPD、OSAHS患者的HIF-1α参与了炎症因子以及血管内皮功能的调控,导致患者的炎症反应及血管内皮功能障碍,研究表明HIF-1α的表达与炎症因子CRP、IL-8等呈正相关关系,HIF-1α为机体适应缺氧代偿的同时,也可能会加重炎症反应的程度,形成恶性循环[14]。而ET-1、VEGF作为HIF-1α的下游调节对象[11],参与OSAHS及COPD患者的血管内皮功能障碍及血管重塑过程[11,15]。较之单纯AECOPD或者OSAHS患者,OS患者炎症因子IL-6、TNF-α及血管内皮指标ET-1、VEGF的异常更为严重[16-17]。本研究结果显示,在西医常规治疗基础上加用加味半夏厚朴汤能进一步改善OS患者的血气分析指标及肺动脉收缩压,降低HIF-1α、IL-6、TNF-α、ET-1、VEGF指标,提示中药能调节患者HIF-1α信号水平,改善缺氧引起的炎症反应及血管内皮功能障碍,降低肺动脉压力,减轻右心负荷,从而减轻患者的临床症状。
中医学中并没有对OS的直接记载论述,目前大多数学者将本病归属于中医学“肺胀”“鼾眠”范畴。《丹溪心法·咳嗽》中有“肺胀而嗽,或左或右不得眠者,此痰挟瘀血碍气而病”的描述,而《诸病源候论》指出鼾眠病机为“气有不和,则冲击咽喉而作声也。其有肥人眠作声者,但肥人气血沉浓,迫隘喉间,涩而不利亦作声”,认为本病与痰浊、气滞有关。可以看出“肺胀”“鼾眠”病机皆以痰浊为主,目前已有证候研究证实COPD与OSAHS重叠综合征的病机与痰浊有密切关系。黄颖等[18]的临床研究将COPD与OSAHS重叠综合征分为5个证型:痰热内扰证、痰湿内阻证、痰瘀互结证、脾肾阳虚证、气阴两虚证,COPD与OSAHS重叠综合征患者痰证明显多于非痰证,其中痰瘀互结证占主要比例。本课题组前期研究亦发现收集的OS患者中与痰有关的证候类型占75.84%,其中痰瘀互结证占26.7%。据上述研究可初步总结,OS的主要病机是久病体虚,脏腑失司,生痰积瘀,气机不和,痰浊是其核心病理因素。课题组针对此病机提出该病的中医治疗可从化痰祛瘀、宣肺平喘入手,并根据临床经验拟加味半夏厚朴汤。本方由半夏厚朴汤合三子养亲汤化裁并加桃仁、海蛤壳等活血化痰药物而成。其中半夏厚朴汤行气散结、化痰降逆;三子养亲汤易温热的白芥子为苦寒的葶苈子,以根据岭南地区痰热多于痰浊的特点,加强泻肺逐饮平喘的功效;加用桃仁活血化痰、海蛤壳清热化痰。全方共奏化痰祛瘀、宣肺平喘的功效,符合该病病机。前期研究显示本方对OSAHS患者有较好的疗效,在本研究中该方也能明显改善OS患者的中医证候。
综上所述,加味半夏厚朴汤可能通过调节HIF-1α信号水平,调控IL-6、TNF-α、ET-1、VEGF的表达,减轻患者炎症反应并改善血管内皮功能,从而改善患者的临床表现,值得临床参考应用。但本研究样本量较小,下一步需要组织更大规模及严格设盲的临床研究以进一步证实其疗效,同时从HIF-1α蛋白及RNA入手探索本方的治疗机制。

