重庆市荣昌区中华田园犬蜱种鉴定及序列分析*
陈绍基,李 芳,谭 纯,贾红菓,梅四鹏,周荣琼
西南大学 动物医学院, 重庆 荣昌 402460
蜱隶属节肢动物门Arthropoda, 蛛形纲Arachnida, 蜱螨亚纲Acari, 寄螨总目Parasiti-formes, 蜱目Ixodida, 是动物体表专性吸血的寄生虫. 蜱大量寄生于动物体表, 可造成宿主贫血、 消瘦甚至死亡. 蜱虫作为传播媒介, 将体内携带的致病病原体通过叮咬易感动物使其患病, 病原体在体内生长繁殖并且可以长期带毒, 同时扮演着传播媒介和贮藏宿主的双重角色[1-3], 影响动物机体正常活动. 目前已知与蜱类传播相关的病原微生物约190种, 多数疾病为人兽共患病, 如森林脑炎、 莱姆病、 肾综合征出血热、 立克次体病[4-6]等, 严重危害人类健康并且给畜牧业带来巨大的经济损失.
线粒体DNA(Mitochondrial DNA, mtDNA)具有独立的核外遗传密码, 结构简单、 进化速率快, 较少发生重组、 系母系遗传具有可溯源性的特点, 可作为标记基因使用[7], 是目前蜱类分子生物学研究中应用最广泛的基因, 主要有16SrDNA,12SrDNA,COXI和COXII等基因[8]. 线粒体16SrDNA基因序列由于其保守性、 存在的普遍性以及基因序列本身的稳定性, 常作为蜱种间鉴定的遗传标记. 本研究利用线粒体基因16SrDNA对重庆市荣昌区中华田园犬蜱进行种属鉴定及系统发育进化分析, 以期为明确动物寄生蜱种类分布和预防蜱传病提供科学依据.
1 材料与方法
1.1 样本的采集
样本从重庆市荣昌区中华田园犬体表获得, 检查犬耳、 颈部、 腹股沟、 腿根等部位, 发现蜱后用镊子夹住假头基缓慢拔出, 放入样本管内编号、 记录. 用75%酒精漂洗3次, 再用灭菌蒸馏水冲洗3次后70%酒精保存.
1.2 蜱形态学鉴定
参照《中国经济学昆虫志》[9], 用体式显微镜(ZSA0745B)对蜱进行形态学鉴定, 主要对假头、 盾板、 肛侧板等部位进行测量观察.
1.3 蜱分子生物学鉴定
1.3.1 主要试剂
PCR试剂(MgCl2、 Buffer、 dNTPs等)、 Taq DNA聚合酶、 DL 2000 DNA Marker、 琼脂糖、 Amp、 X-gal、 IPTG、 重组质粒pMD19-T(Simple) Vector购自TaKaRa公司; 胰蛋白胨(Tryptone)、 酵母浸出粉(Yeast extract)购自Oxiod公司; 蛋白酶K购自Merk公司; DNA胶回收试剂盒、 DH5α感受态细胞购自TransGen Biotech公司.
1.3.2 DNA的提取
取出单只蜱置于新的1.5 mL Eppendorf管中, 用灭菌眼科剪将蜱组织剪碎, 加入270 μL SDS裂解液(包括60 μL 500 mmol/L NaCl溶液, 30 μL 100 mmol/L Tris-Cl(pH=8.0), 30 μL 10% SDS, 150 μL 50 mmol/L EDTA(pH=8.0))和30 μL 50 μg/μL蛋白酶K, 充分混匀, 隔夜55 ℃水浴12~24 h, 其间多次振荡混匀离心管使组织裂解充分后采用酚/氯仿法抽提样本DNA. 提取出的DNA 样品于-20 ℃冰箱保存备用.
1.3.3 PCR扩增
根据文献[10]提供的线粒体保守引物16SrDNA进行扩增, 预期目的片段约460 bp. 其核苷酸序列如下:
上游引物16S-F: 5′-CTGCTCAATGATTTTTTAAATTGCTGTGG-3′(29 bp)
下游引物16S-R: 5′-CCGGTCTGAACTCAGATCAAGT-3′(22 bp)
由重庆擎科兴业生物技术有限公司合成, 使用时加灭菌超纯水稀释, 浓度为10 μmol/L, 分装后于-20 ℃保存备用. PCR反应体系为25.0 μL, 其中3.0 μL Mg2+(25 mmol/L), 2.0 μL dNTPs(2.5 μmol/L), 2.5 μL 10×PCR buffer(不含Mg2+), 0.25 μL上游引物16S-F(10 μmol/L), 0.25 μL下游引物16S-R(10 μmol/L), 2.0 μL模板DNA, 0.125 μL rTaq酶(5 U/μL), 灭菌双蒸水14.875 μL. 反应在PCR仪BIO RAD S1000上进行, 反应参数为预变性94 ℃ 5 min, 变性94 ℃ 30 s, 退火温度57 ℃ 30 s, 延伸72 ℃ 30 s, 循环反应35次, 最后72 ℃ 延伸8 min, 同时设置阴性对照组. PCR产物经10 g/L TAE琼脂糖凝胶电泳后成像系统显示记录分析结果.
1.3.4 PCR产物的克隆及测序分析
DNA胶回收试剂盒切胶纯化PCR产物. 将回收的PCR产物与pMD19-T(simple)Vector载体16 ℃ PCR扩增仪连接1 h. 连接后将上述连接产物转化至DH5α感受态细胞, 涂布于含Amp,X-gal和IPTG的LB琼脂平板中, 置恒温箱37 ℃培养12~14 h.
挑取阳性克隆菌液送重庆擎科兴业生物技术有限公司测序. 将测序结果与国际NCBI数据库Blast核酸比对, 同时基于16SrDNA序列下载了双棘血蜱H.bispinosa(GeneBank NO. KY825195)、 豪猪血蜱H.hystricis(GeneBank NO. LT593116)、 嗜群血蜱H.concinna(GeneBank NO. KP866207)、 日本血蜱H.japonica(GeneBank NO. AB819176)、 青海血蜱H.qinghaiensis(GeneBank NO. MF629896), 波斯锐缘蜱Argaspersicus(GeneBank NO. GU451248), 龟形花蜱Amblyommatestudinarium(GeneBank NO. KC170737), 微小牛蜱Boophilusmicroplus(GeneBank NO. AY974242), 鸡蜱刺螨Dermanyssusgallinae(GeneBank NO. LC029798), 草原革蜱Dermacentornuttalli(GeneBank NO. MK032591), 残缘璃眼蜱Hyalommadetritum(GeneBank NO. KP210065), 全沟硬蜱Ixodespersulcatus(GeneBank NO. MF095807), 柏氏禽刺螨Ornithonyssusbacoti(GeneBank NO. AM921905), 血红扇头蜱Rhipicephalussanguineus(GeneBank NO. JX997393), 用MEGA 4.0构建种系发育进化树, 明确该蜱与其他蜱种的亲缘关系(图1).
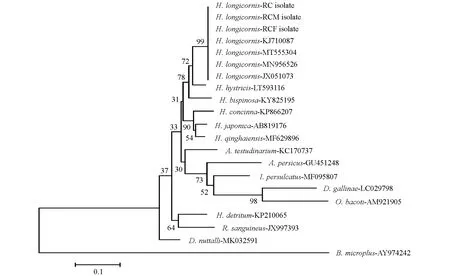
图1 基于16S rDNA序列构建的H. longicornis系统发育分析
2 结果与分析
2.1 形态学鉴定
在体式显微镜下可明显观察到其形态特征: 躯体背部有坚硬盾板, 边缘呈均匀的弧状, 躯体尾部皮纹清楚, 缘垛明显, 共有11个(图2a). 躯体腹面足四对, 生殖孔位于腹前部正中、 Ⅱ-Ⅲ基节间, Ⅱ-Ⅳ基节内距明显超过体后缘, 粗细均匀中等, 基节Ⅰ呈锥形, 内距发达, 后缘不分叉(图2b). 假头背面, 须肢宽短, 外缘向外侧中度突出, 呈角状, 第Ⅱ节背面有三角形短刺, 腹面有锥形的长刺, 假头基呈矩形(图2c). 气门板位于第Ⅳ基节后部, 呈D字隆起, 左右对称(图2d), 经形态学初步鉴定为长角血蜱. 选取样本3株进行后续试验(表1).

图2 长角血蜱的形态特征

表1 本试验所用长角血蜱样本
2.2 分子生物学鉴定
2.2.1 PCR扩增产物结果
扩增产物经琼脂糖凝胶电泳显示, 3株样本在约460 bp处可见明显条带, 与预期片段大小相符, 阴性对照没有出现条带(图3).
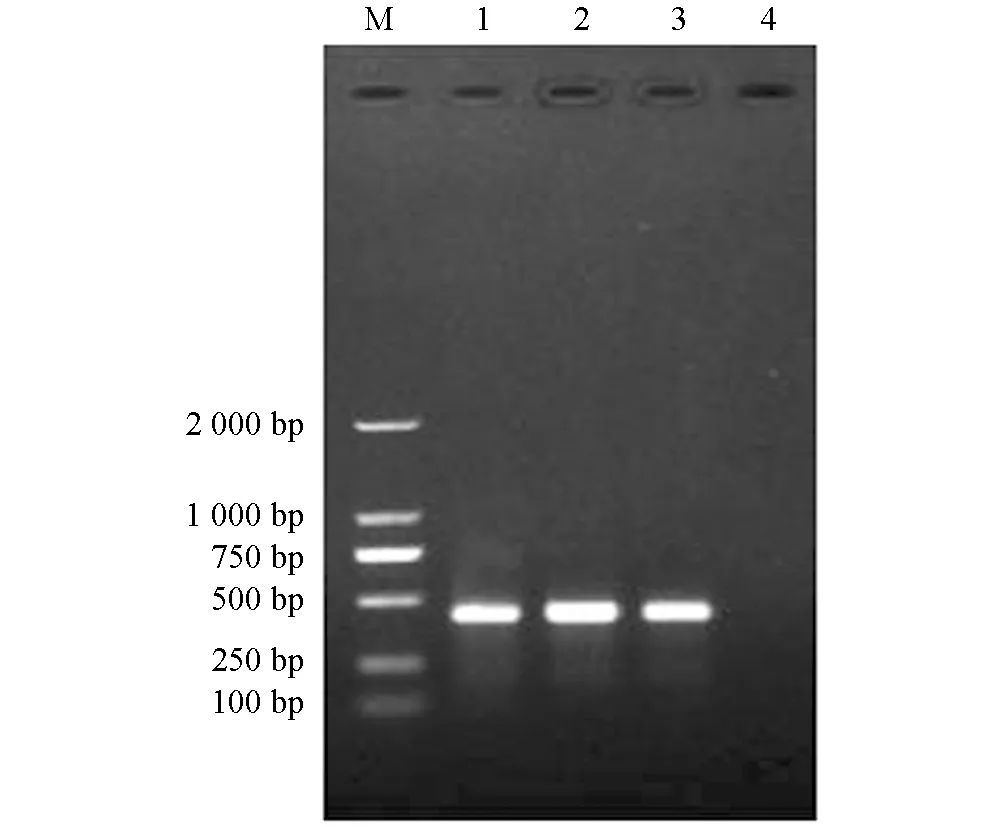
M. DNA相对分子质量标准; 1. H. longicornis-RC 16S PCR; 2.H. longicornis-RCF 16S PCR; 3. H. longicornis-RCM 16S PCR; 4.阴性对照.
2.2.2 重组质粒的菌液PCR鉴定
阳性克隆的重组质粒菌液PCR扩增后经琼脂糖凝胶电泳显示, 3株样本重组质粒菌液扩增出约460 bp的16SrDNA条带, 与预期片段大小相符, 阴性对照没有出现条带(图4).
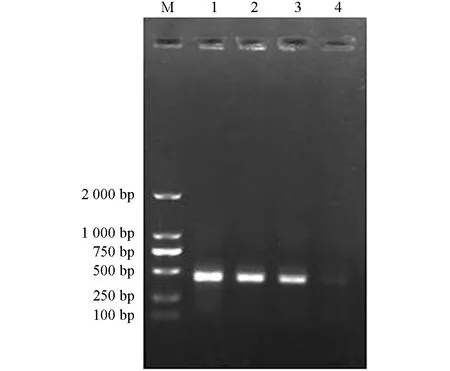
M. DNA相对分子质量标准; 1. H. longicornis-RC重组菌液PCR; 2. H. longicornis-RCF重组菌液PCR; 3. H. longicornis-RCM重组菌液PCR; 4.阴性对照.
2.3 测序结果及种系发育进化树分析
对PCR鉴定为阳性的重组菌液测序, 结果显示3株样本获得的PCR产物序列长度基本一致, 为457~458 bp, 仅RC株有一个碱基的差异(163 bp处缺少碱基A). 经NCBI网站Blast比对, 本研究获得的蜱16SrDNA序列与H.longicornis(GeneBank NO. JX051073,KJ710087,MT555304,MN956526)进行分析, 结果显示其同源性达99.3%~99.6%. 将本次研究测序所得的3株H.longicornis序列与下载的18株序列应用程序MegAlign 4.0 中的NJ构建种系发育进化树(图1), 显示3株H.longicornis重庆市荣昌区分离株与GeneBank登记的H.longicornis(GeneBank NO. JX051073,KJ710087,MT555304,MN956526)位于同一个分支上, 表明其均为同一个物种. 本研究获得的蜱16SrDNA序列与GeneBank上收录的豪猪血蜱H.hystricis(GeneBank NO. LT593116)的遗传距离最近, 与微小牛蜱B.microplus(GeneBank NO. AY974242)的遗传距离最远.
3 结 语
长角血蜱在分类上属于硬蜱科Ixodidae, 血蜱属Haemaphysalis, 已在我国多个省区发现该蜱, 是最为常见的蜱种之一. 由于蜱不仅在动物体表叮咬吸血使得宿主失血较多出现贫血消瘦症状, 经久不愈影响生产性能, 而且由于叮咬降低动物表皮商品质量, 给畜牧养殖产业造成巨大的经济损失. 长角血蜱更是多种重要疾病的传播媒介, 可将多种疾病如Q热、 莱姆病、 某些巴贝斯虫病等传给人类, 对人类健康构成较大的威胁, 并且不断有新发的蜱传病原被检测出, 如近年来研究证实长角血蜱可作为发热伴血小板减少综合症病毒(Severe fever with thrombocytopenia syndrome virus, SFTSV)的中间宿主[10], 能引起机体发热伴血小板减少(Severe fever with thrombocytopenia syndrome, SFTS).
蜱在全球分布范围广, 目前全世界记载蜱种有3科共899种[11], 我国已记录蜱有9属124种[12], 种类繁多, 外观形态上有许多相似物种, 并且由于其表型可塑性、 地区遗传多样性和生长环境不同, 同一物种不同个体间也有差异, 常易导致鉴定错误. 仅凭形态学特征对蜱进行物种鉴定要求研究者具备丰富的专业知识储备, 这种鉴定具有一定的难度. 因此, 借用分子生物学技术准确鉴定蜱的方法普遍被人们所接受.
动物线粒体DNA(mtDNA)以高拷贝数目存在于线粒体内, 主要有16SrDNA,12SrDNA,COXI和COXII等基因, 目前已被广泛应用于蜱类系统发育、 种群遗传变异与分化以及形态学上难以区分的近缘种的鉴别等. 16SrDNA是动物线粒体内较为保守的基因, 具有进化速率缓慢, 以替换为主的特点, 可以很方便地使用通用引物或者保守引物进行PCR扩增[13-14]. 研究证实16SrDNA能作为H.longicornis分类鉴定和群体遗传研究的分子标记, Lv等[15]利用16SrDNA分子标记对湖北省铃头血蜱和褐黄血蜱进行种属鉴定; 刘琴等[16]基于16SrDNA序列探讨了长角血蜱、 褐黄血蜱及铃头血蜱的系统发育进化关系. 本试验以H.longicornis为对象开展研究, 测序结果显示3株H.longicornis的16SrDNA序列基本一致, 仅RC株位于163 bp处有碱基差异; 种系发育进化分析显示3株样本与GeneBank上收录的H.hystricis遗传距离最近, 在分类上H.longicornis与H.hystricis同归于血蜱属, 证实了16SrDNA是H.longicornis进行种间鉴定的遗传标记. 本文对重庆市荣昌区媒介蜱进行研究报道, 为后续该蜱类鉴定、 遗传分析及蜱传病防治等研究奠定了基础.

