前列腺癌组织中LncRNA TUG1表达及其与临床预后的相关性研究*
郝思达,马健雄,顾 海,王业强,秦 勇
(浙江省中西医结合医院/杭州市红十字会医院:1.泌尿外科 ;2.生殖科,杭州 31000)
前列腺癌是男性常见生殖系统恶性肿瘤之一,多见于中老年人群,致死率约占男性恶性肿瘤死亡总数的1.26%,且随着年龄增长而不断升高[1]。外科手术是当前治疗前列腺癌最主要也是最有效的方法,但因其浸润性较强,术后复发率及转移率较高,临床预后仍不理想[2]。长链非编码RNA(LncRNA)是指长度大于200个核苷酸的RNA,且无编码蛋白质功能,已被证实在多种恶性肿瘤的发生及发展过程中具有重要调节作用[3]。有研究显示,LncRNA牛磺酸上调基因1(TUG1)可结合部分甲基化蛋白而参与细胞生长的调控,且被证实在结直肠癌[4]、肝细胞癌[5]等恶性肿瘤中明显高表达,且可能导致部分抑癌基因如磷酸酶基因(PTEN)等丢失而参与肿瘤的发生及发展[6],但其在前列腺癌发生、发展中的作用及确切分子机制仍缺乏充分研究。本研究检测了前列腺癌患者癌组织中LncRNA TUG1表达水平,并探讨其与患者临床病理特征、临床预后的关系,旨在为前列腺癌的早期诊疗提供参考依据。
1 资料与方法
1.1 一般资料
选取2015年1月至2017年1月在本院住院治疗的前列腺癌患者126例。纳入标准:(1)经病理活检及术后病理检查确诊为前列腺癌;(2)具有完整的临床病理资料、随访资料;(3)获得肿瘤组织及癌旁正常组织(与肿瘤边缘距离大于5 cm)。排除标准:(1)继发性前列腺癌患者;(2)合并其他恶性肿瘤、合并自身免疫性疾病者;(3)术前接受新辅助化疗、放疗或其他抗肿瘤治疗者;(4)组织反复冻存或污染者。入组患者和(或)其家属均知情同意且签署书面知情同意书,研究方案经医院伦理学委员会审核且批准通过。纳入患者年龄45~78岁,平均(66.21±6.43)岁;术前血清前列腺特异抗原(PSA)0.19~100 μg/L,平均(12.64±3.03)μg/L;肿瘤直径:<3.0 cm者71例,≥3.0 cm者55例;美国癌症联合会(AJCC)分期:Ⅰ~Ⅱ期51例,Ⅲ~Ⅳ期75例;肿瘤T分期:T1~2期者47例,T3~4期者79例;分化程度:中/高分化62例,低分化或未分化64例;术前淋巴结转移31例。
1.2 方法
1.2.1主要仪器与试剂
(1)仪器:DS-11型微量分光光度计购自美国DeNovix公司;凝胶电泳分析系统购自美国Lonrmat公司;7500型实时定量聚合酶链反应(RT-PCR)仪购自美国Bio-Rad公司。(2)试剂:cDNA 合成试剂盒购自美国Bio-miga公司;2×Taq PCR MasterMix 试剂盒及2×SYBR Green Mix(With ROX)试剂盒均购自美国Bio-miga公司;10%胎牛血清(FBS)购自杭州仟诺生物科技有限公司;RPMI-1640 培养基购自杭州吉诺生物医药技术有限公司;乱序对照小干扰RNA(Si-NC)和TUG1小干扰RNA(si-TUG1)均购自生工生物工程(上海)股份有限公司。
1.2.2RT-PCR法检测组织LncRNA TUG1、PTEN表达
组织标本采用10%甲醛液固定,石蜡包埋,切片厚度5 μm。组织加入液氮并充分研磨,采用Trizol法分离、提取RNA。采用无RNase的DNaseⅠ去基因组进行处理,37 ℃ 30 min,65 ℃灭活10 min,反应体系包括3 020 μL DNaseⅠ、60 μL RNA、100 μL无RNase水、20 μL 10×buffer。取上述RNA样本,稀释60倍后以微量分光光度计检测RNA纯度,分别测定波长260 nm、280 nm处OD值,OD260/OD280>1.8判定为RNA纯净。取模板RNA及引物混合物加入PCR管中,加入无RNase水定容至12.0 μL,70 ℃处理10 min后立即置于冰面上放置2 min合成cDNA,反应体系包括:4.0 μL 单蒸水、0.5 μL上游引物、0.5 μL下游引物、10 μL SYBR®Premix ExTaq TM(TliRNaseH Plus)(2×)及5.0 μL cDNA,启动PCR反应测定组织中LncRNA TUG1、PTEN mRNA相对表达水平,内参分别为GAPDH、β-actin。反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火1 min,72 ℃延伸45 s,循环40次;72 ℃终延伸5 min。采用2-△△CT法计算目标基因的相对表达强度,引物序列设计见表1。

表1 引物序列设计
1.2.3细胞转染
取正常组织细胞及前列腺癌细胞PC-3(购自中国医学科学院基础医学研究所细胞中心)分别接种到RPMI-1640培养基中,置于5% CO2环境(37 ℃恒温)培养细胞。按照1∶5传代,培养5~7 d经显微镜观察显示生长汇合度达80%左右,选取稳定生长对数期细胞进行转染。细胞采用含10% FBS的RPMI-164培养基,置于5% CO2、37 ℃恒温环境下培养。消化后以3×105个/孔在6孔细胞板中种植,设计空白组、阴性转染组与转染组,分别加入无血清培养基、50 nmol/L Si-NC、50 nmol/L si-TUG1,按照Lipofectamine 2000(美国Invitrogen公司)说明书进行转染。温育24 h后,提取PTEN总RNA进行RT-PCR法检测,操作同1.2.2。
1.2.4治疗与随访
所有患者均根据《前列腺癌诊断治疗指南》(2014年)[7]推荐的前列腺癌治疗方案进行术后对症治疗,包括化疗、放疗及不良反应防控等。随访统计术后3年复发/转移率及癌因性病死率,随访截止日期为2020年4月1日或死亡。
1.3 统计学处理

2 结 果
2.1 癌组织及癌旁正常组织中LncRNA TUG1和PTEN mRNA的相对表达水平比较
前列腺组织中LncRNA TUG1相对表达水平明显高于癌旁正常组织,约为正常组织的3.54倍;而PTEN mRNA相对表达水平明显低于癌旁正常组织(P<0.001),见表2。相关性分析显示,癌灶组织中LncRNA TUG1与PTEN mRNA表达水平呈明显负相关性(r=-0.689,P<0.001)。
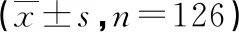
表2 两组标本组织中LncRNA TUG1和PTEN mRNA的相对表达水平比较
2.2 3组PC-3细胞LncRNA TUG1和PTEN mRNA的相对表达水平比较
转染组PC-3细胞中的LncRNA TUG1的相对表达水平明显低于空白组和阴性转染组(P<0.05);PTEN mRNA相对表达水平明显高于空白组和阴性转染组(P<0.05),约为转染前的1.29倍;空白组和阴性转染组两指标比较差异均无统计学意义(P>0.05),见表3。
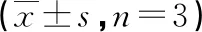
表3 3组PC-3细胞LncRNA TUG1和PTEN mRNA表达水平比较
2.3 LncRNA TUG1、PTEN mRNA相对表达水平与前列腺癌患者临床病理特征的关系
不同年龄、肿瘤大小患者的癌组织中LncRNA TUG1、PTEN mRNA相对表达水平比较,差异均无统计学意义(P>0.05),但不同T分期、AJCC分期、分化程度及是否淋巴结转移患者比较,差异均有统计学意义(P<0.05),见表4。

表4 LncRNA TUG1、PTEN mRNA相对表达水平与临床病理特征的关系
2.4 不同临床转归患者癌组织中LncRNA TUG1、PTEN mRNA相对表达水平比较
126例患者术后随访1~60个月,中位随访时间为36.5个月。1、3年存活率分别为80.95%(102/126)、69.05%(87/126),复发/转移率为40.48%(51/126)。复发/转移患者的癌组织中LncRNA TUG1相对表达水平明显高于无复发/转移患者,且在死亡患者中LncRNA TUG1相对表达水平明显高生存患者(P<0.001);复发/转移患者的癌组织中PTEN mRNA相对表达水平明显低于无复发/转移患者,且在死亡患者中PTEN mRNA相对表达水平明显低于生存患者(P<0.001),见表5。

表5 不同临床转归患者癌组织中LncRNA TUG1、PTEN mRNA表达水平比较
2.5 前列腺癌患者生存影响因素的Cox回归分析
Cox回归分析显示,AJCC分期、T分期、分化程度、淋巴结转移、LncRNA TUG1表达水平均是影响前列腺癌患者生存状况的独立危险因素(P<0.05),PTEN mRNA表达水平是其保护性因素(P<0.05),见表6。
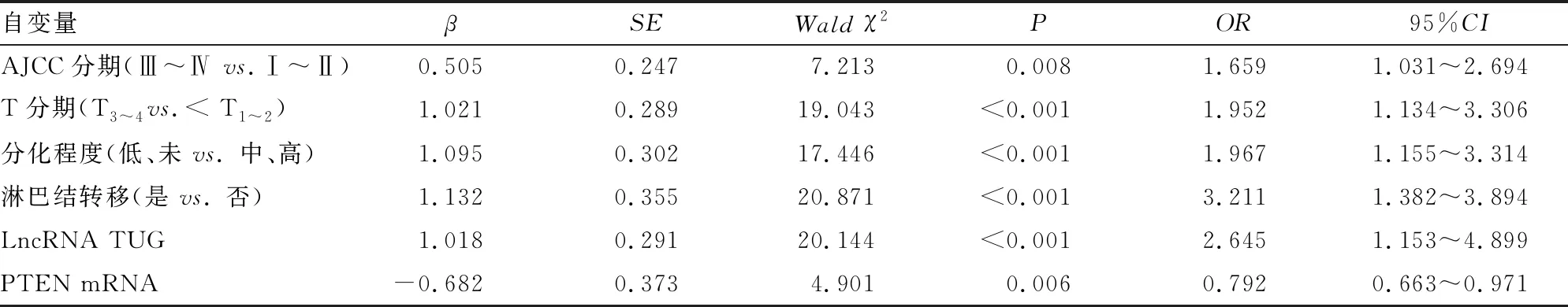
表6 前列腺癌患者生存影响因素的Cox回归分析
3 讨 论
LncRNA是非编码RNA的重要构成,广泛分布于人体各个脏器及细胞中,参与多种复杂基因表达的调控。目前,已有诸多研究证实,LncRNA参与多种恶性肿瘤的发生及发展过程,可能作为肿瘤进展过程中的抑癌或致癌基因而存在[8]。有研究显示,LncRNA能够内源性竞争miRNA而参与上皮间质转化(EMT)相关转录因子表达的调控,从而影响EMT进程,进而影响肿瘤细胞的侵袭、转移过程[9]。LncRNA中TUG1是广泛表达于多种组织细胞中的基因,最早发现于发育中视网膜及神经组织中,近年有不少研究发现LncRNA TUG1参与了膀胱癌、肾癌等泌尿系统恶性肿瘤的发生及发展[10-11]。然而,有关LncRNA TUG1表达在前列腺癌中的作用、可能机制及与临床预后的关系方面尚缺乏充分研究报道。
本研究结果显示,前列腺癌组织中LncRNA TUG1相对表达水平相较于癌旁正常组织明显升高,约为正常组织的3.54倍,提示LncRNA TUG1过表达可能参与前列腺癌的发生、发展。进一步检测抑癌基因PTEN的表达显示,前列腺癌组织中PTEN mRNA相对表达水平明显低于正常组织(P<0.05),与陆巍等[12]报道相符,提示PTEN功能缺失可能参与前列腺癌的发病过程。鉴于LncRNA TUG1与PTEN在前列腺癌中分别发挥促癌与抑癌作用,推测LncRNA TUG1过表达可能通过调节抑癌基因PTEN表达而参与前列腺癌的发生及发展。为此,本研究通过在PC-3细胞中转染si-TUG1抑制LncRNA TUG1表达后显示,转染组的PTEN mRNA相对表达水平明显升高,表达水平约为转染前的1.29倍,提示在前列腺癌中LncRNA TUG1可能抑制PTEN的表达,从而影响其抑癌作用,而PTEN的丢失进一步诱发前列腺癌或引起癌症进展。DU等[13]研究亦发现,IncRNA TUG1可调节前列腺癌中PTEN表达而参与肿瘤的发生及发展,这与本研究结论相符。进一步Pearson相关性分析显示,本组前列腺癌组织中LncRNA TUG1与PTEN mRNA相对表达水平呈明显负相关(r=-0.689,P<0.001),表明前列腺癌组织中LncRNA TUG1过表达增强了其对PTEN表达的抑制作用,导致PTEN功能丢失而引起前列腺癌的发生及发展。但前列腺癌组中LncRNA TUG1过表达是否与PTEN丢失直接相关或存在浓度依赖关系还有待进一步深入研究。
本研究进一步验证LncRNA TUG1表达水平与前列腺癌患者临床病理特征之间的关系显示,T3~4分期、Ⅲ~Ⅳ期患者具有更高的LncRNA TUG1表达,且在未、低分化患者中其相对表达水平高于中、高分化患者,T3~4期者的LncRNA TUG1相对表达水平明显高于T1~2期患者,在伴发淋巴结转移患者中具有更高的LncRNA TUG1表达。提示LncRNA TUG1表达可能与前列腺癌患者的肿瘤侵袭性、恶性程度有关,LncRNA TUG1过表达可能增强其迁移、侵袭行为,而肿瘤迁移、侵袭能力的增强可能增加远期复发、转移风险,导致远期预后不良,文献[14-15]报道也验证了本研究结论。同时,PTEN表达显示出了与LncRNA TUG1相反的变化特征,PTEN低表达或缺失与肿瘤侵袭性、恶性程度有关。推测LncRNA TUG1高表达及PTEN丢失可能与前列腺癌患者的不良生物学行为密切相关,二者相互影响均可能增加远期不良预后风险。随访结果显示,前列腺癌患者术后复发/转移率为40.48%,3年生存率为69.05%,高于杨勇等[16]报道的3年生存率29.8%,可能与样本差异及病情程度不一等有关。比较存活与死亡患者的LncRNA TUG1、PTEN mRNA表达水平显示,死亡患者的LncRNA TUG1相对表达水平明显高于存活者,PTEN mRNA明显低于存活患者(P<0.001),提示LncRNA TUG1高表达及PTEN丢失与前列腺癌患者的远期预后存在一定的关系,这与董云益等[17]研究结论相符。进一步Cox分析显示,AJCC分期(Ⅲ~Ⅳ期)、T3~4期、分化程度(未、低分化)、淋巴结转移、LncRNA TUG1、PTEN mRNA相对表达水平均是影响前列腺癌患者生存状况的独立危险因素(P<0.05)。考虑为LncRNA TUG1过表达可能影响抑癌基因的表达,进而影响癌细胞的增殖迁移,加速癌细胞生长,增加其浸润、转移风险,故可能增加不良预后发生风险。
综上所述,本研究通过检测前列腺癌癌灶组织中LncRNA TUG1及抑癌基因PTEN表达并分析其与前列腺癌临床病理特征、预后间的关系发现,TUG1过表达参与了前列腺癌的发生、发展,且可能通过抑制PTEN表达而诱导癌细胞增殖、分化、侵袭、转移等恶性生物学行为,且过表达TUG1可能促进前列腺癌的复发转移,进而影响临床预后。因此,TUG1有望作为前列腺癌的潜在分子标志物,对前列腺癌的诊治及预后预测均具有参考意义。但本研究样本较小,且缺乏对其可能机制的研究,还需进一步深入研究加以完善。

