脑蛋白水解液对七氟醚麻醉导致的大鼠学习记忆障碍的影响*
童 华 王欣路 冉志超 王庭辉 大边巴
(1.西安市交通大学医学院第一附属医院麻醉科,西安 710061)(2.阿里地区人民医院手麻科,阿里 859000)
七氟醚是临床上常用的一种吸入麻醉药物。随着对七氟醚作用机制的不断了解,目前越来越多研究表明其发挥神经保护作用的同时,具有神经毒性作用,导致患者会出现不同程度的认知功能障碍[1-2]。脑蛋白水解液(cerebroprotein hydrolysate injection,CHI)是一种神经营养药物,其通过血—脑脊液屏障,能有效促进突触的形成,改善和调节神经元的代谢,降低各种神经毒素和缺血对神经细胞损害[3-4]。近年来,CHI被广泛用于轻度中风后和颅脑损伤后认知功能障碍的治疗中。然而,脑蛋白水解物是否可以改善七氟醚致认知功能障碍罕见报道。本实验探讨CHI对七氟醚致大鼠记忆损伤作用的影响,并初步研究其中的作用机制。
1 材料与方法
1.1 主要试剂
脑蛋白水解液(H11022185)购自北京赛升药业股份有限公司;七氟醚(H20070172)购自恒瑞医药有限公司;大鼠丙二醛(MDA)ELISA检测试剂盒、大鼠超氧化物歧化酶(SOD)ELISA检测试剂盒购自纪宁实业有限公司;兔抗鼠SYT1、Bax、Bcl-2、cleaved-Caspase3、β-actin多克隆抗体及HRP标记山羊抗兔二抗购自艾博抗(上海)贸易有限公司;TUNEL细胞凋亡检测试剂盒、HE染色试剂盒、Trizol、通用反转录试剂盒(M-MLV)、Real time PCR荧光定量试剂盒(SYBR Green I)、BCA试剂盒、蛋白双染marker、脱脂奶粉、显影液均购自北京索莱宝有限公司。
1.2 动物分组及处理
SD大鼠购自上海杰思捷实验动物有限公司[SCXK(沪)2018-0004],成年雄性,体质量300~350 g。饲养温度18~26 ℃,相对湿度40%~70%,光照周期为12 h/12 h,饲养周期14 d。将32只大鼠随机分为七氟醚组、CHI高剂量组、CHI低剂量组和对照组,每组8只。七氟醚组吸入2%的七氟醚,每天2 h,连续7 d,CHI高剂量组每天吸入七氟醚之前,尾静脉注射脑蛋白水解液1 200 μL,CHI低剂量组每天吸入七氟醚之前,尾静脉注射脑蛋白水解液300 μL。对照组,每天不吸入七氟醚,尾静脉注射等量生理盐水,具体操作参照文献[5-6]。
1.3 水迷宫实验记录各组大鼠学习记忆能力
停止吸入七氟醚2 d,采用水迷宫实验[5]检测各组大鼠学习记忆能力。每只动物每天训练4次,两次训练间隔15~20 min,连续训练5 d。记录90 s内大鼠找到平台的时间,此时间即为逃避潜伏期。在训练的第6天,将平台撤除,记录大鼠平台停留时间和通过平台的次数。
1.4 HE染色检测各组大鼠海马组织病理学改变
上述实验结束后处死大鼠,取出海马组织。各组海马组织分别用0.9%氯化钠溶液漂洗、吸干,4%多聚甲醛中进行48 h固定,制成5 μm厚连续切片,脱蜡水化后苏木素染液染色3~10 min,分化液分化1~5 s,返蓝液返蓝10 s~1 min,伊红染色30 s~2 min,脱水,透明,封片,镜下观察各组大鼠海马组织病理学变化。
1.5 ELISA检测各组大鼠海马组织中MDA和SOD水平
取各组0.1 g海马组织,加入4 ℃生理盐水溶液制成10%组织匀浆,将组织匀浆以2 500 r/min、 4 ℃离心5 min,收集上清,按试剂盒说明书步骤操作,测定各组大鼠海马组织中MDA和SOD水平。
1.6 TUNEL检测各组大鼠海马神经元细胞凋亡情况
将病理学步骤中脱蜡水化后切片,滴加20 μg/mL蛋白酶K处理15~30 min,然后加入反应混合液进行TUNEL反应。用抗荧光淬灭封片剂封片后观察海马神经元凋亡情况。
1.7 RT-qPCR检测各组大鼠海马组织中SYT1 mRNA表达情况
TRIzol抽提各组大鼠海马组织的RNA,分别按照通用反转录试剂盒(M-MLV)说明书合成cDNA,按照Realtime PCR荧光定量试剂盒(SYBR Green I)说明书检测SYT1 mRNA的表达。RT-qPCR反应体系:5 μL cDNA模板、0.5 μmol/L上/下游引物、10 μL 2×SYBR Green PCR mix、用ddH2O补足20 μL。RT-qPCR反应程序,95 ℃预变性10 min,1个循环,95 ℃变性15 s,58 ℃ 退火20 s,72 ℃延伸20 s,45个循环。以β-actin为内参,每个样品进行3次重复,2-ΔΔCt的方法进行相对定量分析。SYT1上游引物5′- TCATTCAGGCTGCCGAACTGCC-3′,下游引物:5′-TCAGCACTTTGCAGGTCACGCC-3′;β-actin上游引物:5′-GATTACTGCTCTGCTCCTAGCA -3′,下游引物:5′- GCCACCGATCCACACAGAGT-3′。
1.8 Western blot检测各组大鼠海马组织中SYT1、Bax、Bcl-2和cleaved-Caspase3蛋白表达情况
各组海马组织中分别加入RIPA裂解液,冰上裂解20 min,4 ℃、13 000 r/min离心20 min,取上清并采用BCA试剂盒测定蛋白含量。取30 μg蛋白液进行SDS-PAGE,转膜,用封闭液(5%脱脂奶粉)封闭,分别加入兔抗鼠SYT1(1∶1 000)、Bax(1∶5 000)、Bcl-2(1∶2 000)、cleaved-Caspase3(1∶2 000)、β-actin(1∶10 000)抗体4 ℃过夜,洗涤后,再加入二抗(1∶10 000)室温孵育1 h。ECL曝光成像,最后采用Alpha Imager HP 凝胶成像系统分析结果。
1.9 统计学方法

2 结果
2.1 脑蛋白水解液对大鼠学习记忆能力的影响
与对照组相比,七氟醚组、CHI高剂量组、CHI低剂量组大鼠逃避潜伏期显著增加(P<0.05),穿越平台次数显著减少(P<0.05),平台停留时间显著缩短(P<0.05)。与七氟醚组相比,CHI高剂量组大鼠逃避潜伏期显著缩短(P<0.05),穿越平台次数显著增加(P<0.05),平台停留时间显著延长(P<0.05),而CHI低剂量组大鼠逃避潜伏期、穿越平台次数、平台停留时间与七氟醚组比较均无显著性差异(P>0.05),见表1所列。
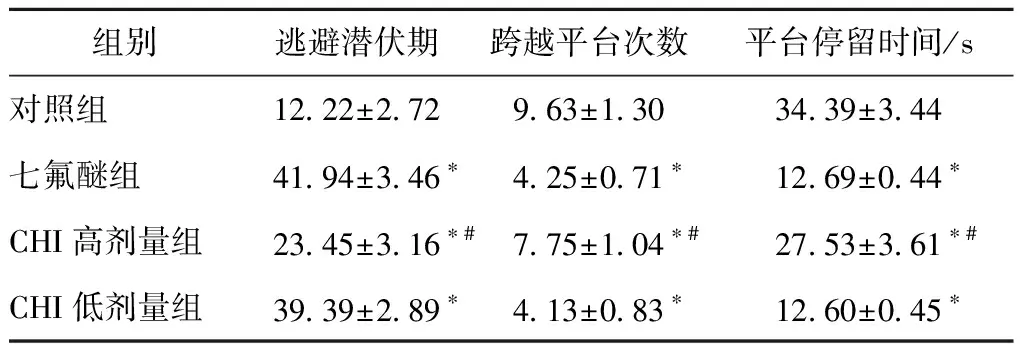
表1 脑蛋白水解液对大鼠学习记忆能力的影响Table 1 Effect of cerebroprotein hydrolysate injection onlearning and memory ability of rats
2.2 各组大鼠海马组织病理学变化
对照组大鼠海马神经元细胞结构、排列、形态均正常,七氟醚组大鼠海马神经元细胞排列松散凌乱,边界不清,细胞核固缩,出现空泡,着色较深,CHI高剂量组大鼠海马神经元细胞较七氟醚组细胞排列相对紧密,细胞核固缩和空泡现象得到改善,而CHI低剂量组大鼠海马神经元细胞损伤情况较七氟醚组无明显改善,如图1所示。
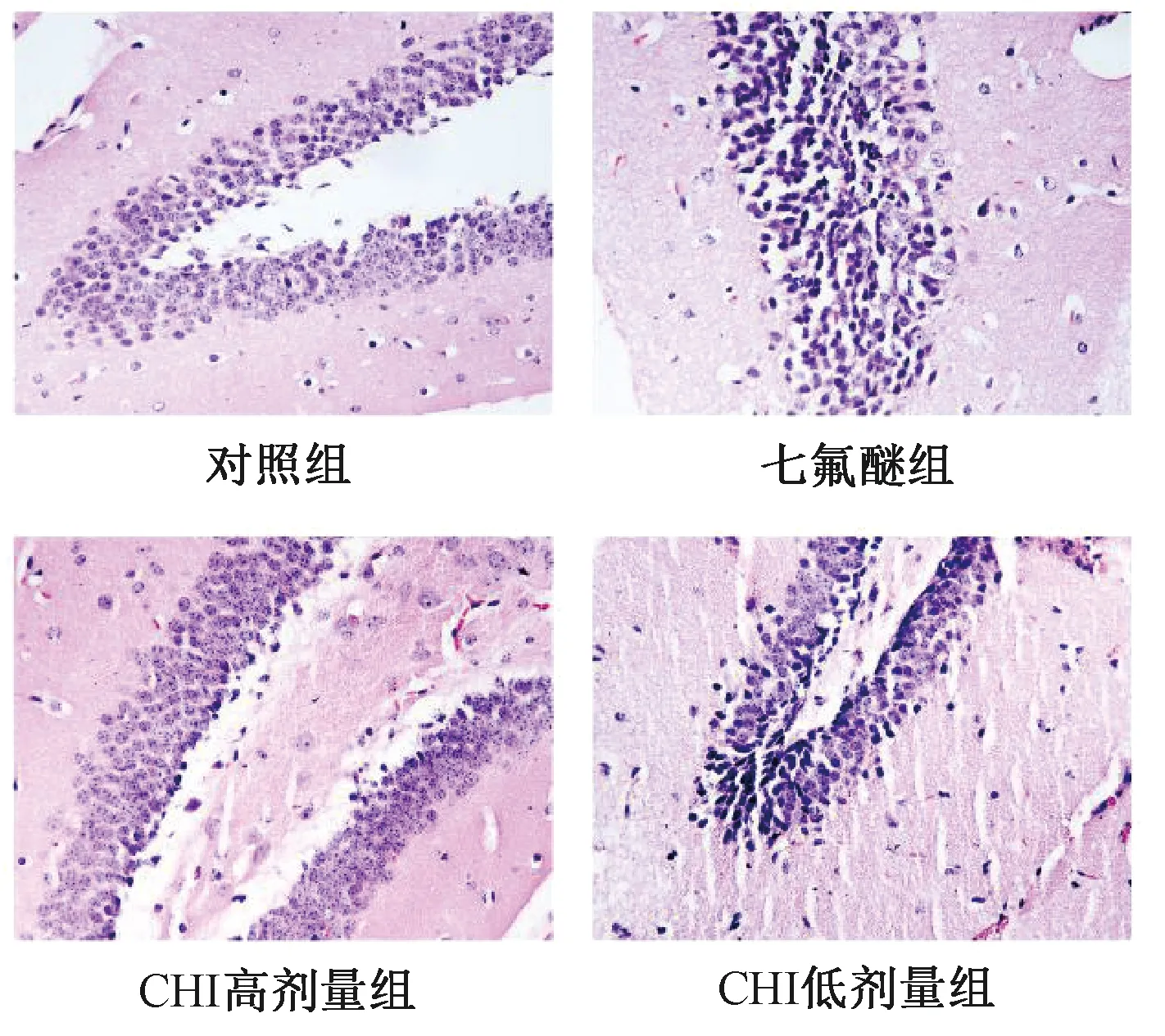
图1 各组大鼠海马组织病理变化(×200)Fig.1 Pathological changes in hippocampusof rats in each group(×200)
2.3 脑蛋白水解液对大鼠海马组织MDA和SOD的影响
与对照组相比,七氟醚组、CHI高剂量组、CHI低剂量组大鼠海马组织MDA含量显著增加(P<0.05),SOD活性显著下降(P<0.05);与七氟醚组比,CHI高剂量组大鼠海马组织MDA含量显著下降,SOD活性显著增加(均P<0.05),而CHI低剂量组大鼠海马组织MDA含量和SOD活性与七氟醚组比较均无显著性差异(均P>0.05),见表2所列。

表2 脑蛋白水解液对大鼠氧化应激反应的影响Table 2 Effect of cerebroprotein hydrolysate injectionon oxidative stress in rats
2.4 脑蛋白水解液对各组大鼠海马神经元细胞凋亡的影响
与对照组相比,七氟醚组、CHI高剂量组、CHI低剂量组大鼠海马神经元细胞凋亡率以及Bax、cleaved-Caspase3蛋白显著升高,Bcl-2蛋白含量显著下降(均P<0.05);与七氟醚组比,CHI高剂量组大鼠海马神经元细胞凋亡率以及Bax、cleaved-Caspase3蛋白显著下降,Bcl-2蛋白含量显著升高(均P<0.05),而CHI低剂量组大鼠海马神经元细胞凋亡情况无明显改善(均P>0.05),如图2和图3所示。
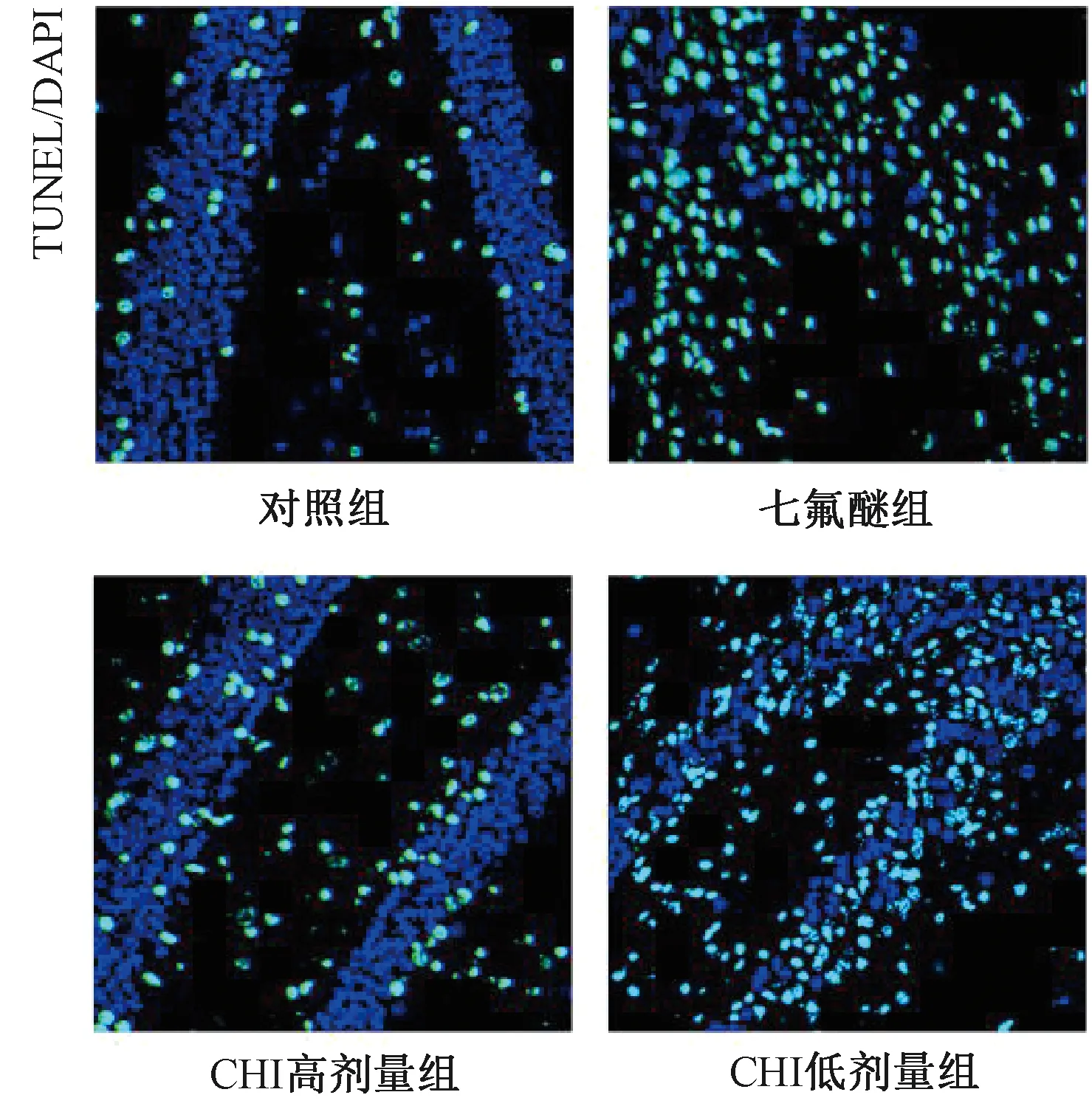
图2 脑蛋白水解液对各组大鼠海马神经元细胞凋亡的影响(×200)Fig.2 Effect of cerebroprotein hydrolysate injection onapoptosis of hippocampal neurons in rats(×200)
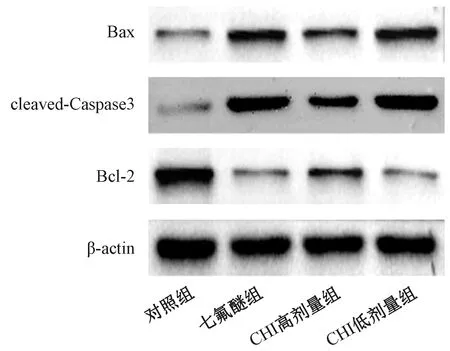
图3 脑蛋白水解液对各组大鼠海马神经元细胞凋亡相关蛋白的影响Fig.3 Effect of cerebroprotein hydrolysate injection onapoptosis related proteins of hippocampal neurons in rats
2.5 脑蛋白水解液对大鼠海马组织SYT1表达水平的影响
与对照组相比,七氟醚组、CHI高剂量组、CHI低剂量组大鼠海马组织SYT1 mRNA和蛋白表达水平显著下降(P<0.05);与七氟醚组比,CHI高剂量组大鼠海马神经元组织SYTI mRNA和蛋白表达水平显著升高(均P<0.05),CHI低剂量组大鼠海马神经元组织SYTI mRNA和蛋白表达水平无显著变化(均P>0.05),如图4所示。
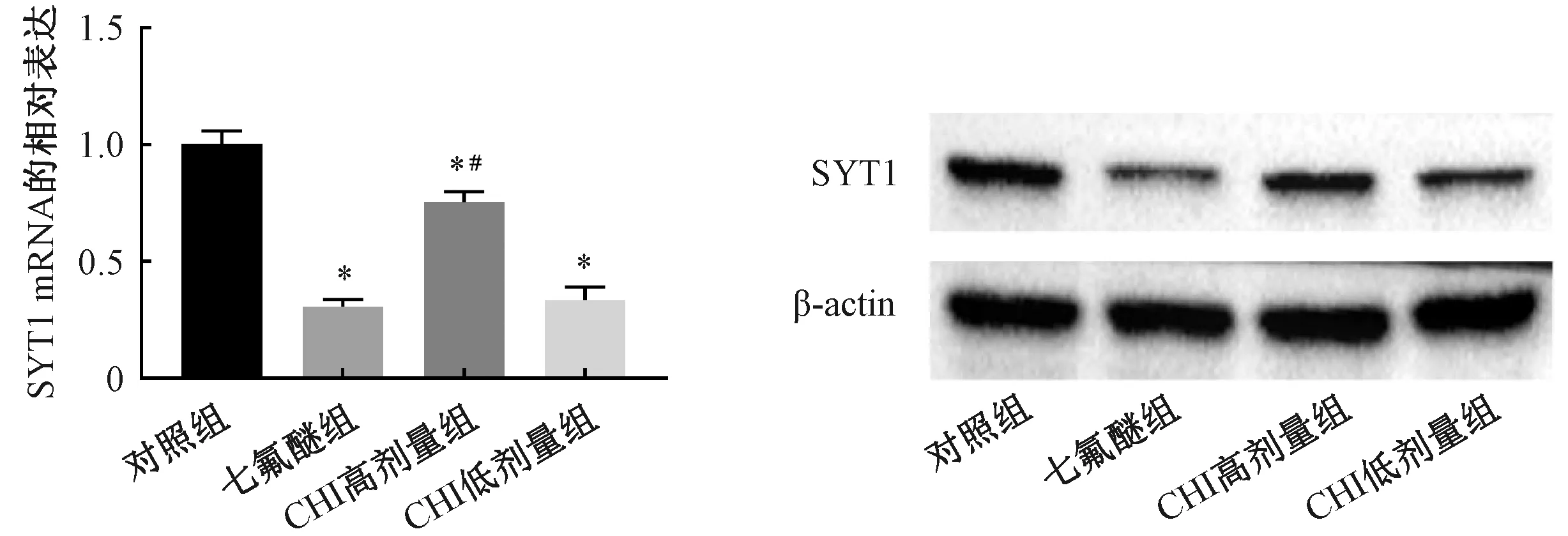
图4 脑蛋白水解液对各组大鼠海马组织SYT1表达水平的影响注:与对照组相比,*P<0.05;与七氟醚组相比,#P<0.05Fig.4 Effect of cerebroprotein hydrolysate injectionin on expression of syt1 in hippocampus of ratsNote: Compared with the control group,*P<0.05; Compared with the sevoflurane group,#P<0.05
3 讨论
近年来麻醉药物致患者认知功能障碍(postoperative cognitive dysfunction,POCD)的问题受到广泛重视。七氟醚作为广泛应用的吸入全身麻醉药,已被证实是诱发乳腺癌患者发生POCD的独立危险因素之一[7-8]。因此,七氟醚对患者中枢神经系统的毒性作用不可忽视。
海马主要负责长时记忆的存储转换和定向等功能,在学习和记忆方面扮演着重要角色,受损后会影响学习记忆功能。刘勇攀等[5]研究表明,反复吸入七氟醚可以通过诱导海马组织神经元细胞凋亡引起大鼠认知功能障碍。本研究发现,七氟醚吸入前预先给予高剂量CHI可以有效缓解七氟醚诱导的学习记忆障碍。另外,在组织水平观察到吸入七氟醚前给予高剂量CHI的大鼠海马组织神经细胞形态得到改善,且海马组织神经元细胞凋亡率及凋亡相关Bax和cleaved-Caspase3蛋白显著下降,而Bcl-2蛋白含量显著升高。由此可知,CHI减轻七氟醚致大鼠记忆障碍可能与减少神经元细胞凋亡有关。这与Vaghef等[9]研究结果相似,他们指出CHI通过抑制大鼠海马神经元细胞凋亡减轻乙醇诱导的学习记忆损伤。研究表明,吸入七氟醚会刺激线粒体产生大量的ROS,诱导细胞内脂质体和蛋白质的氧化,从而导致线粒体肿胀,诱发凋亡因子激活,进一步诱导海马神经元的凋亡[10-11]。谭宇亭等[12]研究表明,白藜芦醇(RES)对七氟醚所致新生大鼠脑损伤的治疗作用与降低氧化应激水平有关。Sherif等[13]研究表明,CHI参与介导脑组织的氧化应激变化。因此,本研究检测了大鼠海马组织MDA和SOD水平的变化,结果表明CHI高剂量组大鼠海马组织MDA含量显著下降,SOD活性显著增加,提示CHI可能通过降低氧化应激损伤,进一步减轻七氟醚所致的神经损伤。
突触可塑性是学习记忆的神经生物学基础,在海马脑区,增加突触可塑性是学习记忆能力提高的基础。SYT1属于Syt家族的一员,可快速结合Ca2+,对胞吞、胞吐过程进行有效的调控,从而调节神经递质的释放,影响突触可塑性[14]。Zhang等[15]研究表明,七氟醚通过下调大鼠海马区SYT1表达,减少突触数目、增宽突触间隙,从而降低突触传递效能,导致学习记忆能力损伤。本研究发现七氟醚吸入前预先给予高剂量CHI可以有效提高SYTI mRNA和蛋白表达水平,提示CHI可能通过增加SYT1的表达改善七氟醚所致大鼠学习记忆障碍。以上研究结果与邓海峰等[16]研究结果相似,他们指出毛蕊花糖苷可能通过增加Syt1的表达改善慢性温和不可预知应激(CUMS)大鼠的学习记忆能力。
本研究初步表明七氟醚吸入前预先给予高剂量CHI能够改善七氟醚麻醉导致的大鼠学习记忆障碍,其机制可能与降低氧化应激损伤,抑制海马神经元细胞凋亡和增加SYT1表达有关。

