中和反应在实验探究中的华丽“变身”
山东省枣庄市市中区永安镇中学 陈 丽 277100
科学探究是学生积极主动地获取化学知识、认识和解决化学问题的重要实践活动[1],也是新课程倡导的重要学习方式,更是中考永恒不变的命题类型.纵观近几年中考化学试题,关于中和反应的实验探究内容多变、形式灵活,呈现了一派华丽“变身”的景象.
1 探究反应是否发生
例1(2020.十堰)实验探究一:碱能与酸发生中和反应,为探究中和反应是否已经发生,设计了如下实验:(1)向盛有澄清石灰水的烧杯中先滴加几滴酚酞溶液,再缓慢滴加稀盐酸,边加边搅拌.当观察到_____,说明中和反应已经发生.(2)向盛有少量石灰乳的烧杯中加入适量稀盐酸,并搅拌,观察到白色浑浊完全消失,该实验_____(填“能”或“不能”)说明中和反应已经发生.
实验探究二:向盛有氯化铜溶液的烧杯中加入过量稀氢氧化钠溶液,观察到____,说明碱能与某些盐发生反应.
实验探究三:在完成实验探究一、二后,将三只烧杯中的所有物质倒入废液缸,最终得到澄清溶液.该溶液中除酚酞外,一定含有的溶质有________.
归纳总结:碱能跟某些非金属氧化物、酸、某些盐反应,还能使酸碱指示剂显色.
解析:实验探究一:(1)酚酞试液在碱性溶液中显示红色,是因为溶液中存在氢氧根离子.当向碱性溶液中滴入酸后,由于发生中和反应而使氢氧根离子消耗,因此红色会逐渐褪去.所以,向盛有澄清石灰水的烧杯中先滴加几滴酚酞溶液,此时溶液呈红色,再缓慢滴加稀盐酸,当观察到溶液由红色变成无色,说明中和反应已经发生.(2)氢氧化钙能溶于水,而稀盐酸中含有较多的水,所以向盛有少量石灰乳的烧杯中加入稀盐酸观察到白色浑浊完全消失,可能是由于氢氧化钙被水溶解而使溶液变的澄清.所以,该实验不能说明中和反应已经发生.
实验探究二:氯化铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠.所以,向盛有氯化铜溶液的烧杯中加入过量稀氢氧化钠溶液,可以观察到有蓝色沉淀生成;
实验探究三:探究一反应的化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O,实验后溶液中一定含有氯化钙;探究二反应的化学方程式为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl,实验后溶液中一定含有氯化钠;探究三中,将三只烧杯中的所有物质倒入废液缸最终得到澄清溶液,说明探究一中酸过量,把探究二中生成的氢氧化铜和过量的氢氧化钠反应消耗掉,反应的化学方程式为:Cu(OH)2+2HCl=CuCl2+2H2O,NaOH+HCl=NaCl+H2O,此时酸仍可能有剩余,但氢氧化铜和氢氧化钠无剩余.故混合后的溶液中除酚酞外,一定含有的溶质有氯化钙、氯化钠和氯化铜,可能含有稀盐酸.
答案:溶液由红色变成无色;不能;有蓝色沉淀生成;氯化钙、氯化钠、氯化铜(填化学式也正确).
点评:很多酸碱反应时没有明显的现象,因此需借助指示剂、pH计、温度计等,通过颜色的变化、pH的变化或温度的变化情况间接确定.此题通过探究“中和反应是否发生”,考查了指示剂随溶液酸碱性的变色情况、氢氧化钙的溶解性以及酸碱盐之间的反应等知识点,也考查了学生严密的逻辑思维能力,有助于激发对科学的兴趣,培养科学素养,提高科学探究能力.
2 探究反应生成了水
例2(2020.天门)“如何验证酸与碱反应生成水”是以下探究过程中的研究主题,请完成以下相关问题.
(1)实验证明酸与碱可发生中和反应,图1从微观角度说明中和反应的实质是________.
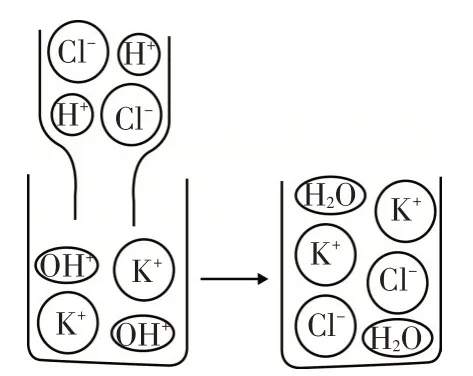
图1
(2)盐酸、硫酸等酸以酸溶液的形式存在,酸溶液与碱反应时,无法判断生成物中有“水”生成.如何设计实验验证酸与碱发生反应生成了“水”?
(3)冰醋酸即无水醋酸,蓝色硅胶遇水变红,CH3COOH+NaOH=CH3COONa+H2O,是冰醋酸与NaOH固体反应的化学方程式,CH3COONa在水溶液中可解离出自由移动的CH3COO-和Na+.将适量的冰醋酸(CH3COOH)、NaOH固体及几粒蓝色硅胶置于试管中,塞上橡皮塞,轻轻振荡试管,观察到的现象是 ______.上述实验及实验现象,能说明“水”是化学反应生成的吗?该结论不严谨!
(4)以科学严谨的态度思考,应在下列2个实验的基础上,再做上述实验.__________

实验一实验二__________实验方案(写出所用试剂即可)、实验现象试剂与现象:试剂与现象:
①上述设计采用了____的实验方法.②冰醋酸与NaOH固体充分混合后得到的固液混合物能够导电,是因为________.
解析:观察反应的微观示意图可知,盐酸中的氯离子和氢氧化钾中的钾离子在反应后并无变化,而氢离子和氢氧根离子在反应后结合成了水分子,所以中和反应的实质是酸中的氢离子和碱中的氢氧根离子结合生成水分子;冰醋酸(CH3COOH)为酸,NaOH为碱,它们相遇由于发生中和反应而生成水,因此能使同在试管中的蓝色硅胶变红;但是使蓝色硅胶变红的水可能是化学反应生成的,也可能是冰醋酸固体和氢氧化钠固体本身含有的,因此该结论并不严谨,应设计对比实验,验证冰醋酸固体和氢氧化钠固体不含水,从而排除后者.因此解决方案中,实验所需要的试剂分别为冰醋酸固体和氢氧化钠固体,实验现象是蓝色硅胶不变色;溶液能够导电,是因为存在自由移动的离子.CH3COONa在水溶液中可解离出自由移动的CH3COO-和Na+,因此冰醋酸与NaOH固体充分混合后得到的固液混合物能够导电.
答案:氢离子和氢氧根离子结合生成水分子;蓝色硅胶变红;冰醋酸,蓝色硅胶不变色;氢氧化钠固体,蓝色硅胶不变色;对比;CH3COONa在水溶液中可解离出自由移动的CH3COO-和Na+.
点评:中和反应中一定有水生成,但往往观察不到,因此需要进行巧妙的设计、科学的验证和严密的逻辑推理.此题巧妙选择冰醋酸和氢氧化钠固体作为反应物,借助“蓝色硅胶遇水变红”的事实原理验证“水”的存在,运用“对比”的实验方法进行排除和推论,不仅呈现了科学探究的科学性和严谨性,也开阔了学生视野,有利于培养他们的创新精神和实践能力,激励他们从多角度、全方位去分析和解决问题.
3 探究反应中温度变化
例3(2020.泰州)酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究.
实验探究Ⅰ 在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度____,由此现象小李同学得出两者能发生反应的结论.通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化;②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化;③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化.用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图2所示.
(1)由图2可知,盐酸、氢氧化钠溶液稀释时均______(填“放热”或“吸热”),但它们稀释时温度的变化量远_____两溶液混合时温度的变化量.
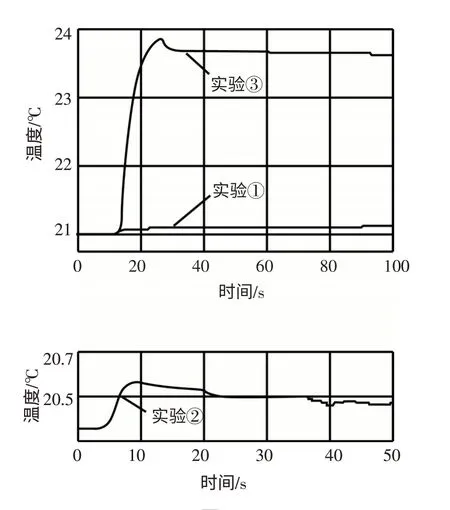
图2
(2)从微观角度分析,此中和反应的温度变化主要是由于_____(填离子符号)两种离子发生反应放出热量的缘故.
实验探究Ⅱ(1)在50mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应.该反应的化学方程式为________.(2)取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色.同学们对红色溶液中溶质的成分(酚酞除外)进行再探究.查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色.作出猜想:猜想一NaCl;猜想二:NaCl、NaOH;猜想三NaCl、NaOH和Na2CO3.同学们讨论后一致认为猜想_____是错误的,理由是______.实验验证:取样,滴加___,无气泡产生,猜想三错误.原因分析:反应后无色溶液中仍存在少量NaOH,加热蒸发,当溶液的pH在___范围内,溶液的颜色变红.总结反思:向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色____(填“一定”或“不一定”)变红.
解析:中和反应是放热反应,所以向氢氧化钠溶液中滴加盐酸,由于酸碱中和放出热量而使溶液的温度升高;仔细观察图2,发现盐酸、氢氧化钠溶液稀释时温度的变化曲线都是上升的,因此可知它们的溶液稀释时均放出热量,但曲线上升的程度是不同的,实验③上升的幅度最大,实验①和②上升的幅度较小,由此可知盐酸、氢氧化钠溶液稀释时温度的变化量远小于两溶液混合反应时温度的变化量;中和反应放热的原因是酸中的氢离子和碱中的氢氧根离子结合生成水分子的缘故;盐酸和氢氧化钠反应生成氯化钠和水,化学方程式为NaOH+HCl=NaCl+H2O;根据质量守恒定律可知,化学反应前后元素的种类不变,盐酸和氢氧化钠中只含氢、氧、氯、钠四种元素,不含碳元素,反应后不会生成碳酸钠,所以猜想三是错误的;进一步排除碳酸钠的存在,可以利用碳酸钠能与酸发生反应放出气体的性质进行实验,但由于氢氧化钠的存在,所以必须加入足量的酸溶液,无气泡产生,才能判断猜想三错误;根据资料“酚酞在pH<8.2的溶液中呈无色,在8.2<pH<14的溶液中呈红色”,反应后的溶液pH只有在8.2—14的范围内,溶液才能从无色变为红色,所以向某碱性溶液中滴加2~3滴无色酚酞试液,振荡后溶液的颜色不一定变红.
答案:升高;放热;小于;H+、OH-;NaOH+HCl=NaCl+H2O;三;反应物中不含碳元素;足量稀盐酸;8.2~14;不一定.
点评:化学变化中往往伴随能量的变化,这种能量的变化通常表现为热能、光能和电能的释放或吸收.酸和碱相遇时,由于能量较高的氢离子和氢氧根离子结合生成能量较低的水分子,因此反应会放出热量.此题围绕盐酸和氢氧化钠的中和反应放热情况和实验过程中的“意外”情况展开探究,展示了比较完整的科学探究过程:猜想、验证、结论、反思,不仅考查了学生的思维能力、读图、识图及获取、使用信息的能力,也增进了学生对科学探究的理解,发展了科学探究能力,更突出了新课改理念,激励学生勇于探究、敢于质疑、大胆创新.
4 探究反应的程度
例4(2020.毕节)在《探究酸、碱的化学性质》实验课上,某同学向盛有约2mL氢氧化钠溶液的试管中滴加稀硫酸,没有观察到现象.请教老师后,他发现自己在滴加稀硫酸前忘了加入酸碱指示剂,导致无法判断反应情况,于是他对试管中溶液的中和程度进行探究.探究目的:探究试管中溶液的中和程度.实验原理:试管中发生反应的化学方程式为_______.做出猜想:猜想l,氢氧化钠未完全反应,溶液呈碱性.猜想2,氢氧化钠和硫酸恰好完全反应,溶液呈中性.猜想3,氢氧化钠完全反应、硫酸过量,溶液呈酸性.

实验操作另用试管取该溶液1~2mL,滴 入1~2滴无色酚酞溶液,振荡实验现象溶液变实验结论溶液呈碱性溶液不变色溶液呈酸性或中性
分析思考:(1)若溶液呈碱性,向试管里的溶液中逐滴加入FeCl3溶液,将产生红褐色沉淀,反应的化学方程式为______.

方案1用pH试纸测其酸碱度,若pH 7(选方案2填“>”“<”或“=”),则溶液呈酸性加入金属锌,若有气泡产生,则溶液呈酸性,该反应的化学方程式为 .
(2)若滴入酚酞后溶液不变色,为进一步确定溶液的酸碱性,该同学提出了以下方案:
解析:氢氧化钠与硫酸反应生成硫酸钠和水,化学方程式为2NaOH+H2SO4=Na2SO4+2H2O;酚酞在碱性溶液中变红,在酸性和中性溶液中为无色;若溶液呈碱性,则溶液中含有氢氧化钠,向试管里的溶液中逐滴加入FeCl3溶液,氢氧化钠和氯化铁反应生成氢氧化铁红褐色沉淀和氯化钠,化学方程式为3NaOH+FeCl3=Fe(OH)3↓+3NaCl;pH<7时,溶液呈酸性,pH=7时,溶液呈中性,pH>7时,溶液呈碱性.故用pH试纸测其酸碱度,若溶液呈酸性,则pH<7;若溶液呈酸性,则溶液中含硫酸,锌和硫酸反应生成硫酸锌和氢气,化学方程式为Zn+H2SO4=ZnSO4+H2↑.
答案:2NaOH+H2SO4=Na2SO4+2H2O;红色;3NaOH+FeCl3=Fe(OH)3↓+3NaCl;<;Zn+H2SO4=ZnSO4+H2↑.
点评:中和反应的程度取决于溶液中酸、碱有无剩余.若酸剩余,则溶液中存在多余的氢离子,显酸性;若碱剩余,则溶液中存在多余的氢氧根离子,显碱性;若酸、碱均无剩余,则溶液中既无多余的氢离子,也无多余的氢氧根离子,此时为酸碱恰好中和,溶液呈中性.此题以探究“氢氧化钠溶液和稀硫酸的中和程度”为题,考查了酸碱指示剂、pH、体现酸、碱性质的有关反应化学方程式等知识,使学生认识到科学探究既需要观察和实验,又需要进行推理和判断.理清“头绪”,扎实掌握溶液酸碱性与指示剂颜色、pH范围的关系,以及酸碱盐有关反应的基础知识,是正确解题的关键.

