气相色谱-质谱法测定土壤中6种多溴联苯醚及2种羟基代谢物
郇志博 王晓燕 吕岱竹
(1中国热带农业科学院分析测试中心海南海口571101;2海南省热带果蔬产品质量安全重点实验室海南海口571101;3昌吉学院新疆昌吉831100)
多溴联苯醚(polybrominated diphenyl ethers,PBDEs)是一种广泛应用的溴系阻燃剂[1]。近年来的研究表明PBDEs在大气、水、沉积物、污泥、土壤和生物体内被广泛检出[2]。PBDEs具有生殖毒性、免疫毒性、神经毒性和内分泌干扰作用,因而遭到世界各国的禁用[3]。另外有研究表明,PBDEs的代谢物,尤其是羟基化代谢物,毒性甚至比母体化合物更大[4]。土壤是储存和汇聚PBDEs的主要场所,也是植物源农产品中PBDEs的主要来源之一[5]。因此,测定土壤中PBDEs及其代谢物的含量对保障农产品质量安全以及探究PBDEs的迁移代谢机制具有重要意义。
目前测定土壤中PBDEs的前处理方法主要有超声法[6]、索氏提取法[7]、基质固相分散萃取法[8]和加速溶剂萃取法(ASE)[9-11];仪器分析方法主要有气相色谱法(GC)[6]、气相色谱-质谱法(GCMS)[7-11]、超高压液相色谱-串联质谱法(UPLC-MS/MS)[12]。索氏提取法和基质固相分散萃取法前处理繁琐耗时较长,加速溶剂萃取法需要快速溶剂萃取仪,超声萃取相对简单且容易普及。气相色谱法只依靠保留时间定性,易产生假阳性[11];液相色谱-串联质谱法中的电喷雾源在分析低极性化合物时离子化效率较低,并不适用于PBDEs的分析[13]。气相色谱-质谱法可同时分析PBDEs及羟基代谢物,通过硅烷化试剂作为衍生试剂可以提升仪器对羟基代谢物的灵敏度[14]。本研究将探索一种采用超声萃取结合气相色谱-质谱联用仪测定提取 土 壤 中6种 主 要 的PBDEs(BDE-28、BDE-47、BDE-99、BDE-153、BDE-183)以及2种羟基代谢物(6-OH-BDE-47和4´-OH-BDE-49)的方法。
1 材料与方法
1.1 材料
1.1.1 土样
土壤样品:采集自海口(1#)、澄迈(2#)、文昌(3#)、五指山(4#)、昌江(5#)、乐东(6#)、琼海(7#)、陵水(8#)、三亚(9#)等9市县蔬菜种植基地的表层土壤(0~15 cm)。
1.1.2 仪器
安捷伦7890B-7000C型气相色谱-质谱联用仪,配7693自动进样器(美国Agilent公司);Milli-Q型超纯水器(美国Millipore公司)。
1.1.3 试剂
BDE-209、BDE-28、BDE-47、BDE-99、BDE-153、BDE-183、6-OH-BDE-47、4´-OH-BDE-49标准品(图1)(>99%,百灵威科技有限公司));甲基叔丁基醚、二氯甲烷、丙酮、正己烷、(色谱纯,美国Fisher公司);无水乙醇、无水硫酸钠、氢氧化钾均为分析纯;CNWBOND酸性硅胶/无水硫酸钠固相萃取小柱(1 g/10mL,上海安谱公司)。
待测物的标准储备溶液:将8种化合物的标准品用正己烷稀释至10.00 mg/L,置于4°C冰箱保存,使用期限为6个月。

图1 PBDEs及羟基代谢物的结构式
1.2 方法
1.2.1 样品的制备
采集的土壤样品需经人工去除石块和植物根茎等杂物,室温放置晾干,然后磨碎过60目筛,最终筛好的土壤样品保存在棕色瓶中待用。
1.2.2 样品的提取和净化
首先称取约5.0 g土壤样品至50 mL离心管中,然后准确量取15 mL体积比为1∶1的正己烷-丙酮混合液至离心管中,将样品涡旋5 min,超声提取20 min,然后以8 000 r/min的速度离心5 min,离心后将上层液体转移到体积为100 mL的圆底烧瓶中,然后将残渣再次加入15 mL的体积比为1∶1的正己烷-丙酮混合液重复提取1次,将2次提取液合并后,使用旋转蒸发仪将提取液蒸发近干,最后再次加入5 mL的正己烷重新溶解,待下一步净化操作。
净化过程使用酸性硅胶/无水硫酸钠固相萃取小柱,首先使用5 mL的正己烷活化固相萃取小柱,然后将上一步待净化液全部转移到活化后的固相萃取小柱中,并使用10 mL体积比为1∶1的二氯甲烷与正己烷的混合液进行洗脱,收集洗脱液后,再次使用旋转蒸发仪将洗脱液蒸发近干,然后再次加入5 mL的正己烷重新溶解,并且待下一步的上机分析。
测定OH-PBDEs时,提取液为体积比为4∶4∶2的正己烷、二氯甲烷与甲基叔丁基醚的混合液,净化液旋蒸近干后,依次加入1 mL 0.5 moL/L的氢氧化钾-乙醇溶液、1 mL 2 moL/L的盐酸溶液和1 mL三甲基硅烷化重氮甲烷,置于60℃水浴锅中衍生30 min,待冷却后加入5.0 mL正己烷涡旋混匀,室温静置30 min,取上层正己烷相过0.22μm有机滤膜待GC-MS分析。
1.2.3 色谱、质谱测定
色谱方法:色谱柱为DB-5MS石英毛细管柱,载气为高纯氦气,载气流速为1.0 mL/min,采用不分流进样,进样体积为2.0μL;BDE-209、其他5种PBDEs和2种OH-PBDEs的进样口温度分别为280、270、270℃,溶剂延迟时间分别为5、8、8 min;BDE-209的柱升温程序:初始温度80℃保持1 min;以30℃/min速率升温至280℃;再以15℃/min的速率升温至300℃,保持8 min。其他5种PBDEs柱升温程序:初始温度60°C保持1 min;以20℃/min速率升温至220℃;再以5℃/min的速率升温至290℃,保持10 min。2种代谢物的柱升温程序为起始温度为60℃,该起始温度保持1 min后以每分钟20℃的速率升温至220℃,再以每分钟10°C的速率升温到290℃,最终温度保持1 min。
质谱方法:质谱采用电子轰击离子源,电离电压70 eV;离子源温度230℃,传输线温度280℃;采集方式为选择离子监测(SIM)模式。其余质谱参数见表1。
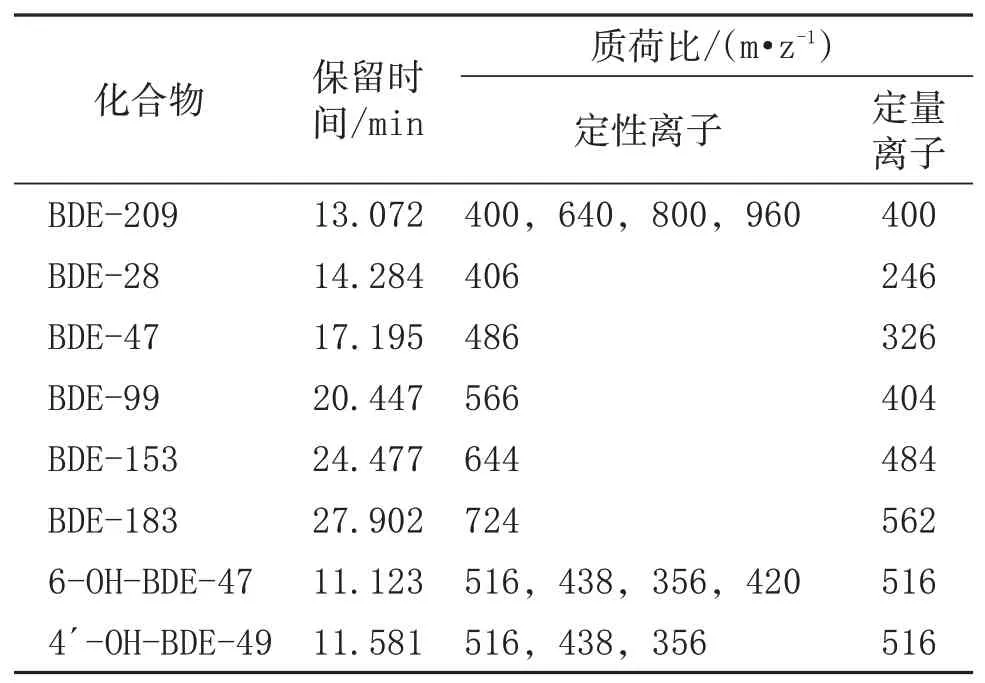
表1 质谱参数
2.3 标准曲线和检出限
2 结果与分析
2.1 GC-MS分离结果
分别将配制好的BDE-209单标溶液、其他5种PBDEs混合标准溶液和2种OH-PBDEs的混合标准溶液按照上面的GC-MS仪器条件上机,得到BDE-209、其他5种PBDEs和2种OH-PBDEs的总离子流色谱图(图2)。从图2可以看到,BDE-209的保留时间约为13.0 min,BDE-28、BDE-47、BDE-99、BDE-153和BDE-183的保留时间约为14.3、17.2、20.5、24.5和27.9 min,两种代谢物6-OH-BDE-47和4´-OH-BDE-49的保留时间分别为11.1和11.6 min,可以看到各个物质分离效果较好,色谱峰峰形较好,无拖尾和重叠。
2.2 基质效应
在进行质谱分析时,最常遇到的问题是基质对质谱信号的干扰,会造成检测结果不准确。因此在建立质谱分析方法时,需要优先考察基质效应(Matrix Effect,ME),实际检测过程中,通常需要使用空白基质的提取净化液来配制基质标准,然后经上机分析绘制基质标准曲线,并且求得基质标准曲线的斜率(S基质),将该斜率与纯溶剂配制的待测物质的标准曲线斜率(S溶剂)进行比较,具体的计算公式为ME=(S基质/S溶剂-1)×100%计算[15],如果ME>0,表明该基质会造成基质增强效应,若ME<0,表明该基质会造成抑制效应,并且当0≤|ME|≤20%时,说明该基质对待测物的信号干扰较低,可忽略不计;当20%<|ME|<50%时,表现为中等强度的基质干扰,而当|ME|≥50%,则为强基质干扰。本研究基质效应|ME|为2.2%~10.5%,说明该基质对待测物的信号干扰较低,可忽略不计。
本研究采用外标法分析土壤中待测物的含量,由于基质干扰效应较弱,因此使用溶剂配制的标准曲线来进行定量分析,配制溶剂标准系列浓度分别为0.001、0.005、0.010、0.020 mg/L,最终得到的待分析物质的标准曲线的线性回归方程和相关系数见表2。由表2可知,在分析范围内几种待测物的线性关系良好,可用于下一步的定量分析。另外为考察仪器的灵敏度,使用3倍信噪比来计算方法的检出限,计算得知8种物质的检测限在1.046~2.830μg/kg。
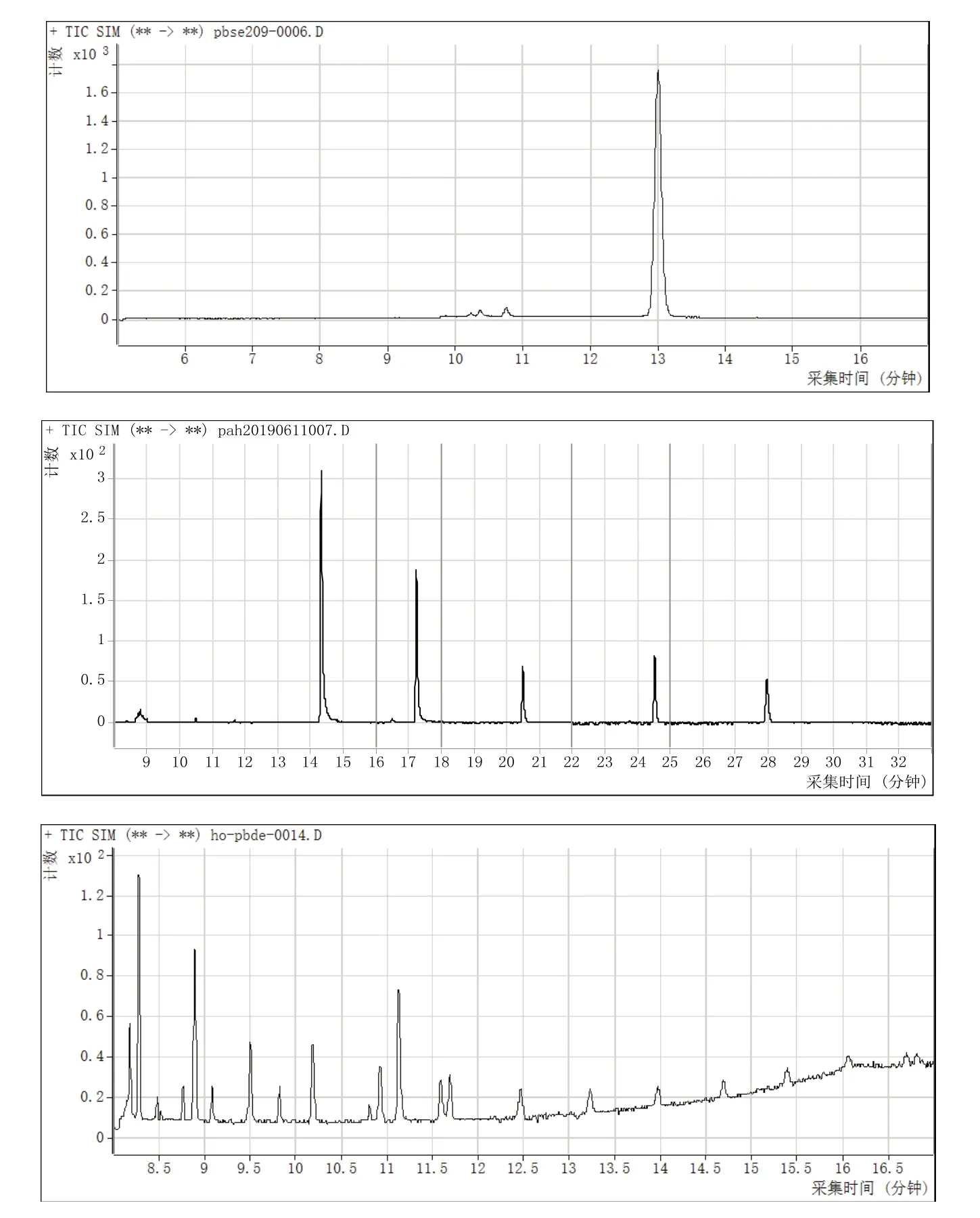
图2 八种物质的总离子流色谱图
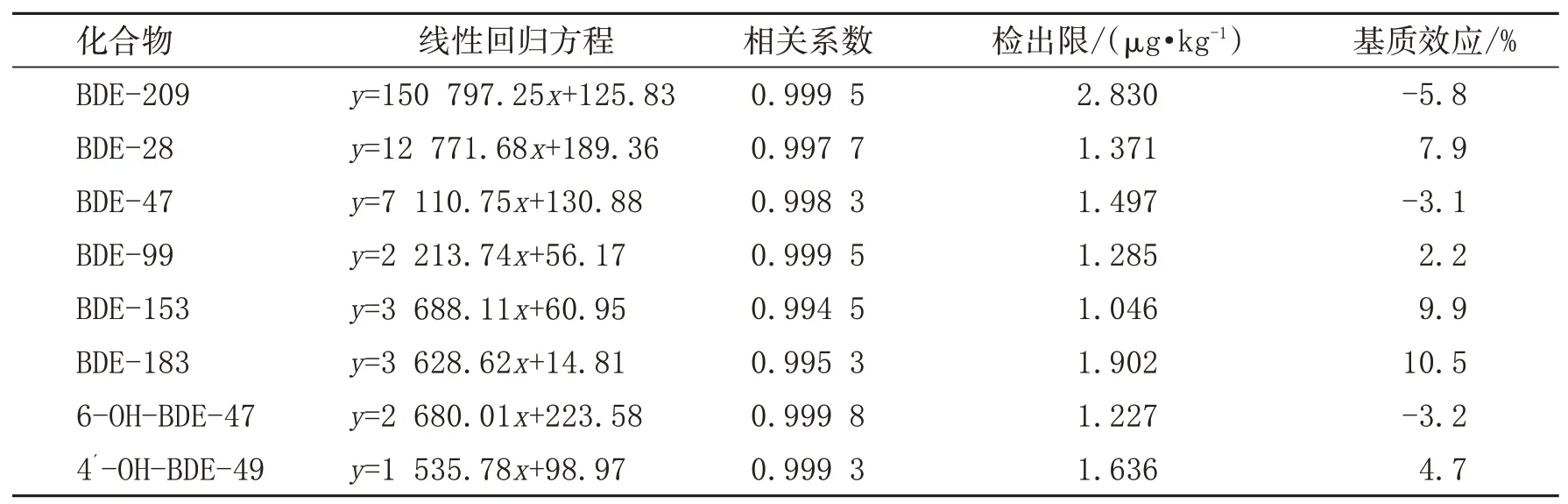
表2 六种PBDEs及2种OH-PBDEs的线性方程、相关系数、检出限和基质效应
2.4 精密度和回收试验
为了衡量该方法的准确性和精确性,设置了加标回收率试验,通过在空白基质土壤中添加已知浓度的标准物质,并进行5次平行分析,计算回收率和相对标准偏差。本研究设置了3个添加水平,分别为0.001、0.010和0.020 mg/kg,最终的回收率和相对标准偏差(RSD)结果见表3。从结果可知,在添加的3个水平,计算得到的回收率为71.7%~109.7%,RSD为0.7%~16%,符合国家标准GB/T 32465—2015《化学分析方法验证确认和内部质量控制要求》的要求。
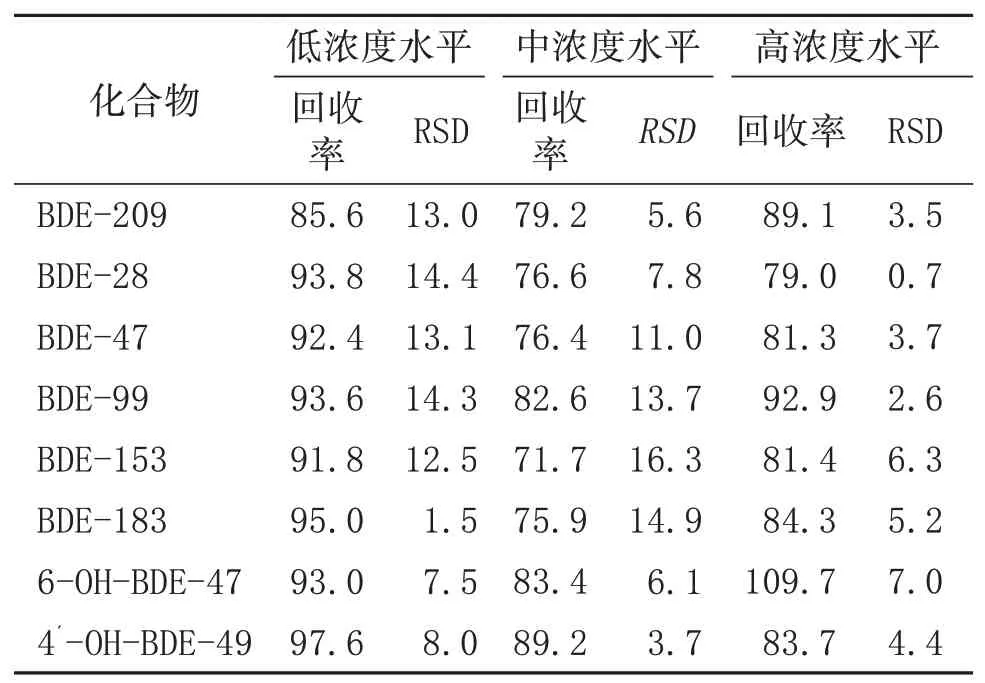
表3 土壤样品中8种化合物的添加回收率及精密度(n=5) 单位:%
2.5 实际样品分析
采用上述建立的分析方法对海南省9个土壤样品进行了检测,结果显示,该批土壤样品中BDE-209、6-OH-BDE-47、4´-OH-BDE-49有检出,检出率分别为88.9%、11.1%和11.1%,浓度分别为ND~6.7μg/kg、ND~1.0μg/kg和ND~1.5μg/kg,其余5种PBDEs均未检出,结果见表4。
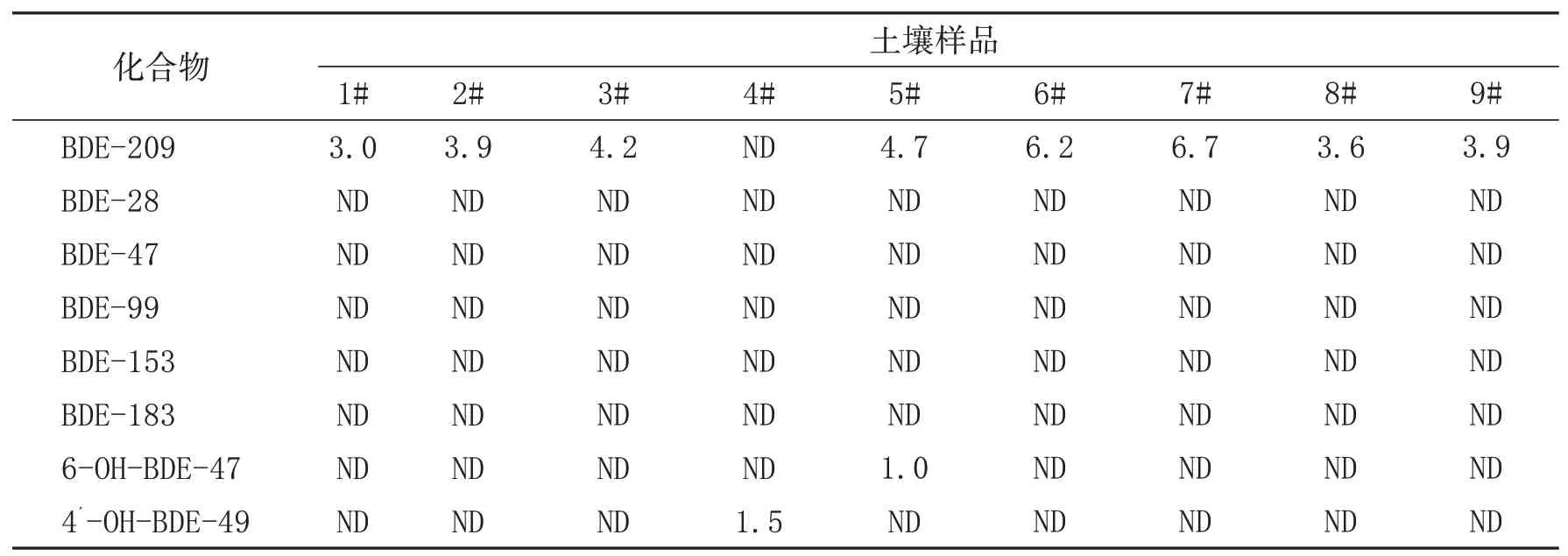
表4 土壤样品测定结果 单位:μg/kg
3 讨论与结论
土壤是各类污染物的主要归宿,柳笛等[16]测定了华北地区土壤中多溴联苯醚的污染状况,结果表明PBDEs的总浓度达到0.08~8 264.87 ng/g。娄素芳等[17]测定了广东贵屿地区土壤中多溴联苯醚的污染状况,结果表明PBDEs的总浓度达到76.5~13 354.0 ng/g。秦佩恒等[18]测定了深圳市表层土壤中多溴联苯醚的污染状况,结果表明PBDEs的总浓度达到1.1~85.8 ng/g。郝迪等[19]测定了贵屿地区不同类型农业土壤中多溴联苯醚的污染特征,结果表明贵屿镇及周边农业土壤多溴联苯醚总含量为30~9 400 ng/g。这些研究表明,我国各地土壤中存在不同水平的多溴联苯醚污染,鉴于多溴联苯醚的毒性问题和生物富集特征,开展土壤中尤其是耕地中多溴联苯醚的含量监测,对保障我国人民的生命健康安全具有积极的意义。目前我国并未建立土壤中多溴联苯醚的分析方法标准,建立一种通用且简单有效的检测标准对开展土壤中多溴联苯醚的监测具有重要意义。本研究在前人研究基础上,建立了利用超声萃取结合气相色谱-质谱测定土壤中常见6种多溴联苯醚及2种代谢物的分析方法,与已建立的土壤中PBDEs分析方法相比,王丹丹等[6]建立的方法需要微波协同萃取装置,傅海辉等[10]和付英明等[11]建立的方法需要快速溶剂萃取仪,都需要特殊的仪器设备辅助提取。金军等[7]建立的方法采用索氏提取法,不仅需要耗费大量的有机溶剂不够环保,而且耗时较长,不适合批量样品检测。魏孜等[8]建立的基质固相分散萃取方法需要将土壤样品与硅胶分散剂混合研磨,然后再装玻璃层析柱进行萃取,比较繁琐复杂。本研究建立的方法简单且不需要的特殊的仪器设备,方法的各类指标满足国家标准要求,并且实际分析了海南省农业土壤样品中多溴联苯醚的含量,适合批量分析土壤中多溴联苯醚的残留,也为土壤中多溴联苯醚分析方法标准的制定提供参考。

