一种甜瓜新症状病害的病原鉴定及其生物学特性
耿丽华 王建设 马建 杨洋 史越 宋顺华
摘 要:2018年在北京通州试验基地的一温室内发生一种甜瓜新症状病害,为了能够有效地控制该病害,采集典型发病植株进行病原菌分离纯化,测定其致病性;利用形态学特征和rDNA ITS序列分析法鉴定该病原菌种类,并测定其部分生物学特性。结果表明,该病原菌为尖孢镰刀菌甜瓜专化型Fusarium oxysporum f. sp melonis。该病原菌在查彼克培养基(Czapek)上生长最快,最适生长温度为25~30 ℃,比较适合的碳源为甘露醇、麦芽糖和葡萄糖,比较适合的氮源为酵母浸膏。该病原菌对光照不敏感,菌丝致死温度为68 ℃下10 min。通过分析病害的发生特点,推测这种病害初侵染源可能是种子携带的病原菌。
关键词:甜瓜;病害新症状;病原鉴定;尖孢镰刀菌;生物学特性
Abstract: A new symptom disease of melon(Cucumis melo L.)was observed in a greenhouses in Tongzhou , Beijing in 2018. In order to promote the study of controlling measures to the disease , the typical diseased plants were collected and the pathogen was isolated, and the pathogen was identified on its morphology and rDNA ITS sequence analysis. The biological characteristics of the pathogen growth were also studied. The results showed that the pathogen of this disease was Fusarium oxysporum f.sp melonis. The pathogen grows fastest on Czapek medium. The optimal temperature for the pathogen to grow on PDA is 25-30 ℃. The pathogen grows faster with mannitol, maltose, and glucose as carbon sources, and with yeast extract as nitrogen sources. The pathogen was insensitive to light. The mycelium lethal temperature is 68 ℃ for 10 minutes. By analyzing the characteristics of this disease , the primary infection source of the disease may come from the seeds with the pathogen.
Key words: Melon; New symptom disease; Pathogen identification; Fusarium oxysporum; Biological characteristics
甜瓜(Cucumis melo L.) 是我國重要的瓜类经济作物之一,因其口感好,营养价值高,在我国设施栽培中的面积越来越大,随之而来的是病害发生情况也越来越复杂。往往同一种病原菌侵染会产生不同发病症状,而不同病原菌导致的病害有时又会表现相似的症状,给准确识别病害带来困难,无法准确防治病害导致人力物力的浪费,同时,病情得不到有效控制又会造成减产。2018年5月,笔者发现在北京通州试验基地的一个甜瓜品种比较试验温室内发生了一种甜瓜病害。该病害发病初期先从植株上中部茎开始一侧纵裂,茎裂处有红褐色分泌物流出,茎纵裂从上往下向基部发展,严重时茎病部褐化,叶片萎蔫,植株枯死。这种病害与以往报道的瓜类蔓枯病相似,但使用针对蔓枯病的药剂不能控制该病害,最先发病的品种生长中期100%死亡。为了弄清楚该病害的病原种类,笔者采集典型发病植株进行病原菌分离纯化,采用形态学和分子生物学方法进行病原菌鉴定,测定其生物学特性,并分析其可能的传播途径,为进一步防治提供理论依据。
1 材料与方法
1.1 材料
供试病样:2018年5月从北京通州试验基地温室采集具有典型发病症状的甜瓜地上部植株。
试剂及仪器:真菌基因组DNA快速抽提试剂盒、高纯度的dNTP、Taq DNA扩增酶、10×Buffer、DNA Marker Ⅱ、引物及其缓冲液(北京新时代众合科技有限公司);其他无机试剂均为国产分析纯试剂。PRX-450D-30恒温光照培养箱(浙江联合赛福实验仪器科技有限公司);MJ-150 F-1霉菌培养箱(上海一恒科学仪器有限公司);C1000 PCR仪(美国 BIO-RAD 公司);DYY-6C电泳仪(北京六一仪器厂);Olympus BX51显微镜(日本奥林巴斯公司)。
培养基:马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):马铃薯200 g、琼脂17 g、葡萄糖20 g、蒸馏水1000 mL;康乃馨水琼脂培养基(carnation leaf agar,CLA):琼脂20 g,蒸馏水1 L,每个9 cm直径的培养基平板上加入大小约为4 mm2的康乃馨叶片6~8块;查彼克培养基(Czapek):KNO3 2 g、K2HPO4 1 g、KCl 0.5 g、MgSO4·7H2O 0.5 g、FeSO4 0.01 g、蔗糖30 g、琼脂17 g、蒸馏水1000 mL;燕麦片琼脂培养基(oat meal agar,OA):燕麦片30 g、琼脂30 g、蒸馏水1000 mL;玉米粉琼脂培养基(corn meal agar,CMA):玉米粉300 g、琼脂 17 g、蒸馏水1000 mL;马铃薯蔗糖琼脂培养基(potato sucrose agar,PSA):马铃薯200 g、蔗糖20 g、琼脂20 g、蒸馏水1000 mL,所有培养基使用之前均于120 ℃高压灭菌20 min备用。
1.2 方法
1.2.1 病原菌分离纯化 采用常规组织分离法[1]。从典型发病植株的病健交界处取小块组织,在75%乙醇溶液中浸泡2~3 s,然后用灭菌水冲洗3次,用灭菌滤纸吸干水分,放在PDA平板上25 ℃恒温培养2~3 d,将分离菌株单孢纯化后转入PDA培养基保存备用。
1.2.2 分离物致病性测定 采用柯赫氏法则对分离菌株进行致病性验证。分别取成株期的甜瓜、西瓜和南瓜健康植株茎段及叶柄进行表面消毒,将接种点设在茎段及叶柄的中间部位,用灭菌的解剖刀在拟接种部位切下表皮层约5 mm×5 mm的面积,然后接种直径为5 mm的菌饼,以不接种菌饼的茎段及叶柄作为对照,摆放在灭菌的搪瓷盘内,加保鲜膜覆盖保湿,放入25 ℃的光照培养箱中,观察发病情况。
1.2.3 病原菌的鉴定 形态学鉴定:将纯化的病原菌接种到PDA平板上,25 ℃暗培养,观察菌落形态并测量其7 d的生长速率;将病原菌接种到在CLA培养基上,25 ℃暗培养,观察大型分生孢子和小型分生孢子,在100倍倒置显微镜下直接观察小型分生孢子的产生方式并拍照。然后,依据Leslie & Summerell[2]相关分类方法进行种类鉴定。
分子生物学鉴定:将病原菌接种到PDA平板上,在25 ℃黑暗条件下培养5 d,收集菌丝体,加液氮研磨成粉末,用真菌基因组提取试剂盒提取其DNA。用真菌通用引物 ITS1(5′- TCCGTAGGTGAACCTGCGG-3′)和 ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[3]对病原菌rDNA的核糖体内转录间隔区(internal transcribed spacer,ITS)进行PCR扩增。反应体系及扩增方法参照耿丽华等[4]的方法进行。扩增片段由北京新时代众合科技有限公司进行测序,将得到的序列在NCBI中检索同源性序列,采用MEGA 7.0软件用邻接法(Neighbor-Joining)构建系统发育树,并用自举法(Bootstrap)对发育树进行1000次重复检验。
1.2.4 病原菌生物学特性测定 在病原菌生物学特性测定中,使用培养7 d的病原菌菌落,用5 mm打孔器在培养7 d的菌落边缘打取菌饼,将其置于不同处理试验的培养基平板中央,除光照對病原菌生长的影响试验外,均在25 ℃条件下暗培养。每个处理1个平板,5次重复。
不同培养基对病原菌生长的影响:设PDA、PSA、Czapek、OA和CMA共5种培养基处理。不同培养基培养菌饼5 d后用十字交叉法测量菌落直径。
温度对病原菌生长的影响:将放置菌饼的PDA平板分放在5、10、15、20、25、28、30、35 ℃条件下暗培养。7 d后用十字交叉法测量菌落直径。
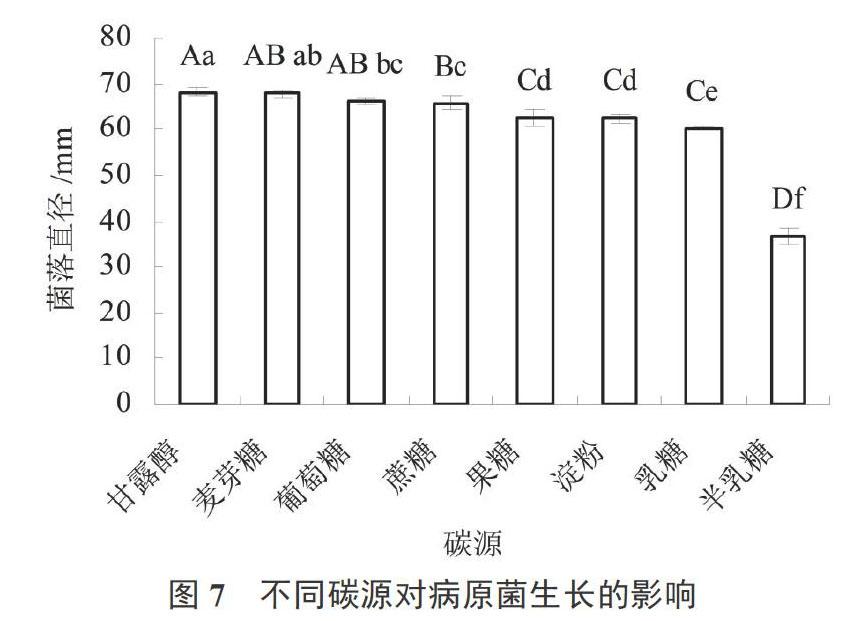
不同碳源对病原菌生长的影响:以Czapek为基础,分别用等量的乳糖(C12H22O11)、麦芽糖(C12H22O11·H2O)、淀粉(C6H10O5)n、葡萄糖(C6H12O6)、半乳糖(C6H12O6)、甘露醇(C6H14O6)和果糖(C6H12O6)代替Czapek中30 g蔗糖(C12H22O11),配制成不同碳源的培养基。不同碳源培养基培养菌饼5 d后用十字交叉法测量菌落直径。
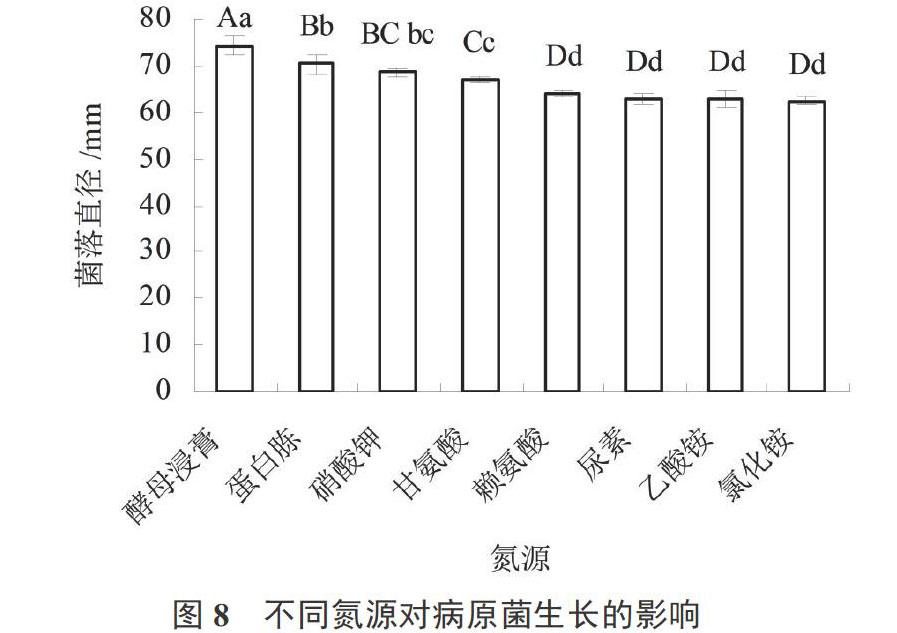
不同氮源对病原菌生长的影响:以Czapek为基础,分别用等量的尿素(CH4N2O)、蛋白胨、氯化铵(NH4Cl)、酵母浸膏、乙酸铵(CH3COONH4)、赖氨酸(C6H14N2O2)以及甘氨酸(C2H5NO2)代替Czapek中2 g KNO3,配制成不同氮源的培养基。不同氮源培养基培养菌饼5 d后用十字交叉法测量菌落直径。
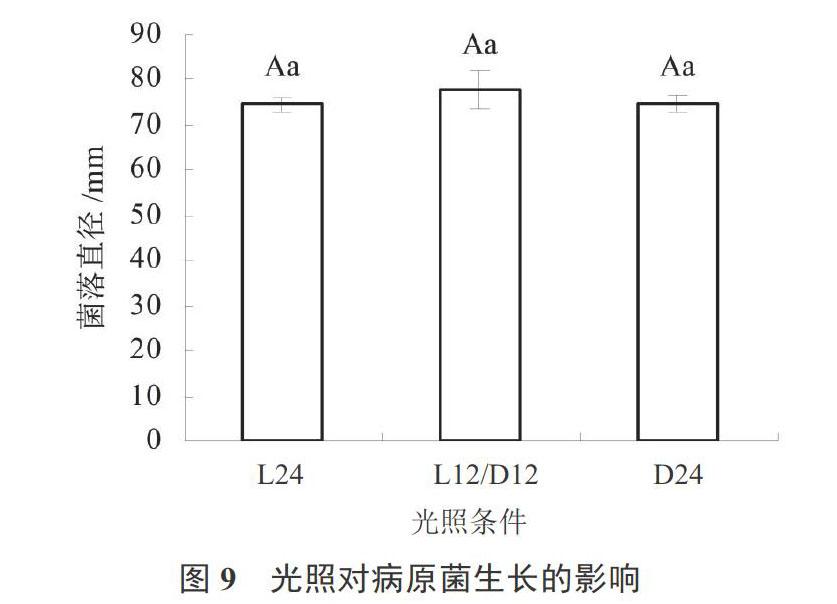
光照对病原菌生长的影响:光源为普通日光灯(28 W,距离30 cm),设连续光照24 h(L24)、连续黑暗(D24)和12 h光暗交替(L12/D12)3个处理。将放置菌饼的PDA平板在不同光照条件下培养7 d后用十字交叉法测量菌落直径。
菌丝致死温度测定:将10个病原菌菌饼放入灭菌试管中,将试管分别放入40、45、50、55、60、65、70 ℃的水浴锅中处理10 min,冷却降温后每处理随机取出5个菌饼,分别转接到PDA平板培养基上,培养7 d后观察菌落生长情况。确定致死温度范围后,再在此范围内进一步设置浓度梯度试验,以确定致死温度。
1.3 数据分析
将生物学特性数据录入Excel表格,分析各处理的标准差,采用SPSS 13.0单向方差分析模型(one-way ANOVA model)检验平均数差异显著性(Student- Newman-Keuls)。
2 结果与分析
2.1 症状观察与病原菌分离纯化
由图1可以看出,病害的初始症状为发病植株上、中部茎出现侧裂,仔细观察可见纵裂处有红褐色颗粒状物,有的从纵裂处流出红褐色分泌物,顺茎蔓滴落;然后茎蔓纵裂向茎基部扩展,湿度大时纵裂处长出白色菌层;切开发病植株的茎部可见病部褐化;当叶片表现萎蔫时挖出根部,发现根系生长正常、没有任何病变。
取茎部病健交接处,按常规方法进行病原菌分离,挑取单孢进行纯化。先后几次取样分离,均长出唯一一种真菌,分离得到一种分离物,定名为TGT180522-1。
2.2 分离物致病性测定
由图2可以看出,甜瓜茎段和叶柄接种致病菌后2 d,明显可见接种的茎段及叶柄上菌丝生长,5 d时,接种的茎段及叶柄上菌丝快速增长、茎段及叶柄出现褐化,8 d时,接种的茎段及叶柄几乎完全褐化,而对照仍然保持完好,与田间自然发病症状一致。从发病的部位进行再分离和纯化,所得菌株与所测定的分离物在培养性状和形态特征上相同,因而确定该分离物是病原菌。
西瓜和南瓜茎段上接种该病原菌后8 d,接种的西瓜、南瓜茎段上没有菌丝生长,与对照一样仍然保持完好。说明该病原菌能侵染甜瓜,不能侵染西瓜和南瓜。

