外源添加麝香草酚提高烟草幼苗抵御盐胁迫机理的研究
宋佳倩,徐亮,王悦霖,叶协锋,钟钏,李均,钟子正,姚鹏伟,王静*,卢剑
1 河南农业大学烟草学院,国家烟草栽培生理生化研究基地,烟草行业烟草栽培重点实验室,郑州市金水区文化路95号 450002;
2 四川省凉山州会东县烟草公司,凉山彝族自治州会东县金叶街66号 615200;
3 四川省凉山州烟草公司西昌市公司,凉山彝族自治州西昌市三岔口东路368号 615000
近年来,由于农业生产中的不合理灌溉、过量施用化肥等因素,土壤次生盐渍化问题愈发严重[1],农业生产与可利用耕地间的矛盾日益加剧,特别是在沿海地区以及干旱和半干旱地区,土壤盐渍化成为限制农业发展的一个重要因素[1-2]。有研究表明,植烟土壤盐分离子表聚现象严重,出现不同程度的盐渍化,极个别地区的土壤甚至属于中度盐渍化[3-4]。土壤中盐分含量过高严重影响植物生长,引起盐胁迫。盐胁迫能够抑制植物生长发育,最直观的表现为抑制种子萌发[5],抑制根和茎的生长[6-7],降低光合速率[8],减少生物量[9]等。
植物根系的发育具有高度可塑性,这使得植物能够更好的适应各种环境胁迫。根系作为吸收水分和营养物质的器官,最先感知到逆境胁迫信号[10]。盐胁迫通过抑制根的伸长[11-12]、根活[13]、根毛发育[14]等影响根系的生长。当植物受到盐胁迫时,植株吸水困难,从而导致生理性干旱;植物从土壤中吸收过多的Na+,从而产生离子毒害,打破植株的离子平衡,影响植物对必需矿质元素的吸收;盐胁迫导致植物积累大量的活性氧,其产生的氧化胁迫还会破坏质膜结构,抑制蛋白合成,促进叶绿体的分解,严重的可导致植株死亡[15-17]。为避免高盐环境造成的伤害,植物利用抗氧化酶清除系统来缓解氧化胁迫,超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)[18]是酶促抗氧化系统的主要酶类,SOD将超氧阴离子歧化成过氧化氢,POD和CAT将过氧化氢分解为水。
通过外源化学物质调控来减轻盐胁迫对植物的伤害,增强植物的耐盐性,是缓解盐胁迫的一种重要方式。麝香草酚(5-甲基-2-异丙基苯酚)是从麝香草中提取出来的精油中的重要成分[19],具有消炎、杀菌、抗氧化等特性,在医药领域被广泛使用[20]。作为一种新型天然植物源化合物,已有研究表明麝香草酚在调控植物逆境胁迫方面具有一定的功效,Cheng[21]等研究证实麝香草酚通过激活抗氧化防御和调节Na+在水稻根中的动态平衡来提高对盐胁迫的耐受性;Ye等[22]研究发现麝香草酚处理可阻断镉诱导的活性氧的过度生成、脂质过氧化和膜完整性的丧失,减轻镉对烟草幼苗生长的抑制作用;麝香草酚对西瓜枯萎病[23]、禾谷镰孢菌[24]等同样具有良好的防效,但对其调控逆境胁迫机理的深入研究却鲜有报道。
非损伤微测技术(Non-invasive Micro-test Technology,NMT)能够以近似生理条件的液体环境原位检测进出活体样品离子、分子流速,对样品组织或细胞内部生理活动不会造成任何干扰和破坏[25],近年来常被用于植物体生命活动规律以及植物与环境间的互作关系研究。本研究通过化学染色法和非损伤微测法,对烟草根尖进行细胞学和钠钾离子流速的测定,并结合烟草幼苗根长、活性氧含量、抗氧化酶含量等生理指标,探究麝香草酚缓解烟草幼苗盐胁迫的机理,以期为提高植物耐盐性研究以及盐碱土壤改良提供理论基础。
1 材料与方法
1.1 试验设计
供试烟草品种为K326。试验设置4个处理:正常的MS培养基为对照(CK);处理一:MS培养基+150 mmol/L NaCl(S);处理二:MS培养基+50 μmol/L麝香草酚(T);处理三:MS培养基+150 mmol/L NaCl+50 μmol/L麝香草酚(ST)。钠钾离子流速测定采用同样的处理,MS培养基用霍格兰营养液替换。每个处理均设置三次生物学重复。
1.2 试验方法
1.2.1 材料培养种子消毒与培养方法参照王悦霖等[5]。培养6~7 d时选取长势一致的幼苗进行处理。
1.2.2 根长的测定分别于处理12 h、24 h、36 h、48 h、60 h、72 h后测量幼苗根长增长量并拍照。
1.2.3 选取培养基上培养7 d的幼苗,加处理72 h后,每个处理各取10株幼苗测定SOD、POD和CAT活性,MDA、H2O2含量等指标,测定均采用苏州科铭生物技术有限公司的试剂盒,试验方法参照试剂盒说明书。
1.2.4 根尖细胞死亡染色
根尖的细胞死亡染色参考Duan[26]的方法,选用特异性染料台盼蓝,它能够穿透破损的细胞膜将死亡细胞染成蓝色,而不能对健康活细胞进行染色。将处理72 h的幼苗转移到台盼蓝(Trypan blue)溶液中培养20 min(25℃,光照)。用去离子水洗去浮色,在体视显微镜下对根尖进行观察并拍照。
1.2.5 钠钾离子流速测定
将种子播于蒸馏水浸湿的滤纸上,置于光照培养箱(温度25℃,光/暗16 h/8 h,光照强度4950 Lx,相对湿度60%),培养7 d后选取长势一致的幼苗转移到1/2霍格兰营养液中,2 d后换正常的霍格兰营养液,之后每隔两天更换一次营养液。培养至30 d,用于钠钾离子流速测定。
在处理12 h后取根系顶端幼嫩部位,叶片撕掉表皮,露出叶肉位置,固定于灭菌的小培养皿中,加入离子流速基本测试液,根系平衡30 min,叶片平衡6 h,电极运动一次间距为30 μm,运动频率为0.3~0.5 Hz,每个处理6次重复。采用非损伤微测系统进行钠钾离子流速测定,利用ASET2.10软件进行数据显示、图像获取、数据的预处理、电极三维位置调试和显微镜精细聚焦等操作。
1.3 数据分析
采用Excel 2003和DPS 7.05软件进行数据处理和显著性分析,P<0.05表示差异显著;数据采用GraphPad Prism v 8.3软件绘图。
2 结果与分析
2.1 外源添加麝香草酚对盐胁迫下烟草根长的影响
根系作为吸收水分和营养物质的重要器官,最先感知到逆境胁迫信号[27],因此,根长常被用来评估植物根的生长状况。结果表明,T处理的根长增长量在处理48 h后显著低于对照处理,但仍然显著高于S处理,S处理各处理时间段烟草幼苗的根长增长量均显著低于对照(图1),其中处理72 h的根长增长量与CK相比下降了60.89%,而ST处理的根长增长量均高于S处理,且均达到了显著水平(图2)。表明添加麝香草酚缓解了盐胁迫对幼苗根系的生长抑制。
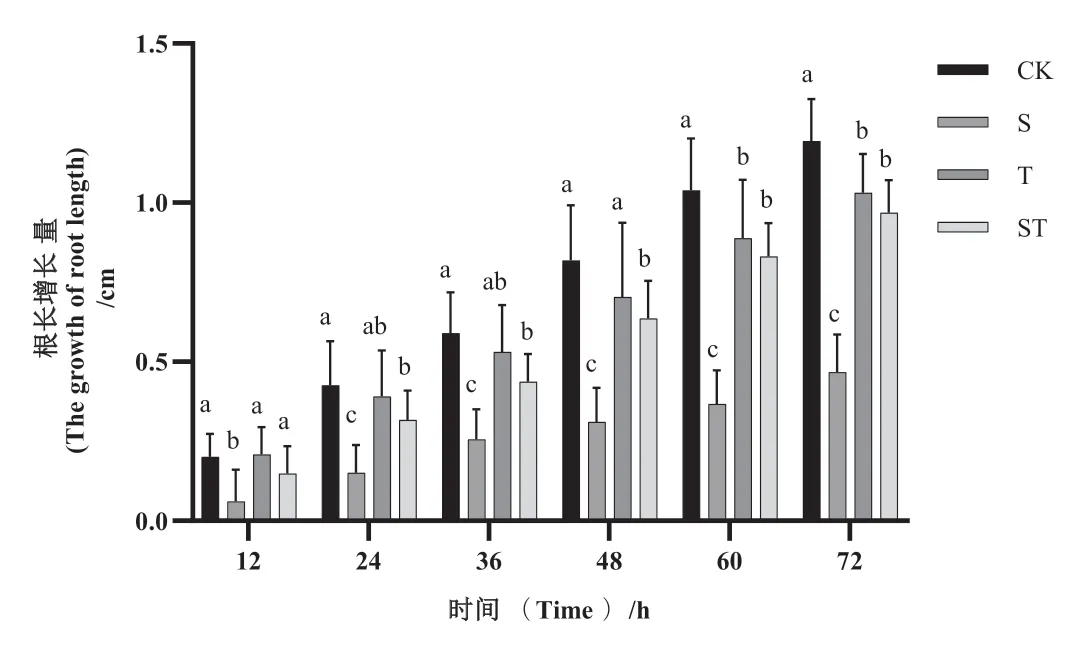
图1 外源添加麝香草酚对烟草幼苗根长增长量的影响Fig.1 Effect of exogenous thymol on root length growth of tobacco seedlings

图2 外源添加麝香草酚对盐胁迫下烟草幼苗根生长的影响(处理72 h)Fig.2 Effect of exogenous thymol on root growth of tobacco seedlings under salinity stress (treated for 72 h)
2.2 外源添加麝香草酚对盐胁迫下烟草MDA与H2O2含量以及抗氧化酶活性的影响
盐胁迫会造成植物体内活性氧含量升高,对细胞膜系统造成损伤[28]。本研究结果显示,处理72 h后,S处理与CK相比H2O2含量升高了136.91%、MDA含量增加了37.74%,均达到显著水平,ST处理的MDA含量与对照无显著差异,而H2O2含量则显著高于对照,但总体来说,ST处理的MDA和H2O2含量均显著低于S处理(图3)。从图4可以看出,处理72 h后,与CK相比盐胁迫显著提高了SOD、POD、CAT的活性,分别提高了47.47%、93.23%、238.60%。ST处理抗氧化酶活性也显著升高,但没有S处理增加的多,分别提高了15.84%、25.26%和41.49%。表明添加麝香草酚缓解了盐胁迫造成的H2O2积累和膜脂过氧化损伤。

图3 外源添加麝香草酚对盐胁迫下烟草H2O2和MDA含量的影响Fig.3 Effects of exogenous thymol on the contents of H2O2 and MDA in tobacco under salinity stress

图4 外源添加麝香草酚对盐胁迫下烟草SOD、POD、CAT活性的影响Fig. 4 Effect of exogenous thymol on activity of SOD, POD and CAT activities of tobacco under salinity stress
2.3 外源添加麝香草酚对盐胁迫下烟草根尖细胞死亡的影响
如图5所示,对照条件下的烟草幼苗根尖被轻微染色,说明根在正常的生长发育过程中存在自然的细胞死亡代谢过程;S处理72 h后,根尖染色明显加重,说明盐胁迫导致了根尖细胞死亡加剧;而ST处理细胞死亡现象得到明显缓解;T处理对根尖细胞死亡无显著影响。

图5 不同处理烟草幼苗根尖细胞的染色情况Fig. 5 Staining of root tip cells of tobacco seedlings under different treatments
2.4 外源添加麝香草酚对盐胁迫下Na+、K+流速的影响
细胞内钠钾平衡对植物的耐盐性起关键作用[29]。如图6所示,处理12 h后,在霍格兰营养液培养条件下,烟草根系表现为Na+吸收,S处理Na+吸收净流量显著增加,而ST处理与T处理的Na+流速均表现为外排,且ST处理的Na+外排净通量显著大于T处理,表明麝香草酚能够促进Na+外排,缓解盐胁迫造成的Na+内流。对同一烟株叶片中Na+流速的检测发现,正常霍格兰营养液培养条件下表现为Na+吸收,其他三个处理均表现为外排,且ST处理Na+的外排显著低于S处理。这可能是由于单独盐胁迫处理根系Na+吸收增多,运输到地上部后排出,故盐胁迫下地上部Na+外排增加,而盐胁迫与麝香草酚处理地上部Na+外排量较小。

图6 外源添加麝香草酚对盐胁迫下烟草Na+流速的影响Fig. 6 Effect of exogenous thymol on Na+ flow rate of tobacco under salinity stress
由图7可知,CK处理与T处理的烟草根系K+流速均为轻度外排,ST处理的K+外排净流量明显低于S处理;叶片中CK处理与T处理的K+为吸收,盐胁迫处理以及盐胁迫与麝香草酚混合处理后的K+为外排,且盐胁迫处理的K+外排净流量明显高于盐胁迫与麝香草酚混合处理,表明麝香草酚的添加缓解了盐胁迫造成的K+流失。

图7 外源添加麝香草酚对盐胁迫下烟草K+流速的影响Fig.7 Effect of exogenous thymol on K+ flow rate of tobacco under salinity stress
3 讨论
本研究结果显示,盐胁迫导致了大量活性氧累积,诱发了根尖细胞死亡,而麝香草酚的添加能够通过提升烟草幼苗的抗氧化能力,缓解盐胁迫引发的根长抑制和细胞死亡效应。此外,盐胁迫处理下SOD、POD和CAT的活性显著升高,这与付晴晴等[30]的研究结果一致,表明活性氧的过量积累激活了烟草的抗氧化系统,麝香草酚与NaCl共处理的SOD、POD和CAT活性要低于单独NaCl处理,推测可能是由于麝香草酚与NaCl共处理诱导产生的活性氧水平低于单独NaCl处理。抗氧化酶活性测定的结果表明,盐胁迫下麝香草酚的添加没有刺激烟草幼苗SOD、POD和CAT的活性的进一步升高,表明麝香草酚对烟草盐胁迫的缓解作用不是通过提高抗氧化酶系统来完成,而是通过抑制活性氧的产生实现的,这与叶协锋等[22]的研究一致。
当面对高盐胁迫时,植物体内做出相应的调整以提高自身的生存能力。有研究表明植物在高盐环境下,胞质中大量积累的Na+会打破原有的Na+/K+平衡,降低植物维持细胞内外离子平衡的能力,进而阻碍其他离子的吸收,最终影响植物的代谢[31]。Deinlein等研究表明,植物可以通过排除Na+和分隔Na+来解除过量的Na+胁迫[32]。本研究发现,盐胁迫处理12 h后根系吸收大量的Na+,而盐和麝香草酚混合处理后Na+从吸收转为外排;添加麝香草酚处理条件下,根系Na+流速表现为外排,表明添加麝香草酚能够缓解根系因吸收过多的Na+而产生的离子毒害,从而缓解盐胁迫。相反地,盐胁迫下叶片的Na+外排,表明根系吸收的Na+通过中柱鞘运输到地上部后,通过质膜排出胞外,NaCl与麝香草酚共处理的Na+外排低于盐胁迫处理。推测麝香草酚的添加使根系吸收更少的Na+,使得烟株并没有通过根系吸收过多的Na+,因此地上部的Na+外排较盐胁迫处理减弱。此外,盐胁迫初期产生的活性氧能够激活质膜非选择性阳离子通道,造成K+的流失[33-36]。本研究发现,盐胁迫处理的根系K+流速为明显的外排,添加麝香草酚后K+的外排量明显降低,表明麝香草酚能够在一定程度下缓解盐胁迫造成的K+流失,但不能恢复至对照水平,这对于盐胁迫下植物的生长仍然是有益的。
4 结论
盐胁迫容易导致烟草幼苗根系大量活性氧累积,并诱发根尖细胞死亡。麝香草酚能够通过提升烟草幼苗的抗氧化能力,缓解盐胁迫引发的根长抑制和细胞死亡效应;另一方面麝香草酚可以降低盐胁迫造成的Na+吸收和K+外排,从而维持细胞内钠钾平衡,对植株的耐盐性具有积极的作用。

