长链非编码RNA AFAP1-AS1在癌症中作用及其机制的研究进展
李志明,龙 凤,2,何建新,黄 勇,2,孙少康
1.甘肃中医药大学,甘肃 兰州 730000;2.甘肃省高校重大疾病分子医学与中医药防治研究省级重点实验室,甘肃 兰州 730000
癌症作为严重威胁人类健康的恶性疾病,一直以来是全球非感染性疾病死亡的主要原因之一。根据有关癌症统计数据的最新研究报告显示,2020年美国预计将发生1 806 590例新发癌症病例和606 520癌症死亡病例[1]。随着基因组学、分子生物学等基础学科的发展,癌症的发生、发展相关的分子机制被广泛研究,越来越多的证据表明,长链非编码RNA(long non-coding RNA,lncRNA)是一系列生物行为和疾病的主要调节因子[2]。lncRNA功能失调被认为是导致多种疾病发生的主要因素之一,这些疾病包括癌症、心血管疾病、纤维化、肥胖等[3]。
在人类基因组中,大约93%的DNA可以转录成RNA,其中只有2%是编码蛋白质的mRNA,其余的98%是不编码蛋白的非编码RNA,而在这些非编码RNA中,超过200个碱基的RNA被归类为lncRNA[4]。虽然lncRNA几乎不编码蛋白质,但它们可以通过RNA干扰、基因共抑制、基因沉默、基因印记和DNA去甲基化等机制调控基因表达,参与各种分子生物学过程[5]。lncRNA的分类目前尚无明确统一标准,通常根据其相对于相邻蛋白编码基因的位置将其基本分类为:有义链lncRNA、反义链lncRNA、内含子区lncRNA、双向lncRNA、长基因间非编码RNA和增强子相关lncRNA。另有学者根据lncRNA的作用将其大致分为4类:信号分子、支架分子、引导分子和诱饵分子[6]。作为信号分子,lncRNA参与信号通路的转导,调控下游靶基因的表达;lncRNA作为支架分子,可作为蛋白质的结构组分与多种蛋白结合形成稳定的核酸蛋白复合物,介导染色质组蛋白修饰;lncRNA作为引导分子,可以招募染色质修饰相关酶来调控靶基因;lncRNA作为诱饵分子,通过与miRNA的结合(miRNA海绵)招募相关蛋白质或转录因子来调控靶基因的表达。lncRNA的表达异常已被证明与多种癌症的发生、发展有关[7]。例如,lncRNA淋巴结转移相关转录本1(lymph node metastasis associated transcript 1,LNMAT1)通过将核不均一核糖核蛋白L(heterogeneous nuclear ribonucleoprotein L,hnRNPL)募集到C-C趋化因子配体2(C-C motif chemokine ligand 2,CCL2)启动子,激活CCL2表达促进膀胱癌淋巴管生成和淋巴转 移[8];lncRNA SPRY4-IT1通过海绵miR-101-3p上调zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)促进膀胱癌细胞增殖和转 移[9]。肌动蛋白丝相关蛋白1-反义RNA1(actin filament-associated protein 1 antisense RNA 1,AFAP1-AS1)最初于2013年在食管腺癌中被发现,过去近十年的研究表明,作为重要的致癌lncRNA,AFAP1-AS1在多种癌症中均表达上调,可促进多种癌症的不同进程。AFAP1-AS1在人类癌症中的高表达与不良的临床结果(如淋巴结转移和远处转移)也密切相关。因此,解读该lncRNA在癌症中的功能和作用机制可以进一步帮助临床工作者寻找预防或治疗恶性肿瘤的新策略。
1 AFAP1-AS1简述
AFAP1-AS1位于人类4号染色体的4p16.1区域,是肌动蛋白丝相关蛋白1(actin filamentassociated protein 1,AFAP1)基因的反义链转录而来的一种反义lncRNA,全长共6 810个碱基,存在两个转录本(从Ensembl数据库中提取),包括ENST00000608442.2、ENST00000674004.1。AFAP1编码运动纤维相关蛋白,属于AFAP1、AFAP1like-1和AFAP1 like-2/xB-130家族成员[10-11]。AFAP1-AS1外显子2与蛋白质编码基因AFAP1的外显子14、15和16重 叠[12](图1)。lncRNA AFAP1-AS1在恶性肿瘤细胞的细胞质及细胞核中均有表达。近年来研究发现,在多数细胞系如胃癌BGC-823和SGC7901细胞[13]、黑色素瘤A375和M21细胞[14]、肺癌PC9和H1975细胞[15]以及三阴性乳腺癌BT-549和MDA-MB-231细胞[16]中,AFAP1-AS1主要定位于细胞质中,且基于lncLocator数据库对AFAP1-AS1基因进行序列分析[17],得出AFAP1-AS1主要定位于细胞质(表1)。越来越多的证据表明,AFAP1-AS1作为一种反义lncRNA在多种人类癌症中表达上调,如胰腺癌[18]、肺癌[19]、食管癌[20]、乳腺癌[21]、宫颈癌[22]等。此外,AFAP1-AS1在这些癌症中参与调控癌细胞的增殖、凋亡、迁移和侵袭等多种生物学过程(表2)。而AFAP1-AS1在各种生物学过程中的功能主要是通过与miRNA竞争结合或通过复杂的机制与蛋白质(包括在细胞增殖、迁移、侵袭和凋亡中具有活性的蛋白质)相互作用而赋予的。
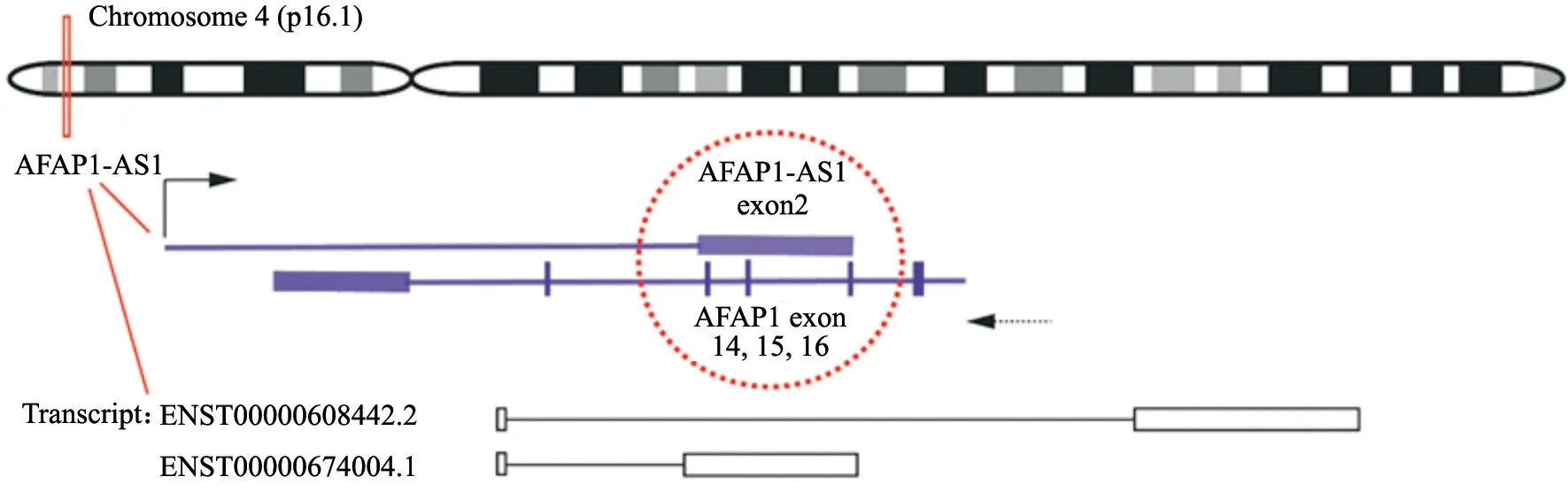
图1 AFAP1-AS1位于染色体4p16.1上,存在两个转录本ENST00000608442.2和ENST00000674004.1Fig.1 AFAP1-AS1 was located on chromosome 4p16.1,ENST00000608442.2 and ENST00000674004.1 were two AFAP1-AS1 transcripts
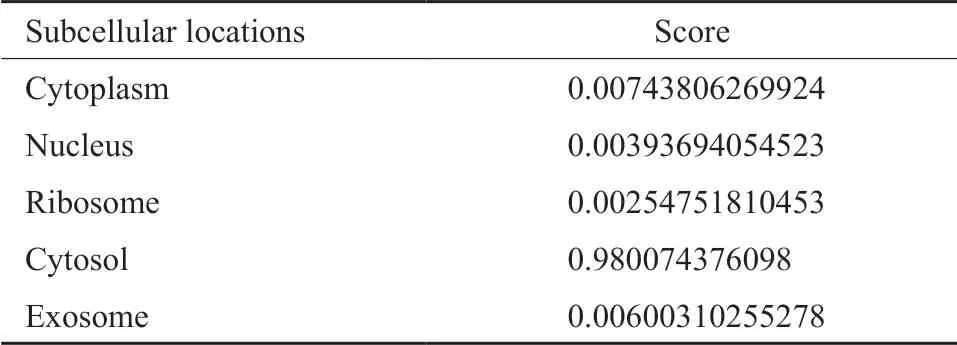
表1 AFAP1-AS1的亚细胞定位分析(来自lnclocator数据库,数据库网站:www.csbio.sjtu.edu.cn/bioinfo/lnclocator)Tab.1 Analysis of the subcellular localization of AFAP1-AS1 (from lnclocator database:www.csbio.sjtu.edu.cn/bioinfo/lnclocator)
2 AFAP1-AS1在人类癌症中的作用机制
癌症的发生、发展是一个复杂的生物学过程,包括维持细胞增殖、抵抗细胞死亡、诱导血管生成、激活侵袭和转移、逃避免疫破坏和增加化疗耐药性[52]。AFAP1-AS1作为一种lncRNA,于2013年首次在食管腺癌中被发现。它与肿瘤细胞的增殖、凋亡、细胞周期、迁移、侵袭和化疗耐药密切相关。
2.1 作为一种竞争性内源RNA
竞争性内源RNA(competing endogenous RNA,ceRNA)在癌症的病理生理学中发挥着越来越重要的作用[53]。微小RNA(microRNA,miRNA)是ceRNA网络中的一个重要调节因子,它通过与mRNA 3’UTR中的靶位点相互作用,导致其腺苷酸化,降低mRNA的稳定性和翻译抑制,负调控基因的表达[54]。AFAP1-AS1是一种非常重要的ceRNA,其在体内起着miRNA海绵的作用见图2。在胰腺癌细胞中发现AFAP1-AS1高表达,而AFAP1-AS1的敲除可以通过减弱与miR-384的竞争结合能力,下调激活素A受体1型(activin A receptor type 1,ACVR1)的表达,从而抑制胰腺癌细胞的增殖、侵袭、迁移和干性,最终抑制肿瘤的发 生[18]。miR-133a已被证明是包括胰腺癌在内的多种人体肿瘤的抑癌因子[55-58],新的证据表明,AFAP1-AS可通过海绵miR-133a在胰腺癌细胞中功能性地释放miR-133a靶向胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF1R)癌基因的mRNA转录产 物[23]。miR-103a-3p被报道在多种恶性肿瘤组织细胞中作为抑癌基因发挥作用,比如miR-103a-3p在神经胶质瘤组织和神经胶质瘤干细胞中低表达,过表达miR-103a-3p可显著抑制神经胶质瘤干细胞的增殖、迁移和侵袭,并促进其凋 亡[59];在胃癌和膀胱癌中miR-103a-3p的表达受到抑制[60-61]。同样,在垂体腺瘤中miR-103a-3p被证实充当了抑癌基因的角色,而AFAP1-AS1通过使miR-103a-3p海绵化以激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/AKT)信号通路来促进垂体腺瘤细胞的增殖[47]。在三阴性乳腺癌细胞中,过表达miR-145可抑制活化转录因子6(activating transcription factor 6,ATF6)的表达从而增加AFAP1-AS1的启动子的活性,过表达AFAP1-AS1则可通过靶向抑制miR-145上调MutT同源蛋白1(MutT homolog 1,MTH1)的表达,促进三阴性乳腺癌细胞的增殖和侵 袭[21]。在肺癌的研究中发现,肺癌细胞中高表达的AFAP1-AS1可通过使miR-139-5p海绵化而上调核糖核苷酸还原酶M2(ribonucleotide reductase,RRM2),通过上调RRM2的表达促进非小细胞肺癌细胞的增殖和增强化疗耐药 性[36]。AFAP1-AS1在胃癌组织和细胞系中表达上调,与胃癌患者预后不良密切相关。在功能上,AFAP1-AS1与miR-155-5p直接相互作用,并充当miR-155-5p的竞争性海绵上调成纤维细胞生长因子7(fibroblast growth factor 7,FGF7)的表达,促进胃癌细胞增殖、迁移和侵袭[13]。AFAP1-AS1的沉默可导致黑色素瘤细胞的增殖、迁移、侵袭减少,间充质标志物表达降低以及上皮标志物重新表达。具体而言,AFAP1-AS1与miR-653-5p竞争结合,下调视黄酸诱导14基因(retinoic acid-induced 14,RAI14)的表达,而miR-653-5p过表达或RAI14的敲低可抑制肿瘤生长和上皮-间质转化(epithelial-mesenchymal transition,EMT)表 型[14]。Lian等[62]报道AFAP1-AS1在鼻咽癌组织中高表达,与鼻咽癌患者的临床TNM分期、颈部淋巴结转移密切相关,与之相反,miR-423-5p在鼻咽癌中低表达。Rho/Rac1信号通路分子RAB11B和LASP1为miR-423-5p的靶基因,FOS样抗原2(Fos-related antigen 2,FOSL2)是激活蛋白-1(activator protein-1,AP-1)转录因子复合物的成员,通过与LIM和SH3结构域蛋白1(LIM and SH3 domain protein 1,LASP1)启动子结合激活其转录。而AFAP1-AS1可通过竞争性结合miR-423-5p充当ceRNA,减轻miR-423-5p在人鼻咽癌细胞中对FOSL2、RAB11B和LASP1蛋白表达的抑制,
调节Rho/Rac信号转导从而促进人鼻咽癌细胞的迁移和侵袭。在子宫内膜癌细胞中,AFAPAS1可以通过吸附miR-545-3p促进血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)的表达,从而促进子宫内膜癌的血管生成和侵袭表型,促进肿瘤的体内生长和转 移[51]。在前列腺癌中,AFAP1-AS1通过靶向miR-512-3p基因的3’-UTR下调其表达从而促进前列腺癌的增殖、侵袭和转移。沉默AFAP1-AS1则可显著降低前列腺癌细胞的细胞周期进程相关蛋白细胞周期蛋白D1(cyclin D1,CCND1)、细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinase 4/6,CDK4/6)的表达水平,而miR-512-3p的过表达能够逆转AFAP1-AS1在前列腺癌进展中的作用[49]。有研究报道,AFAP1-AS1在骨肉瘤组织和细胞系中的表达明显上调,且AFAP1-AS1的高表达水平与骨肉瘤患者的不良预后相关,这表明AFAP1-AS1可以促进骨肉瘤进展。在分子水平上,AFAP1-AS1可以直接与miR-497、miR-4695-5p结合以充当ceRNA,通过抑制miRNA从而上调IGF1R的表达或激活T细胞因子4(T cell factor-4,TCF-4)/β-连环蛋白(β-catenin)信号转导通路来促进骨肉瘤细胞的增殖和侵袭[43,63]。
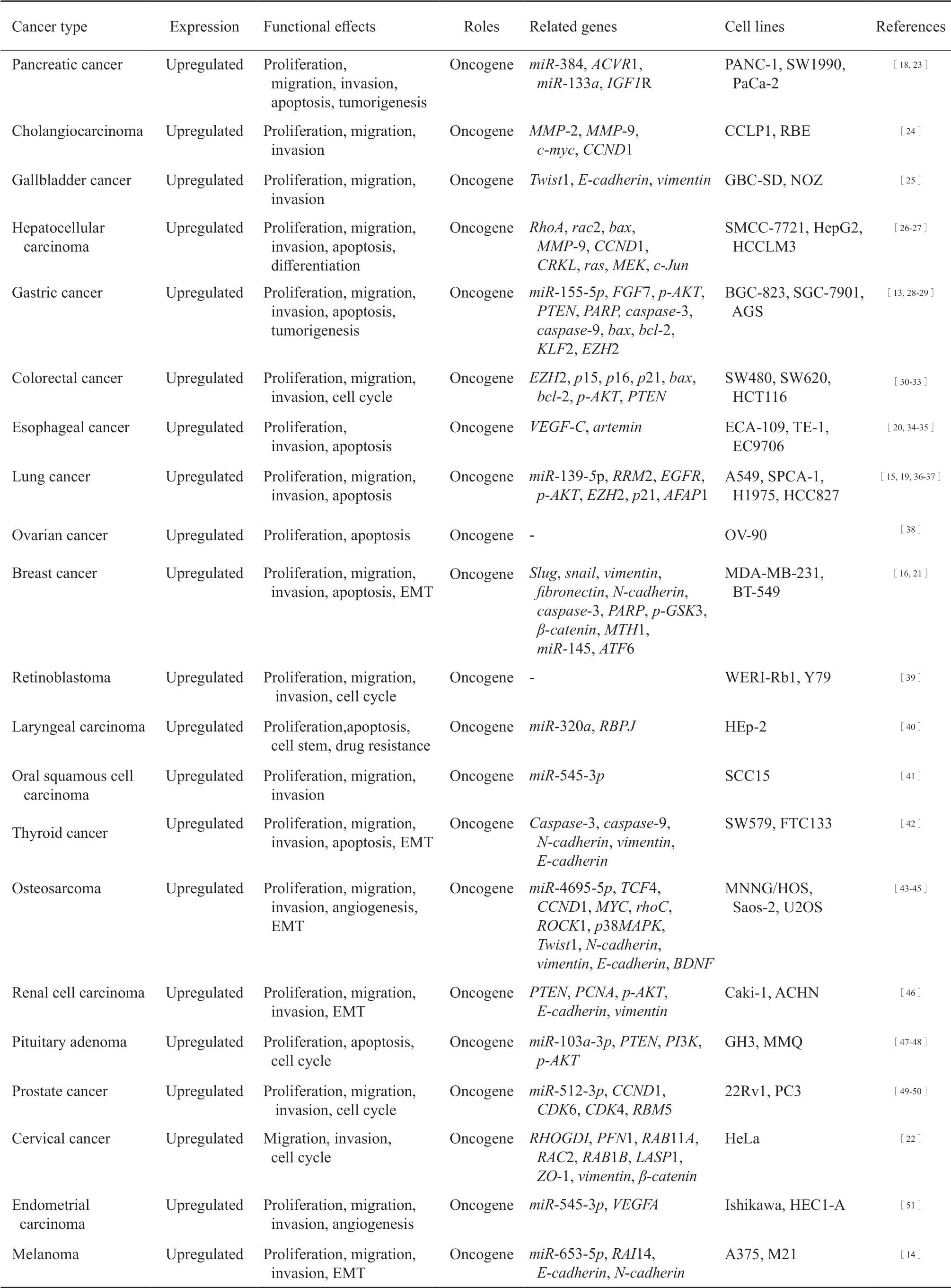
表2 AFAP1-AS1在各种肿瘤中的功能特征Tab.2 The functional characteristics of AFAP1-AS1 in various cancers
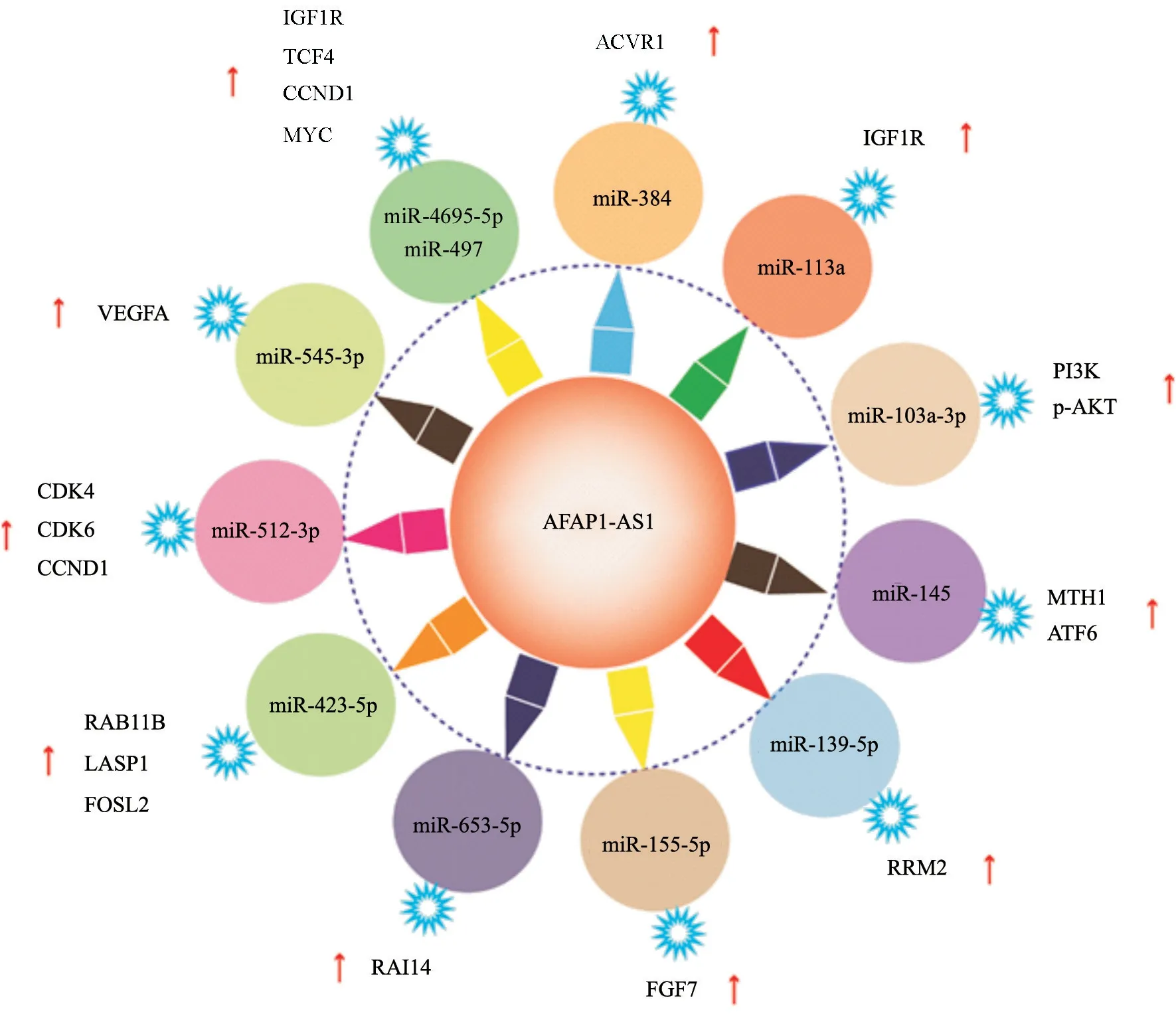
图2 AFAP1-AS1作为一种ceRNA在多种人类癌症中的作用及其潜在分子机制,AFAP1-AS1可以抑制microRNA的表达并调节下游分子Fig.2 The role and underlying molecular mechanisms of AFAP1-AS1 as a ceRNA in various human cancers,AFAP1-AS1 could inhibit the expression of microRNA and regulate downstream molecules
2.2 转录和转录后水平调控
真核生物基因调控的传统模式一般是指通过蛋白质与DNA之间的相互作用或蛋白质与蛋白质之间的相互作用来调控目的基因的表达,然而RNA与DNA之间的相互作用和RNA与蛋白质之间的相互作用的一种新的调控模式已经被人们所认知。非编码RNA在基因表达调控中的作用越来越多地引起了学者们的重视,而lncRNA作为非编码RNA的一种,在转录水平的调控也是非常重要的,其主要通过招募蛋白复合物或竞争转录因子等调控方式来影响基因的表达。基因表达成熟的mRNA需要剪接、加帽和加尾等加工过程,之后是mRNA翻译。lncRNA可以在这些时期通过剪接调控、翻译调控、mRNA稳定性调控发挥转录后水平调控功能。
AFAP1-AS1可以介导恶性肿瘤细胞周期相关基因表达的转录水平的调控。在各种细胞中,超过20%的lncRNA被多梳抑制复合物2(polycomb repressive complex 2,PRC2)结合,并使下游靶基因沉默[64]。众所周知,EZH2是PRC2复合物的一个核心亚基,而PRC2是组蛋白修饰的关键调节剂,它催化H3K27的三甲基化作用以介导基因沉默。最近研究表明,EZH2与AFAP1-AS1结合在1~1 500 nt的位点,且AFAP1-AS1可以通过将EZH2富集到H3K27me3修饰的靶基因启动子而参与转录抑制。AFAP1-AS1在结直肠癌细胞中的过表达增强了p15、p16和p21启动子与EZH2的结合和H3K27me3修饰,从而促进人结直肠癌细胞系SW480和HCT-116细胞增殖和细胞周期进展[30]。在肺癌细胞中EZH2可以结合由AFAP1-AS1介导的p21启动子区域,而敲低AFAP1-AS1可减少EZH2介导的H3K27me3三甲基化作用和降低EZH2与p21启动子区域的结合。总之,AFAP1-AS1可以部分地通过与EZH2结合沉默p21转录来促进肺癌细胞的生长[37]。AFAP1-AS1可以与RNA结合蛋白相互作用介导恶性肿瘤转录后水平调控过程。AU碱基富集区RNA结合蛋白1(AU-rich element RNA binding factor 1,AUF1)是由前信使RNA(pre-messenger RNA,pre-mRNA)选择性剪接产生的4个RNA结合蛋白(RNA-binding protein,RBP)家族,基于对靶mRNA 3’-UTR内富含AU序列的识别,在控制mRNA靶标的稳定性或翻译方面具有典型的作 用[65]。研究[66]表明,AFAP1-AS1可通过与AUF1结合来增强酪氨酸激酶受体(v-erb-b2 avian erythroblastic leukemia viral oncogene homolog 2,ERBB2)mRNA的翻译,从而导致乳腺癌细胞对曲妥珠单抗的耐药。RNA结合基序蛋白5(RNA binding motif protein 5,RBM5)是RNA结合基序蛋白家族成员,通过对多种凋亡基因mRNA前体的选择性剪接,从而调节基因的表达,抑制肿瘤的转化和进展进而发挥抑癌蛋白的作用[67-69]。而AFAP1-AS1可通过靶向抑制RBM5的表达促进前列腺癌的增殖和转 移[50]。总之,AFAP1-AS1的促癌机制与其介导转录和转录后水平调控作用密不可分,具体机制见图3。
2.3 作为调控多种信号通路的上游分子
AFAP1-AS1作为上游信号分子参与癌症各种信号转导通路的调节。AFAP1-AS1参与调控10号染色体上缺失的磷酸酶和张力蛋白同源物基因(phosphatase and tensin homolog deleted on chromosome 10,PTEN)/AKT信号转导通路,影响胃癌、肾细胞癌、垂体腺瘤细胞的增殖和侵袭表型。PI3K/AKT信号转导通路在多种癌症中普遍激活,而PTEN作为一种肿瘤抑制因子,可以下调AKT信号转导能力。敲低AFAP1-AS1可降低人胃癌SGC7901细胞、人肾透明细胞癌细胞Caki-1中p-AKT的蛋白水平并增加PTEN的表达,增加胃癌细胞凋亡通路相关蛋白cleaved-PARP、caspase-3、caspase-9和Bax的表达水平,降低Bcl-2的蛋白质水平,在体外诱导胃癌细胞的增殖和凋亡[28]。而沉默PTEN基因则有效地减弱了AFAP1-AS1促进肾癌细胞增殖、侵袭和EMT的能力[46]。在垂体腺瘤细胞中观察到AFAP1-AS1可通过抑制miR-103a-3p表达激活PI3K/AKT信号通路轴促进垂体腺瘤细胞增殖[47]。此外,有研究者发现AFAP1-AS1是通过RhoA/Rac2信号转导通路参与细胞增殖、侵袭的关键因子[26]。敲低AFAP1-AS1会降低肝癌细胞中RhoA和Rac2的表达,这表明AFAP1-AS1可能通过上调RhoA/Rac2信号来促进肝癌进程。EMT作为肿瘤侵袭转移的重要环节,与肿瘤的侵袭转移密切相关。AFAP1-AS1在恶性肿瘤组织和细胞中的过表达可通过调节相关信号通路途径诱导EMT表型。研究[16]表明,AFAP1-AS1的过表达激活Wnt/β-catenin途径,通过增加在三阴性乳腺癌细胞系中c-Myc和EMT相关分子的表达来促进肿瘤发生和细胞侵袭。Twist1等EMT相关转录因子可受p38MAPK调控。p38MAPK作为中间信号转导靶点可通过激活Rho/Rho相关蛋白激酶(Rhoassociated protein kinase 1,ROCK1)信号通路促进EMT[70-74]。有研究[44]报道,AFAP1-AS1基因敲除下调了骨肉瘤细胞中RhoC、ROCK1、磷酸化p38MAPK和Twist1的表达水平,AFAP1-AS1与骨肉瘤细胞中的RhoC结合,通过影响RhoC介导的信号转导途径发挥致癌作用。
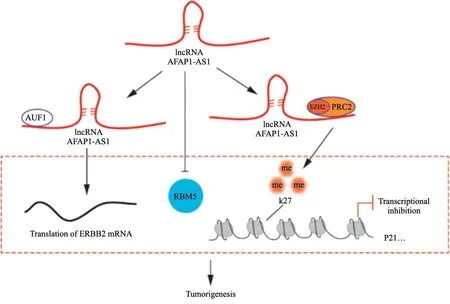
图3 AFAP1-AS1在转录和转录后水平调控的分子机制Fig.3 The molecular mechanism of AFAP1-AS1 regulation at the transcriptional and post-transcriptional levels
2.4 参与化疗或靶向治疗的药物耐受
到目前为止,对不同治疗药物的耐受是癌症治疗的重大挑战之一。AFAP1-AS1可介导顺铂和曲妥珠单抗耐药。喉癌是最常见的头颈部肿瘤,目前主要的治疗方法已从喉总切除术发展成为采用放疗或放化疗结合的非手术治疗方案。顺铂是目前的化学治疗标准药物,可与紫杉醇和5-氟尿嘧啶联用,随后放疗可作为广泛手术的替代方法[75]。然而,化学抗药性和癌细胞干性严重限制了治疗的成功率[76-77]。有证据表明,AFAP1-AS1促进喉癌细胞的干性和肿瘤细胞对顺铂的耐药性。这一过程是AFAP1-AS1通过负调控miR-320a来增加重组信号结合蛋白J(recombination signal binding protein J,RBPJ)表达促进细胞增殖和减少细胞凋亡来介导的[40]。目前,针对人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)细胞外区的人源化单克隆抗体曲妥珠单抗已成为治疗HER2阳性乳腺癌的选择[78]。此外,将来自曲妥珠单抗耐药细胞的细胞外AFAP1-AS1包装到外泌体中,可介导在曲妥珠单抗敏感细胞对曲妥珠单抗的耐药,而AFAP1-AS1的敲除可逆转耐药性[66]。
3 AFAP1-AS1在多种人类肿瘤中的临床意义
许多研究表明,AFAP-AS1属于一种癌基因,它在癌症中表达上调。AFAP-AS1的上调具有重要的临床意义,有望作为早期肿瘤诊断和预后的生物标志物。此外,下调AFAP-AS1可以抑制肿瘤细胞的增殖和转移,降低耐药性,增加凋亡数,可能成为肿瘤治疗的一个有前途的靶点。
AFAP1-AS1表达上调与胃癌患者的临床病理学特征及预后有关。胃癌患者肿瘤组织中AFAP1-AS1的高表达与淋巴结转移、TNM分期及总生存期(overall survival,OS)均呈正相 关[79]。lncRNA不仅可以稳定存在于肿瘤细胞和组织中,而且还可以稳定存在于血清、尿液和胃液中[80]。研究发现,胃癌患者血清AFAP1-AS1均较正常对照组上调,而胃癌患者手术后血清AFAP1-AS1明显降低。血清AFAP1-AS1与癌胚抗原(carcinoembryonic antigen,CEA)和糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)联合检测可显著提高诊断胃癌的灵敏度[81]。一项关于lncRNA表达与胃癌患者总体生存期关系的meta分析显示,AFAP1-AS1是预测胃癌患者预后的有力候选者之一[82]。对非小细胞肺癌的临床肿瘤组织样本研究发现[83-84],AFAP1-AS1在肺癌组织中的表达明显高于癌旁组织和正常组织,临床分期、吸烟史、浸润程度、淋巴结转移和远处转移均是AFAP1-AS1高表达的显著相关因素。AFAP1-AS1的高表达与肺癌患者总生存期较短有关,是影响肺癌患者生存时间的独立预后因素。非小细胞肺癌患者血清中可以检测到AFAP1-AS1,与经典肿瘤标志物细胞角蛋白19片段抗原21-1(cytokeratin 19 fragment antigen 21-1,CYFRA21-1)联合应用筛查可提高非小细胞肺癌的诊断效率[85]。对AFAP1-AS1表达与视网膜母细胞瘤患者临床病理学特征之间的相关性的研究发现,AFAP1-AS1的表达与肿瘤的大小、肿瘤脉络膜浸润和视神经浸润密切相关,且AFAP1-AS1高表达的视网膜母细胞瘤患者的生存期短于AFAP1-AS1低表达患者[39]。对鼻咽癌[86]、胰腺癌[87]、结肠癌[31,88]、胆囊癌[25]、宫颈癌[22]、乳腺 癌[89-90]、神经胶质瘤[91]患者预后的研究发现,与AFAP1-AS1低表达的患者相比,AFAP1-AS1高表达的患者往往有较高的转移和复发风险,且患者生存时间较短。
4 总结与展望
综上所述,AFAP1-AS1有可能作为一种新的分子标志物用于肿瘤的诊断和治疗,并可作为一种独立的预后指标。

