同源重组缺陷检测在肿瘤临床诊疗中的研究进展与展望
郁 俐,沈敏娜,姜惠琴,王蓓丽,2,郭 玮,2
1.复旦大学附属中山医院检验科,上海 200032;2.复旦大学附属中山医院厦门医院检验科,福建 厦门361015
DNA受到内源性和外源性因素的影响会产生不同类型的损伤,其中DNA双链断裂(DNA double-strand break,DSB)损伤是最具细胞毒性的损伤。大量研究证据表明,DSB与免疫缺陷、发育障碍等相关[1]。机体在正常情况下通过修复损伤通路来维持基因组的完整性和稳定性,其中同源重组(homologous recombination,HR)是DSB的修复方式之一[2]。肿瘤HR修复中明确的缺陷是BRCA1和BRCA2的基因突变,BRCA1或BRCA2致病性突变的癌症约占家族性乳腺癌/卵巢癌的1/4[3]。除了BRCA1/2基因突变之外,同源重组缺陷(homologous recombination deficiency,HRD)也可以由其他机制引起,例如,同源重组修复(homologous recombination repair,HRR)相关基因的胚系突变、体细胞突变、基因组总体突变情况、基因组稳定性及HRR途径中涉及基因的表观遗传修饰等。
多项研究表明,HR相关基因或蛋白的表达与肿瘤放疗及药物的敏感性相关,HRD作为一种新的生物标志物,在肿瘤的个体化治疗中发挥巨大的作用[4]。由于HRD细胞对多腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]抑制剂(PARP inhibitor,PARPi)的敏感性,在肿瘤患者的用药指导及预后监测中,HRD的检测至关重要[5]。本文旨在总结HRD的检测方法,探讨HRD检测在临床实践中的价值,为肿瘤的精准治疗奠定基础。
1 HRD检测
1.1 HR基因突变检测
HR是一条涉及到多个步骤的复杂的信号转导通路,其中关键蛋白为BRCA1和BRCA2,携带BRCA1和(或)BRCA2基因的胚系有害突变的人群其一生中患乳腺癌、卵巢癌、前列腺癌、黑色素瘤和胰腺癌的风险增加[6-7]。BRCA与许多其他DNA修复蛋白相互作用,形成DNA损伤修复的复杂系统,这些蛋白包括ATM、RAD51、PALB2、MRE11、RAD50、NBN和FA蛋白 等[8]。研究表明,PALB2有害突变携带者终生患乳腺癌、胰腺癌的风险为普通人群的2~20倍,这些基因的突变、失活同样导致DNA损伤修复功能的缺陷[9-10]。
Pennington等[11]使用靶向捕获测序对390例卵巢癌患者的30个基因进行胚系及体细胞突变的检测,发现31%的卵巢癌在13个HR基因(BRCA1、BRCA2、ATM、BARD1、BRIP1、CHEK1、CHEK2、FAM175A、MRE11A、NBN、PALB2、RAD51C、RAD51D)中存在有害的胚系突变(24%)或体细胞突变(9%)。胚系和体细胞HR突变可预测原发性铂类药物敏感性(P=0.000 2)和总生存率的改善(P=0.000 6),胚系HR突变携带者的中位总生存期为66个月,体细胞HRR突变的患者为59个月,无HRR突变的患者为41个月。Heeke等[12]对52 426例肿瘤样本进行HRR相关基因致病突变检测。HRR基因在21种肿瘤样本中突变的总发生率为17.4%,突变最常发生在子宫内膜(34.4%)、胆道(28.9%)、膀胱(23.9%)、肝(20.9%)、胃与食管(20.8%)和卵巢(20.0%)肿瘤中。ARID1A是最常见的突变基因(7.2%),其次是BRCA2(3.0%)、BRCA1(2.8%)、ATM(1.3%)、ATRX(1.3%)和CHEK2(1.3%),该研究显示,HRR在不同的实体瘤中的突变频率存在 差异。
随着研究的深入,不断有新基因被发现参与HR作用,CDK12突变的晚期前列腺癌表现出侵袭性的临床行为,患者转移时间短[13]。RBBP8是DNA复制叉完整性的关键调节因子,RBBP8基因发生变异容易导致早发性乳腺癌[14]。利用二代测序技术,可以评估许多HRR基因是否存在胚系或体系突变,但对于基因突变的注释仍然是一大挑战;此外,由于表观遗传修饰等因素,单纯检测HR基因的突变不能完全反映患者的HRD 状态。
1.2 “基因组瘢痕”分析
HRD的功能学评估有助于弥补检测HR基因突变的不足,当HRD存在时,基因组变异累积,等位基因失衡可能导致“基因组瘢痕”,通过对“基因组瘢痕”所表示的HRD进行评估可以不考虑潜在的遗传或表观遗传机制。目前常用的基因组瘢痕检测主要有3种方法,即微阵列比较基因组杂交(array comparative genomic hybridisation microarrays,aCGH)检测,基于单核苷酸多态性的序列分析,以及基于突变特征的测序分析(mutational signatures)[15]。目前已证实与HRD密切相关的“基因组瘢痕”包括基因组杂合性缺失(loss of heterozygosity,LOH)[16]、端粒等位基因不平衡(telomericallelic imbalance,TAI)[17]、大片段迁移(large-scale state transition,LST)[18]等,经过一系列算法可以得出HRD基因组瘢痕评分(图1)。
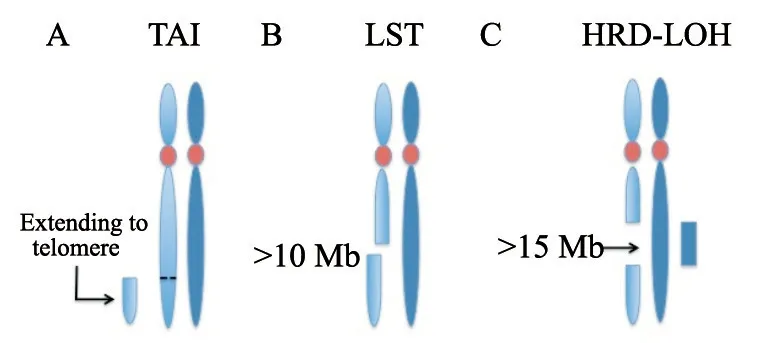
图1 基因组瘢痕类型概述 Fig.1 Overview of genomic scar types
随着更多的癌症基因组的标志物被开发,研究发现全基因组的突变负荷与BRCA恶性卵巢癌化疗后生存率的提高相关[19]。Alexandrov 等[20]认为突变模式的改变导致了癌症的特征性发展,“Signature 3”被认为是潜在的HRD标志,存在于乳腺癌、卵巢癌、前列腺癌和胃癌中。HRDetect是一个突变特征的加权模型,该模型结合了微同源介导的缺失、碱基替换/重排信号和基于基因组瘢痕的HRD指数的加权得分。从FFPE样本中高灵敏度、高特异性地识别BRCA基因缺陷型肿瘤[21]。
1.3 HRD的转录图谱及蛋白质表达定位
在乳腺癌和卵巢癌中BRCA1基因有着较高的甲基化率,研究认为BRCA1基因的启动子异常高甲基化引起对应区域的组蛋白去乙酰化,改变核小体空间排列分布,从而增强转录抑制蛋白的功能,导致转录失败[22]。Kalachand等[23]对15项研究中2 636例受试者的数据进行meta分析,评估BRCA1甲基化与临床病理学特征的关系。发现BRCA1甲基化与年龄较小和晚期高级别浆液性卵巢癌相关。基因表达谱(gene expression profiling,GEP)通过分析93个调控细胞凋亡、细胞周期进入和DNA修复的相关基因的化疗反应谱可以反映肿瘤的当前转录状态,用于选择患者进行辅助化疗[24]。
2 HRD检测在临床中的运用
2.1 肿瘤患者预后指导
2020年发布的一项研究[25],研究者从癌症基因组图谱(The Cancer Genome Atlas,TCGA)获得了卵巢癌患者的基因检测数据并计算了HRD分数,结果发现HRD评分≥63的人群预后显著优于42~62分以及42分以下的患者。该研究将BRCA1/2、CHEK1、PTEN等基因突变的病例归类为基因变异导致的HRD(gHRD);具有BRCA1甲基化和RAD51C甲基化的病例归类为表观遗传学改变导致的HRD;其余病例则归类为不确定的HRD。三组患者的生存情况分析显示,gHRD的预后良好,而表观遗传导致HRD的人群预后较差。因此,根据导致HRD不同的原因将患者分为不同预后的亚型,对卵巢癌的个性化临床管理具有积极作用。三阴性乳腺癌顺铂试验队列[26]及Ⅲ期POLO研究[27]显示,HRD患者一线含铂治疗的无进展生存期(progression-free survival,PFS)优于非HRD患者,HRD基因的双等位突变和核心基因(BRCA1/2及PALB2)突变患者具有更高的基因组不稳定性,一线含铂药物治疗的PFS改善优于非含铂药物治疗。提示乳腺癌及胰腺癌患者通过靶向测序,可以发现更多携带HRD/DNA损伤修复基因突变的患者,从而进行有针对性的含铂药物或PARPi治疗。随着更长时间的随访和观察以及更多的相关研究的开展,HRD与预后的关系将更清晰明确。
2.2 肿瘤患者用药指导
对于存在HRR功能异常的肿瘤,PARPi通过抑制PARP酶活性和增加PARP-DNA复合物的形成,导致肿瘤细胞DNA损伤修复障碍和促发“合成致死”。多项临床试验表明,PARPi能够使HRD患者获益(表1)。Ⅲ期临床试验PAOLA-1的结果显示在806例卵巢癌患者中HRD阳性患者387例(占总人群48%),HRD阳性BRCA1/2突变阴性(non-tBRCAm)患者有152例(占总人群19%),即通过检测HRD导致的基因不稳定性可有效预测额外约20%的患者,从PARPi中显著获益的患者可从20%的BRCA突变人群到50%的HRD人群[28]。同期发布PRIMA的研究结果同样纳入了针对HRD亚组的分析。在卵巢癌人群中BRCA1/2未发生突变的HRD患者接受尼拉帕尼治疗的PFS为19.6个月,而安慰剂组为8.2个月(HR=0.50,95% CI:0.31~0.83)[29]。

表1 HRD相关的临床研究及结果Tab.1 Clinical studies and results related to HRD
TOPARP-B研究数据提示HR通路中除BRCA1/2以外,几个关键基因如ATM、CDK12和PALB2可不同程度预测转移性去势抵抗型前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)患者对PARPi的综合疗效。PROfound研究数据显示携带BRCA1/2或ATM突变的mCRPC患者,PARPi奥拉帕尼与恩杂鲁胺或阿比特龙相比,PFS显著改善。NOVA研究[30]、ARIEL3研究[31]等临床研究不断发现HRD阳性患者使用PARPi能够延长癌症患者的中位PFS。目前PARPi奥拉帕尼已经获得美国食品药品管理局(Food and Drug Administration,FDA)批准用于治疗携带HRR基因突变的转移性去势抵抗性前列腺癌患者。
3 面临的挑战
通过HRR基因突变以及基因瘢痕等检测来评估HRD状态可以帮助更多患者使用PARPi获益。由于许多变异的基因型-表型相关性尚不清楚,如何对检测结果进行解释,是否可以指导用药或者预测患病风险,对于意义不明的变异进行注释及解读一直是一个难题。在BRCA1甲基化的卵巢癌患者中没有表现出对PARPi治疗的长期反 应[32]。这种差异体现了基因组的高度异质性,需要对特定的生物标志物进行特定的临床评估和验证。使用基因瘢痕检测来评估基因组的状态也并非能够完全预测患者对于PARPi的敏感性,有研究[33]报道,有近50%的铂耐药卵巢癌患者是由于在接受铂类药物治疗的过程中出现了BRCA功能的恢复,因此对首次取样的组织进行基因瘢痕检测的结果无法代表当前患者体内的状态。目前国内尚缺乏标准的HRD检测产品,还需要中国人群自己的数据支持,包括算法及阈值的设定等,如此才能保证临床应用的准确性和有效性。
随着HRD与PARPi研究的深入,HRD的检测及其相关性研究已在多种肿瘤中进行尝试,如胃癌[39]、胰腺导管腺癌[40]。Fan等[39]在中国胃癌人群中进行了HRR基因与免疫治疗反应的相关性研究,结果发现,ATM基因是中国人群中突变较多的HR基因之一(16/484,3.31%)。HR基因突变与肿瘤突变负荷增加、免疫活性增强和微卫星不稳定状态相关。按照是否存在HRD,研究者将存在HRD的肿瘤定义为HRD的肿瘤,尝试探索DNA损伤修复途径中必不可少的肿瘤抑制因子的细胞功能,确立合理规避肿瘤耐药性的 策略[41]。
众多的研究发现,患有HR-DNA损伤反应(DNA damage response,DDR)信号转导通路突变的肿瘤患者可能对DNA损伤化疗更敏感,同时HRD与接受DNA损伤疗法治疗的预后相关。在未来,将肿瘤归类为HR-DDR缺陷型会变得越来越重要。目前国内尚无经中国国家药品监督管理局(National Medical Products Administration,NMPA)审批通过的有效预测PARPi疗效的基因瘢痕检测试剂盒,但是相应的产品正在紧锣密鼓地开发中。必须指出,无论使用何种方法学来实现HRD检测,最终必然会经历严格设计的回顾性和(或)前瞻性临床研究的验证。

