LRP8在胃癌中的表达及其在胃癌发生过程中的作用
刘 斌,郑鹏远,米 阳,任飞飞,高 爽,刘 传,李发展
1.郑州大学第五附属医院消化内科,河南 郑州 450052;2.郑州大学医学科学院,河南 郑州 450052
胃癌在所有肿瘤中发病率位居第五,死亡率位居第三[1]。胃癌每年超过一半发生在中国,是中国男性死亡率位居前列的癌症[2]。目前对胃癌的病因已有较为明确的结论,但是其发病机制仍未完全明确[3]。从分子层面来说,胃癌的发生涉及多个癌基因和抑癌基因、信号转导通路和细胞周期调控分子的变异等复杂过程[4]。本研究探讨低密度脂蛋白受体相关蛋白8(low-density lipoprotein receptor-related protein 8,LRP8)在胃癌组织与正常胃黏膜中是否存在差异表达,LRP8对胃癌细胞生物学行为的影响,并探寻其可能的机制及其与胃癌患者临床病理学特征及预后的关系。
1 资料和方法
1.1 临床资料
1.1.1 数据库资料收集分析
在人类癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库下载384例胃癌和3 7 例正常人的基因表达数据,在cbioportal(https://www.cbioportal.org)数据库中下载T C G A 数据库中具有完整临床病理学信息的240例胃癌患者数据,在基因表达汇编(Gene Expression Omnibus,GEO)数据库中下载GSE13911[5]、GSE13861[6]的基因表达数据集,分析胃癌组织和正常胃黏膜中LRP8的表达差异。利用R(pheatmap)与R(corrplot)软件包分析与LRP8的共表达的基因,进一步通过DAVID分析工具对共表达基因进行基因本体(Gene Ontology,GO)分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析;在Kaplan-Meier plotter(www.kmplot.com)数据库中分析LRP8表达与胃癌患者预后的相关性。
1.1.2 标本来源
郑州大学第五附属医院2018年8月—2019年7月行全胃切除术或部分切除术的患者25例,其中男性17例,女性8例,年龄(63.6±11.4)岁,所有患者术前均未接受化疗和放疗。采用免疫组织化学法检测LRP8在胃癌组织中的表达。胃癌细胞系AGS购自中国科学院典型培养物保藏委员会细胞库,常规传代培养。
1.1.3 实验试剂
兔LRP8抗体购自北京博奥森生物技术有限公司,鼠β-actin抗体购自美国Santa Cruz公司,二抗购自北京中杉金桥生物技术有限公司,RPMI-1640及Opti-MEM培养基、TRIzol购自美国Gibco公司,FBS胎牛血清购自美国Biological Industries公司。人源LRP8小干扰RNA(small interference,siRNA)由上海吉玛制药技术有限公司合成,si-LRP8-1序列为5’-GCAGCCAGAU CUGUGUCAATTUUGACACAGAUCUGGCUG CTT-3’,si-LRP8-2序列为5’-GGAGAAACUGG AAGCGGAATTUUCCGCUUCCAGUUUCUCC TT-3’。LipofectamineTM2000转染试剂购自美国Invitrogen公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自日本Dojindo公司,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDSPAGE)试剂盒购自北京康为世纪生物科技有限公司,发光液购自美国Advansta公司。实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQPCR)引物由中国金唯智生物科技有限公司合成,反转录试剂盒购自日本Toyobo公司,RTFQPCR试剂盒购自德国Qiagen公司。
1.2 实验方法
1.2.1 数据分析
在TCGA数据库中下载胃癌组织基因表达值,分析384例胃癌患者胃癌组织和37例健康人胃组织中LRP8基因表达差异。利用生物信息学功能注释数据平台DAVID,对胃癌中与LRP8表达正相关的前200个基因进行GO分析和KEGG分析。TCGA数据库中240例胃癌患者,取LRP8表达值中位数为界分为高表达和低表达组,然后分析临床病理学特征与LRP8表达的关系。利用Kaplan-Meier plotter数据库中找到LRP8表达的芯片数据并绘制LRP8表达的生存曲线。
1.2.2 免疫组织化学检测
组织切片分别放于二甲苯、无水乙醇中脱蜡、脱苯;加入柠檬酸钠抗原修复15 min。用3%过氧化氢去离子水和山羊血清依次封闭15 min,兔LRP8一抗(1∶100)4℃温育过夜。次日洗去一抗,采用50 μL生物素化二抗和辣根酶标记链霉卵白素依次温育20 min,二氨基联苯胺(3,3’-diaminobenzidine,DAB)染色2 min,苏木精复染细胞核1 min,脱水、透明、中性树胶封片。空白对照组使用抗体稀释液温育,其余处理相同。结果采用德国半定量评分法进行评分[7]。具体参考本研究团队之前发表的文章[8]。
1.2.3 细胞培养及细胞转染
使用含10%FBS的RPMI-1640培养基,于37 ℃、CO2体积分数为5%的恒温培养箱中培养AGS细胞。细胞以1×105个铺到12孔板,次日转染:12孔板更换 800 µL无血清培养基,然后每孔中加入预先混匀的200 µL opti-MEM+2.5 µL LipofectamineTM2000+5 µL阴性对照或si-RNA。轻轻摇晃,置于培养箱中。8 h后更换含血清及抗生素的完全培养基1 mL。转染48 h后收取细胞用于后续实验。
1.2.4 细胞功能实验
细胞增殖:细胞以1 000个每孔铺到96孔板中,置于培养箱中培养0、24、48、72 h后,分别更换含10%CCK-8的完全培养基,温育2 h后,多功能酶标仪测定450 nm处的吸光度(D)值并进行统计学分析。细胞迁移:1×105个细胞用 200 μL无血清培养基重悬后加入transwell培养板的上室,下室中加入600 μL完全培养基,放入上室,置于培养箱温育48 h。移除培养基,用棉签擦去上室未迁移的细胞,用4%多聚甲醛固定细胞30 min,用0.1%结晶紫染色30 min后再用PBS洗去染色液。随机选取5个100倍镜视野,显微镜下观察并拍照。
1.2.5 RTFQ-PCR检测
RNA按TRIzol法提取后,按反转录试剂盒说明书操作进行,于37 ℃、15 min反转录反应和 98 ℃、5 min的酶失活反应后得到cDNA,稀释10倍后作为模板配置RTFQ-PCR体系,分别加入10 µL 2 ×SYBR Green PCR Master Mix、2.8 µL引物混合物(上、下游引物均为5 µmol/L)及5.2 µL无酶水,最后加入2 µL cDNA模板,95 ℃活化2 min,两步循环95 ℃变性5 s,60 ℃退火延伸10 s,循环次数为40。所得结果采用2-△△C(t)法计算相对表达量,具体参考本研究团队之前发表的文章[8]。引物信息如表1所示。

表1 RTFQ-PCR的引物序列Tab 1 Primer sequences for RTFQ-PCR analysis
1.2.6 蛋白免疫印迹(Western blot)
按照试剂盒说明书的方法制备SDS-PAGE凝胶,电泳按照80 V 30 min、100 V 60 min两步法进行,结束后取出凝胶,制作转膜三明治结构,按300 mA、90 min恒流电转。取出NC膜,置于含5%脱脂奶粉封闭液中封闭1 h,加入兔LRP8抗体(1∶1 000)、鼠β-actin抗体(1∶5 000),4 ℃温育过夜。次日取出回收一抗充分清洗后二抗室温温育1 h,结束后充分清洗,Bio-RAD曝光仪曝光拍照分析。具体参考本研究团队之前发表的 文章[8]。
1.3 统计学处理
TCGA数据库中LRP8表达值采用两独立样本校正t检验。GEO数据库中LRP8表达值采用GEO2R在线分析方法,adj.P<0.05且|log2 FC|>2(adj.P为调整后的P值,FC为差异倍数)代表差异有统计学意义。免疫组织化学评分结果用 SPSS 22.0软件进行统计学分析,LRP8相对表达量免疫组织化学数据采取配对符号秩和检验,与临床病理学特征关联采用Fisher确切概率法检验,TCGA数据库中病理学特征采取卡方检验或连续校正卡方检验。生存分析采用log-rank检验。以上实验数据,P<0.05为差异有统计学意义。
2 结果
2.1 LRP8在胃癌组织中高表达
分析TCGA数据库中384例胃癌患者肿瘤组织和37例正常人胃黏膜组织中LRP8的表达数据,结果显示,在胃癌组织中LRP8表达高于正常胃黏膜,差异有统计学意义(t=8.928,P<0.000 1,图1)。而GEO数据库中,其中GSE13861显示在弥漫型胃腺癌中LRP8表达高于正常胃黏膜(t=9.062,P<0.000 1);而GSE13911中数据显示肠型胃腺癌中LRP8表达高于正常胃黏膜(t=10.081,P<0.000 1)。第3项研究中分析混合型腺癌(t=5.738,P<0.000 1)和肠型胃腺癌(t=6.754,P<0.000 1)中LRP8表达高于正常胃黏膜,差异有统计学意义(P<0.000 1,图1)。
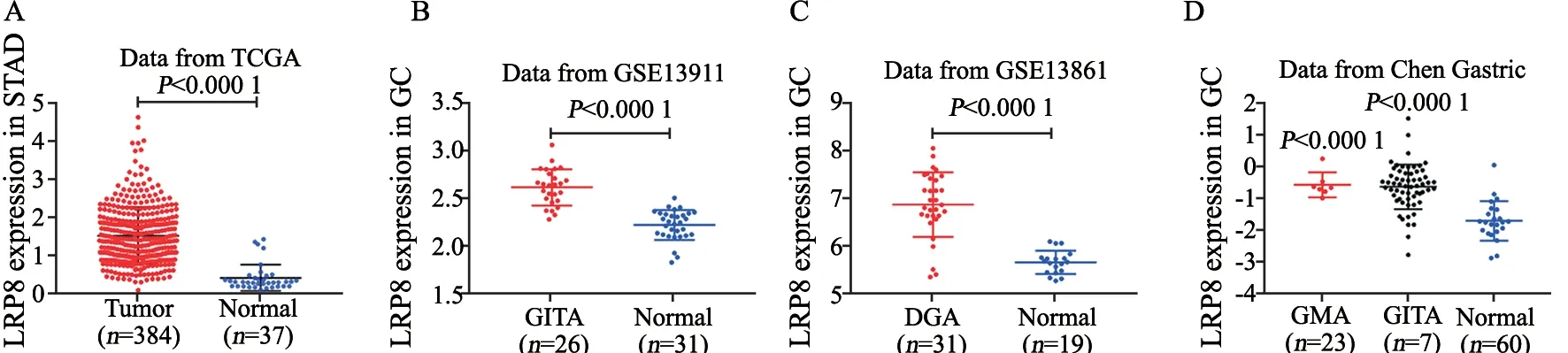
图1 TCGA和GEO数据库中LRP8在胃癌中的表达情况Fig.1 LRP8 expression is upregulated in gastric cancer in TCGA and GEO datasets
2.2 LRP8在胃癌中与其他基因表达的共聚类分析
TCGA数据库中分析384例胃癌患者基因表达数据的共聚类分析显示,LRP8与LOC100507564、SAPCD2、ODF2、E2F1、SLC1A5等20个基因有较高的共表达(图2A),最高的5个相关系数分别为0.68、0.60、0.54、0.54和0.53(图2B)。提示LRP8可能与这些基因在功能上有相似性。
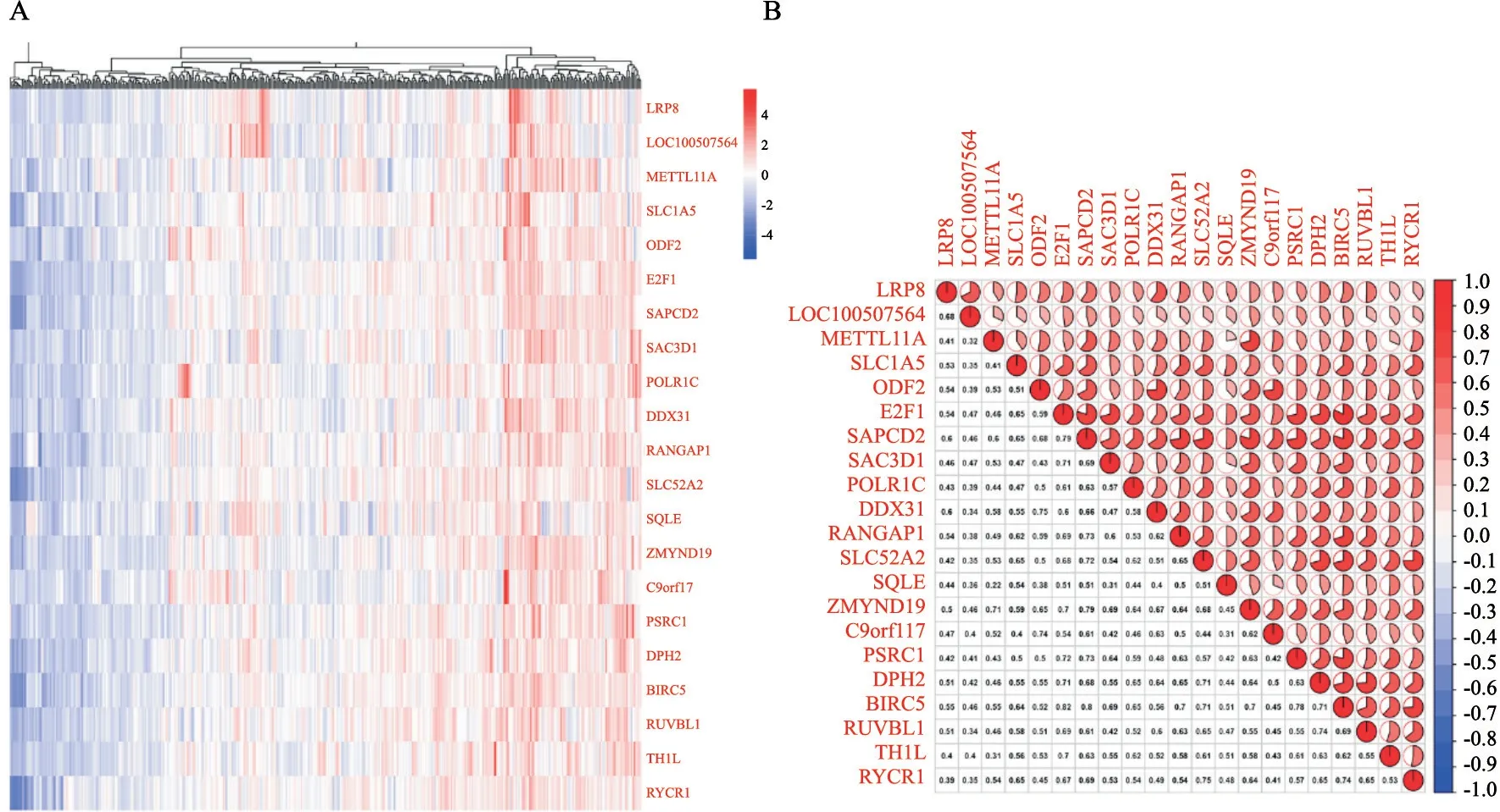
图2 胃癌组织中与LRP8表达相关基因的关联性分析Fig.2 Correlation analysis of the gene expression level of LRP8 in gastric cancer
2.3 LRP8功能富集分析
为了研究LRP8在胃癌中发挥何种功能,我们对胃癌中与LRP8表达正相关的200个基因进行基因功能的GO功能富集分析,发现LRP8在分子功能上富集在DNA指导的RNA聚合酶活性、中性氨基酸的跨膜转运蛋白活性等基因功能上;而在细胞功能上则富集在细胞内膜结合细胞器、核仁、核膜上;在生物学功能上,富集在与RNA转录延伸聚合酶Ⅱ启动子、mRNA剪接、rRNA的加工等基因功能上。KEGG通路富集显示,LRP8参与Wnt信号转导通路激活(图3)。
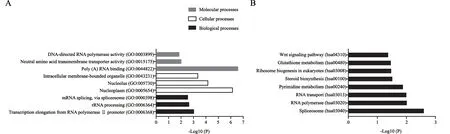
图3 TCGA数据库样本中LRP8的GO和KEGG通路富集分析Fig.3 GO and KEGG pathway enrichment analyses of 384 gastric cancer patients from TCGA database
2.4 LRP8敲低影响胃癌细胞功能
为了研究LRP8表达对胃癌细胞功能的影响,我们通过RNA干扰技术敲低AGS细胞的LRP8,通过RTFQ-PCR及Western blot来验证敲低效率,结果显示,LRP8表达成功下调。随后我们进行了细胞增殖实验和细胞迁移实验。结果发现,在AGS细胞中,si-LRP8组细胞增殖率均低于对照组;细胞迁移实验结果显示,si-LRP8组AGS细胞迁移率明显低于对照组,差异有统计学意义(P<0.05,图4)。
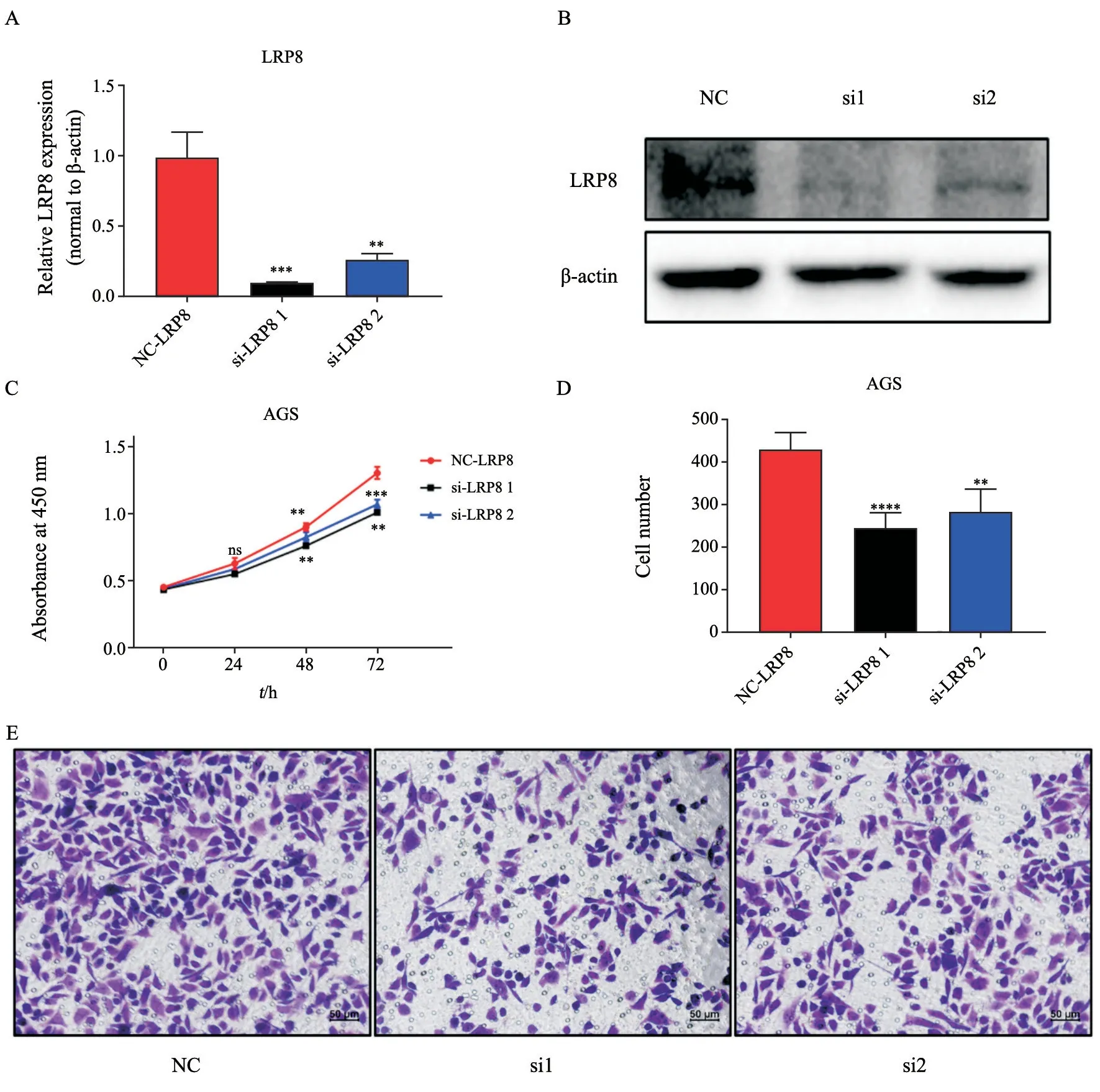
图4 LRP8表达影响胃癌细胞AGS迁移Fig.4 LRP8 expression affects AGS cell migration
2.5 LRP8敲低抑制Wnt通路活性
为了分析LRP8对Wnt通路活性的影响,我们通过RTFQ-PCR分析了LRP8敲低后Wnt经典通路的下游靶基因,发现LRP8敲低后伴随Wnt通路下游关键靶基因表达的蛋白β-catenin、LRP5、POU5F1、CCND1、AXIN2的表达下调(图5)。
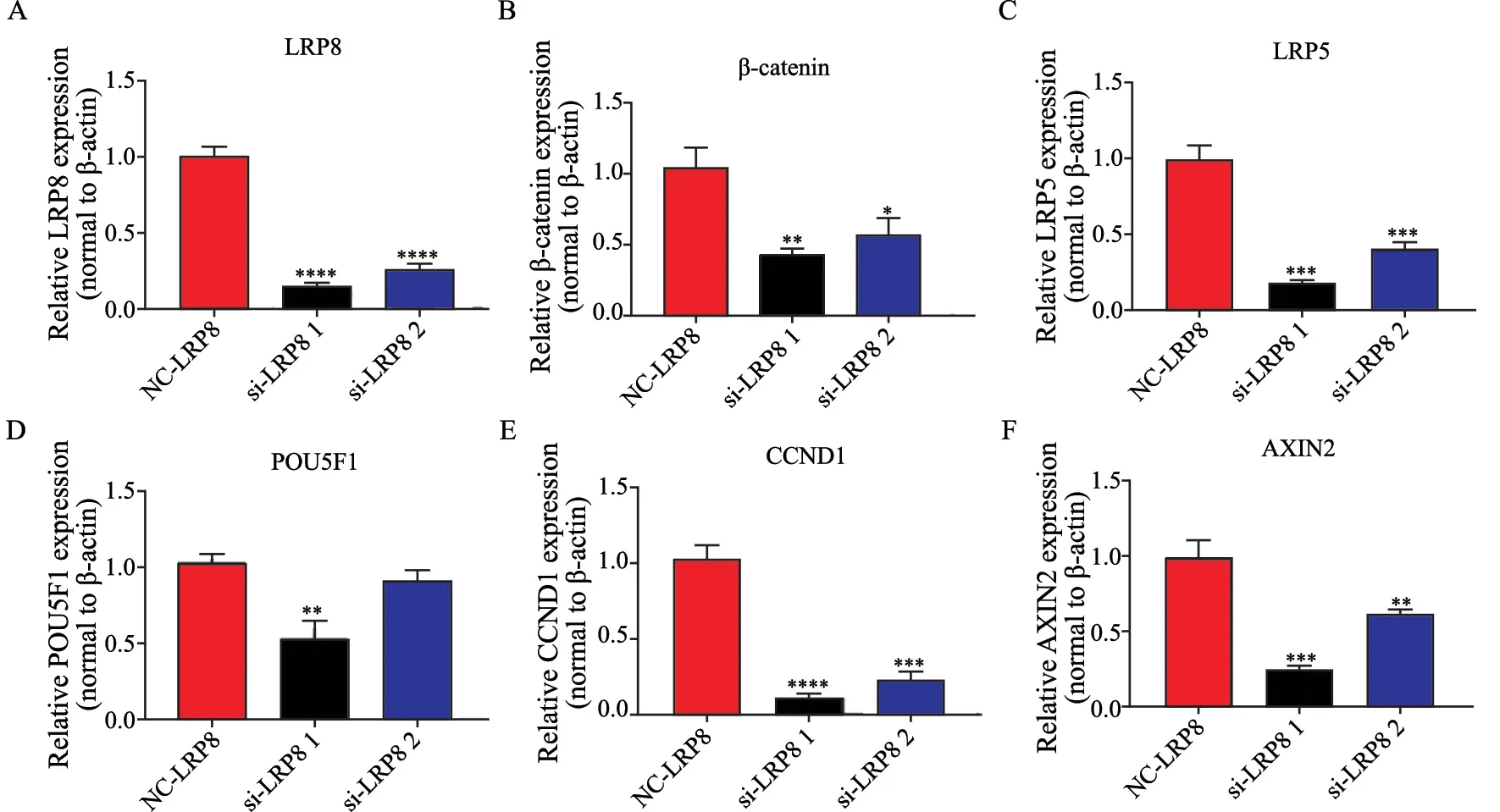
图5 LRP8敲低对Wnt信号通路下游靶基因的影响Fig 5 Effect of LRP8 knockdown on downstream target genes of Wnt signaling pathway
2.6 胃癌中LRP8高表达与患者不良预后的关系
我们进一步分析Kaplan-Meier plotter数据库中LRP8表达水平与胃癌患者预后的数据,通过Affy ID:205282-at和208433_s_at两个基因芯片的数据绘制了LRP8高低表达组的生存曲线(图6)。LRP8高表达患者的总生存期和无疾病进展生存期均低于低表达组(P<0.05,表2),提示LRP8高表达可能与胃癌不良预后相关。
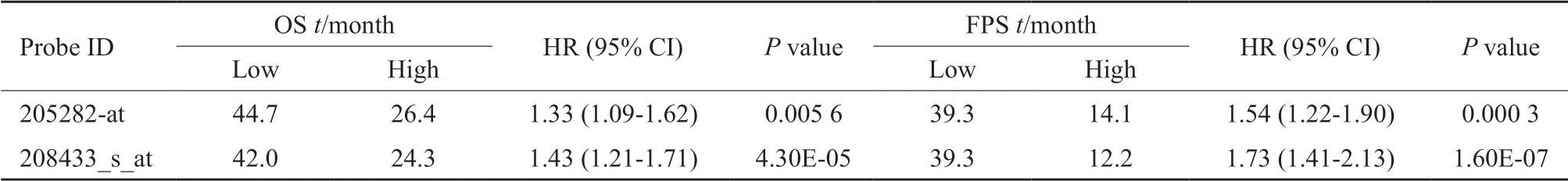
表2 LRP8表达与胃癌患者OS及FPS的关系Tab.2 Correlation of LRP8 expression with OS and FPS of gastric cancer patients
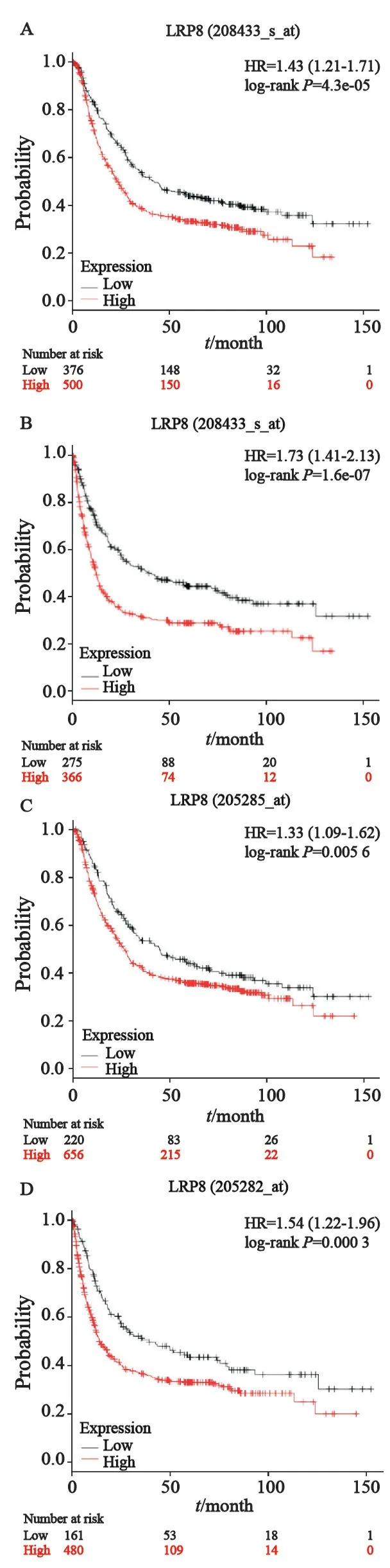
图6 LRP8高表达与胃癌患者不良预后相关Fig.6 High LRP8 expression predicted poor prognosis in gastric cancer patients
2.7 胃癌组织中LRP8的高表达与患者临床病理学特征的关系
对25例胃癌患者及其癌旁组织进行的免疫组织化学检测结果显示,LRP8在胃癌组织中高表达,阳性率为70.83%,差异有统计学意义(Z=-3.535,P<0.001)。进一步分析胃癌组织中LRP8表达与患者临床病理学特征之间的关系(表3),发现LRP8表达与胃癌分期相关(P=0.034)。
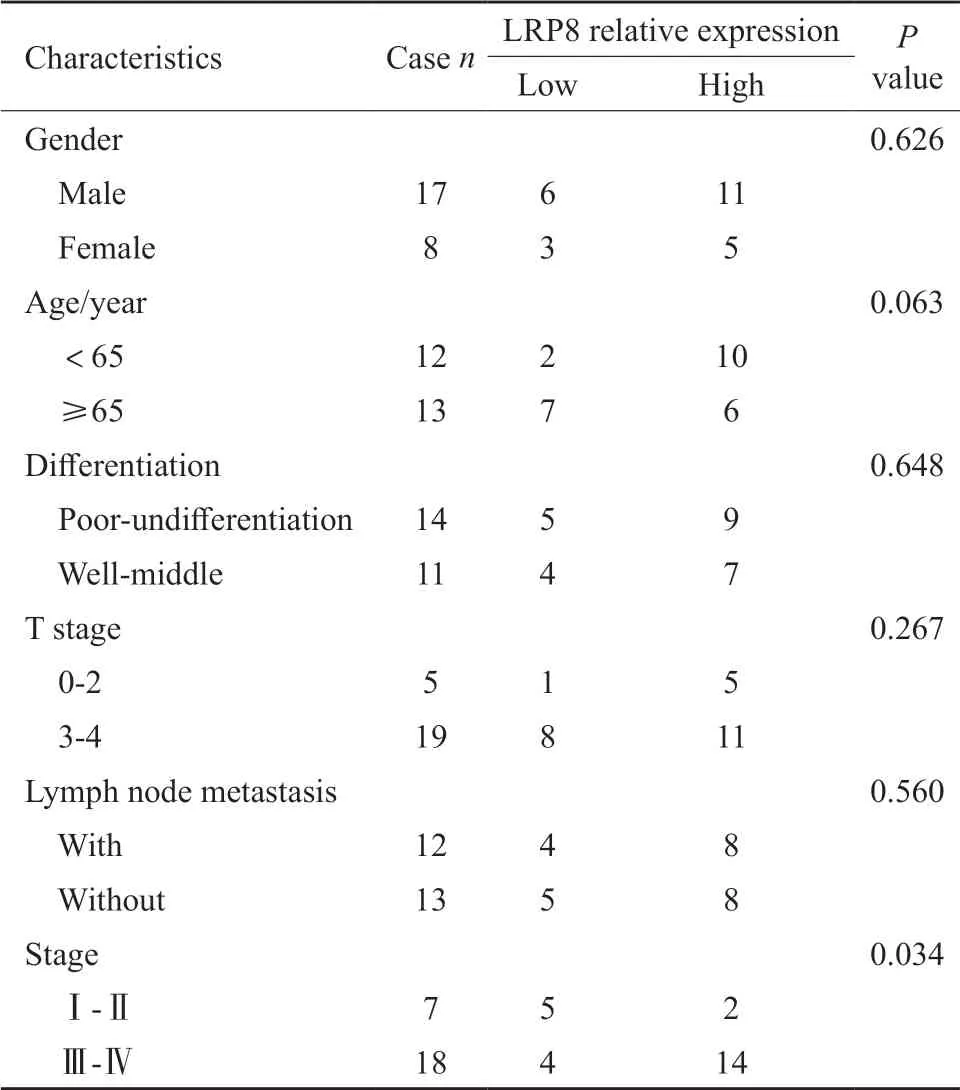
表3 免疫组织化学分析LRP8表达与胃癌患者临床病理学特征的关联Tab.3 Correlation between LRP8 expression and clinicopathological features of gastric cancer in immunohistochemistry data(n)
进一步分析表明Ⅲ、Ⅳ期胃癌中LRP8表达更高,而与患者年龄(P=0.063)、性别(P=0.626)、分化程度(P=0.648)、浸润深度(P=0.267)及淋巴结转移(P=0.560)等无相关性。但对TCGA数据库中LRP8表达与胃癌患者临床特征分析表明(表4),LRP8表达与胃癌患者年龄呈正相关(P<0.001),与患者性别(P=0.096)、肿瘤浸润深度(P=0.342)、淋巴结转移(P=0.306)、远端转移(P=0.260)及分期(P=0.775)无相关性(图7)。
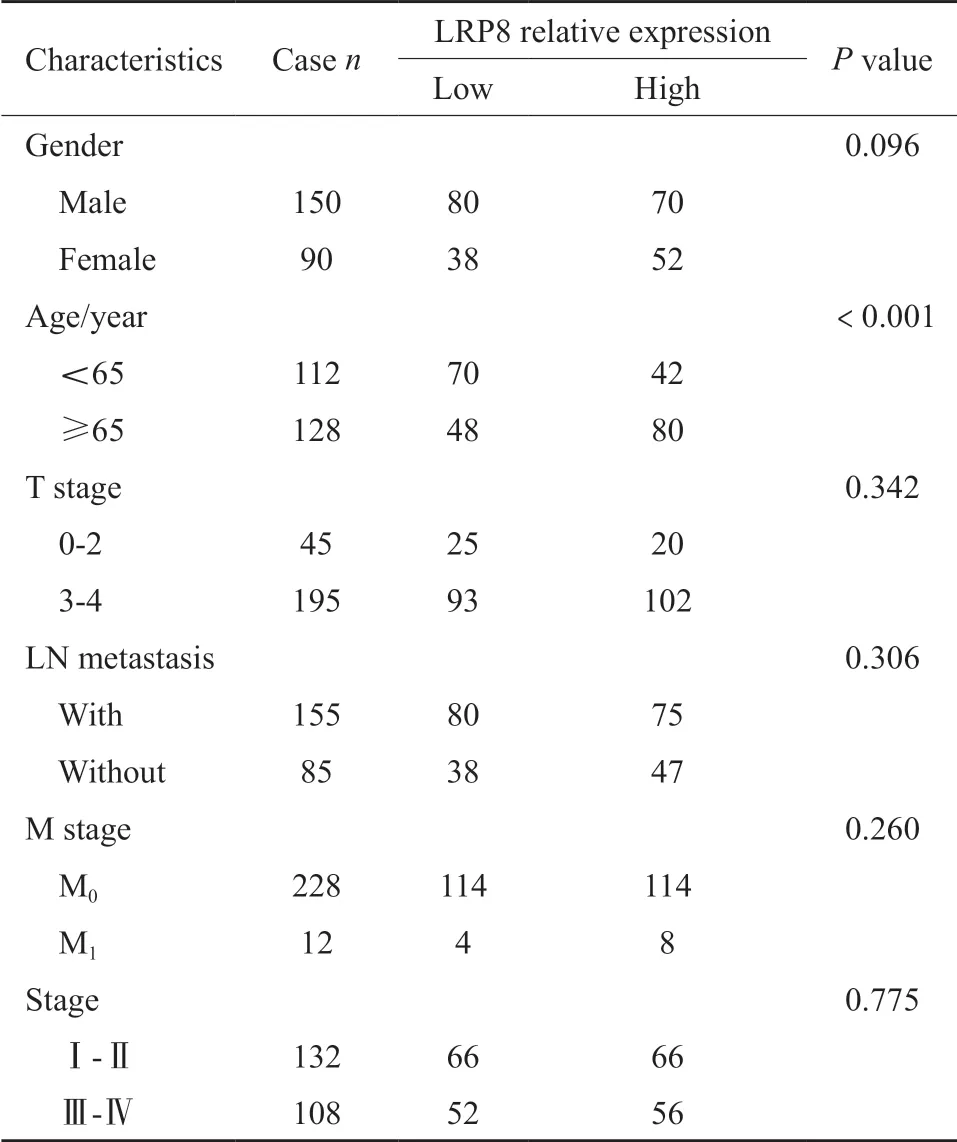
表4 TCGA数据分析LRP8表达与胃癌患者临床病理学特征的关联Tab.4 Correlation between LRP8 expression and clinicopathological features of gastric cancer in TCGA dataset(n)
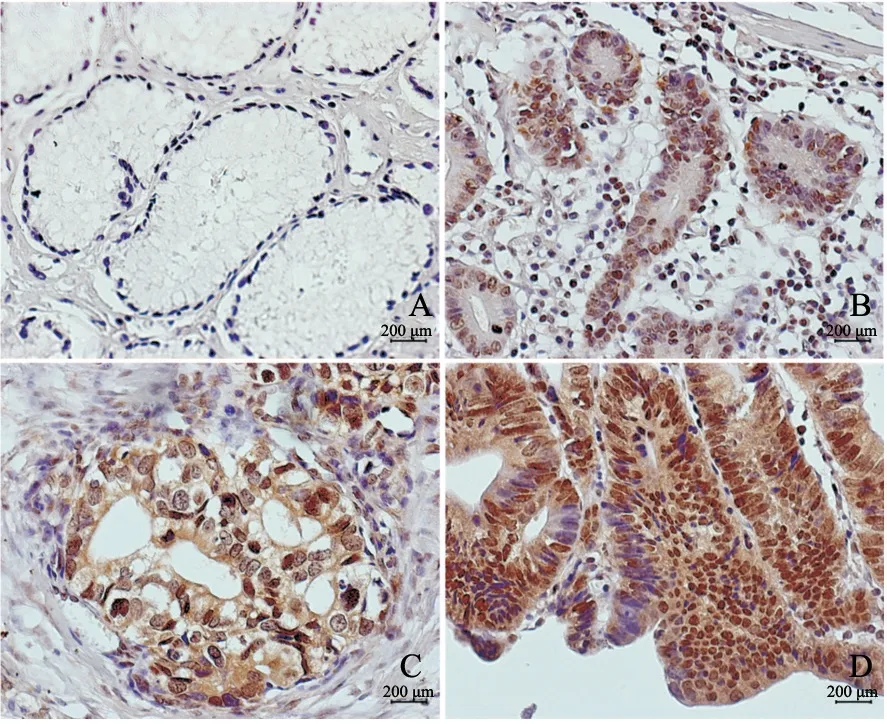
图7 具有代表性的胃癌患者肿瘤组织及癌旁组织LRP8免疫组织化学检测结果Fig.7 Representative immunohistochemistry staining of LRP8 in tumor tissues and paracancerous tissues of gastric cancer patients
3 讨 论
低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)家族成员包括LDLR及LDLR相关蛋白,如LRP1、LRP2、apoER2/LRP8、LRP3、LR P4、LR P5、LR P6以及LR32/LR P1B[9]。虽然同属一个家族,但是它们在不同的生理活动中发挥不同的效应。由于癌细胞比正常细胞需要更多的胆固醇摄取,因此通过LDLR介导的血清LDL内吞作用提高肺癌细胞内胆固醇含 量[10]。LDLR还被报道通过促进肿瘤细胞的迁移和增殖促进癌症进展[12-13]。其中LRP5、LRP6、LRP8已被广泛证明在多种肿瘤的发生过程中起重要作用[13-17]。
LRP8由7个保守的低密度脂蛋白A重复序列和3个表皮生长因子受体样结构域和β-螺旋结构组成。但关于LRP8和胃癌的关系,鲜见文献报道。我们的研究关注LRP8在胃癌中的表达及其对胃癌细胞功能之间的影响,以便寻求新的胃癌诊治靶点。本研究通过分析TCGA、GEO和Kaplan-Meier plotter数据库中的信息,来探讨LRP8在胃癌中的表达情况及其表达对胃癌患者预后的影响。我们发现,在TCGA数据库和3项研究中,胃癌组织中LRP8呈高表 达[5-6,17],共表达分析发现,LRP8与LOC100507564、SAPCD2、ODF2、E2F1、SLC1A5等20个基因有较高的共表达,进一步对表达呈正相关的前200个基因进行GO通路富集分析,LRP8在分子功能上富集在DNA指导的RNA聚合酶活性等信号转导通路,而KEGG富集分析发现LRP8富集到Wnt信号转导通路,从而可能通过调节Wnt信号转导通路来影响肿瘤细胞迁移、增殖和肿瘤进展。因此,我们研究了LRP8敲低对胃癌细胞生物学行为的影响,发现沉默LRP8表达后,AGS细胞体外增殖率及细胞迁移率均下降。为了验证LRP8是否调节Wnt信号转导通路,我们进一步检测LRP8敲低对经典Wnt信号转导通路下游靶基因的影响,发现伴随LRP8的敲低,其下游β-catenin、LRP5、POU5F1、CCND1、AXIN2的表达均出现一致性的下调,进一步证实了我们的推测。而Kaplan-Meier Plotter数据库中有两项基因芯片结果表明胃癌患者中LRP8高表达与患者不良预后相关[18]。最后通过对25例胃癌患者的肿瘤组织及其癌旁组织的免疫组织化学检测来进一步验证LRP8表达与胃癌患者临床病理学特征的相关性,发现LRP8在胃癌组织中高表达,且与胃癌分期呈正相关。对TCGA数据库中240例胃癌患者临床信息的分析发现LRP8表达与患者年龄呈正相关,而与肿瘤分期无关。
我们的研究证实了胃癌中LRP8的高表达与胃癌患者的远期生存率下降相关,提示LRP8可作为胃癌患者预后不良的生物学标志物,并可能成为胃癌靶向治疗新的分子靶点。

