NDRG2通过抑制Bcl-2表达增加膀胱癌细胞对顺铂的敏感性
李瑞晓,唐启胜,马善金,张 波,李雪莲,张志明
1.空军军医大学唐都医院泌尿外科,陕西 西安 710038;2.西安市中医医院外科,陕西 西安 710002
目前,晚期膀胱癌的治疗主要是基于顺铂(cisplatin,CDDP)的辅助治疗,在根治性膀胱切除术前/后或晚期辅以CDDP为主的化疗是目前的主要治疗手段[1]。然而,由于对化疗药物的耐药性产生,CDDP的疗效有限,化疗有效率约为50%。Bcl-2在与抗癌药物(如CDDP)诱导的DNA损伤相关的细胞凋亡中起关键作用,Bcl-2的过表达赋予了细胞多药耐药性,并且临床数据已将Bcl-2表达水平与CDDP耐药和复发性疾病联系起来[2]。N-Myc下游调节基因2(N-Myc down stream-regulated gene 2,NDRG2)是一种新发现的p53诱导基因,被认为参与DNA损伤诱导的p53相关凋亡途径并在抑制增殖中发挥作用。我们的前期研究发现,NDRG2基因的过表达可在体内/外抑制膀胱肿瘤的增殖及侵袭能力[11]。鉴于先前的研究,关于NDRG2基因在膀胱癌耐药机制的研究比较少,因此本研究旨在探讨NDRG2是否通过与Bcl-2相互作用而影响膀胱癌细胞耐药的形成,为临床治疗晚期膀胱癌提供新的思路。
1 材料和方法
1.1 细胞培养
人膀胱癌细胞系T24购自中国科学院典型培养物保藏委员会细胞库,并在含有10%胎牛血清(fetal bovine serum,FBS)的DMEM中于37 ℃、CO2体积分数为5%的温箱中培养。为了培育出抗CDDP的亚型,将T24细胞于含有CDDP(浓度递增:0.1~1.0 μg/mL)的培养基中连续传代,持续6个月。最终将CDDP抗性细胞株于含有1 μg/mL CDDP的培养基中培养。
1.2 基因修饰和转染
将编码全长NDRG2的cDNA亚克隆到pcDNA3.1载体(美国Invitrogen公司)中,通过转染构建NDRG2基因过表达T24细胞株,同时采用小干扰RNA(siRNA)技术构建NDRG2及Bcl-2基因沉默细胞株。根据制造商的说明书,使用LipofectamineTM2000(美国Invitrogen公司)用相应的分子克隆载体转染目的细胞。
1.3 蛋白质印迹法(Western blot)检测
将膀胱癌细胞溶解于蛋白裂解液[宝生物工程(大连)有限公司]提取目的细胞的总蛋白。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE)分离细胞裂解物并转移至硝酸纤维素膜。选取NDRG2、Bcl-2、多药耐药蛋白一抗(美国Santa公司)与NC膜温育过夜,然后在与目的蛋白匹配的辣根过氧化物酶(HRP)标记的二抗中温育。用计算机-荧光扫描仪系统对膜进行扫描,进行数据分析。
1.4 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
严格按照提取试剂盒(美国Invitrogen公司)操作说明进行,使用TRIzol试剂从膀胱癌细胞中提取总RNA。将提取的RNA在紫外分光光度计下检测,读取260 nm处的吸光度(D260nm)值以及D260nm/D280nm比值,按照美国Invitrogen公司反转录系统将RNA反转录合成cDNA。每个PCR程序:35个循环(对于NDRG2基因),94 ℃ 30 s,52 ℃ 40 s,72 ℃ 40 s;共25个循环(对于Bcl-2基因),在94 ℃ 30 s,62 ℃ 30 s和72 ℃ 30 s,然后72 ℃,延伸10 min。通过2-ΔΔCt法计算各组mRNA表达量并进行比较,最后进行数据分析。
1.5 细胞毒性测定
MTT法分析CDDP对膀胱癌细胞生长的影响。调整细胞浓度1×104个/mL以200 μL等分接种到96孔板中。加入不同浓度的CDDP在37 ℃下温育72 h后,向每个孔中加入20 μL的MTT溶液(5 mg/mL),并将96孔板在37 ℃下再温育4 h。然后除去培养基并用150 μL 100%DMSO代替,搅拌溶解5~10 min。使用多孔扫描分光光度计在490 nm处测量D值。细胞活力表示为未处理细胞的百分比。每种实验条件重复3次。
1.6 检测细胞凋亡
将膀胱癌细胞用CDDP(所需浓度)处理 24 h。用荧光素异硫氰酸酯标记的膜联蛋白Ⅴ和碘化丙锭染色凋亡细胞。使用荧光细胞分选仪测量凋亡细胞。
1.7 Transwell小室检测
采用transwell小室检测确定细胞的侵袭能力。将目的细胞培养48 h后收集细胞。将细胞(2×104个细胞/孔)重悬于200 µL无血清培养基中,并置于上室中。底部腔室覆盖有500 µL RPMI-1640和20%FBS。温育36 h后,将膜固定并分别使用4%多聚甲醛和结晶紫染色。然后在光学显微镜下计数侵袭的细胞。所有实验均包括3个独立的重复。
1.8 统计学处理
选用统计学软件SPSS 19.0进行数据分析,数据表示为。通过使用单向ANOVA及组间χ2检验来进行统计学分析。P<0.05为差异有统计学 意义。
2 结果
2.1 CDDP不同浓度处理下T24、T24/CR细胞中NDRG2蛋白的表达情况
通过浓度递增的方式用CDDP处理膀胱癌T24细胞,然后通过分光光度法评估不同浓度CDDP处理T24细胞和CDDP抗性细胞(表示为T24/CR)的活力状态以及NDRG2蛋白的表达水平。结果发现,在浓度<1 μg/mL时,T24/CR细胞具有继续生长的抗性(图1A)。Western blot结果显示,与亲代T24细胞相比,T24/CR细胞中NDRG2的表达水平显著下调(图1B)。此外,低浓度CDDP处理T24细胞,发现其以时间依赖性方式刺激NDRG2表达(图1C)。
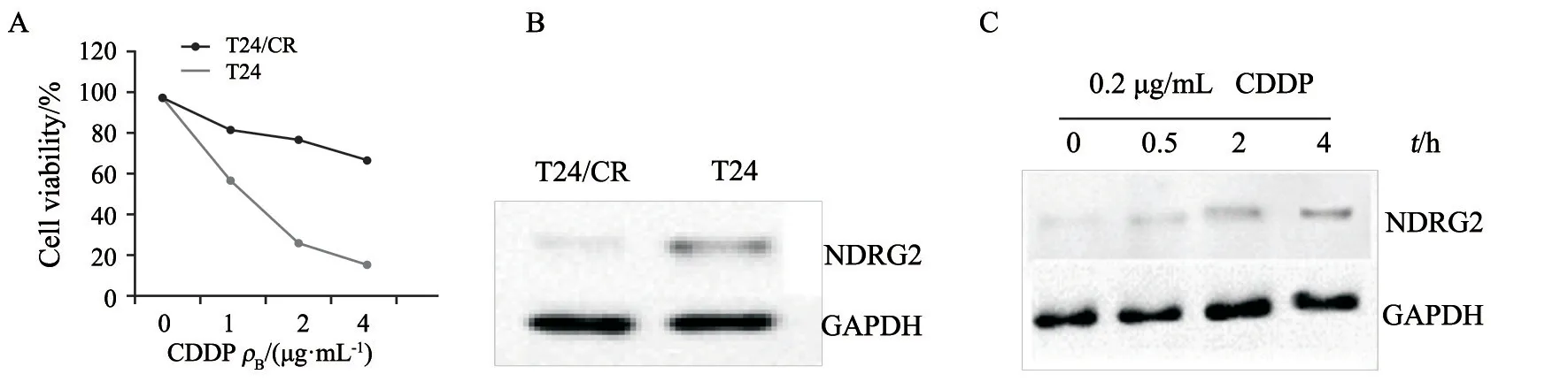
图1 CDDP耐药的产生影响NDRG2蛋白的表达Fig.1 The development of CDDP resistance affects the expression of NDRG2
2.2 NDRG2蛋白过表达增强了T24细胞中CDDP的敏感性
将外源性NDRG2基因转染至T24/CR细胞中并使其稳定过表达(图2A)。通过MTT及凋亡检测证实,实验组中T24/CR细胞的增殖受到显著抑制,凋亡比例增加(图2B、C);在细胞侵袭实验中,实验组T24/CR细胞的侵袭受到显著抑制(图3)。这些研究结果表明,NDRG2蛋白的过表达可增强CDDP抗T24细胞的敏感性。
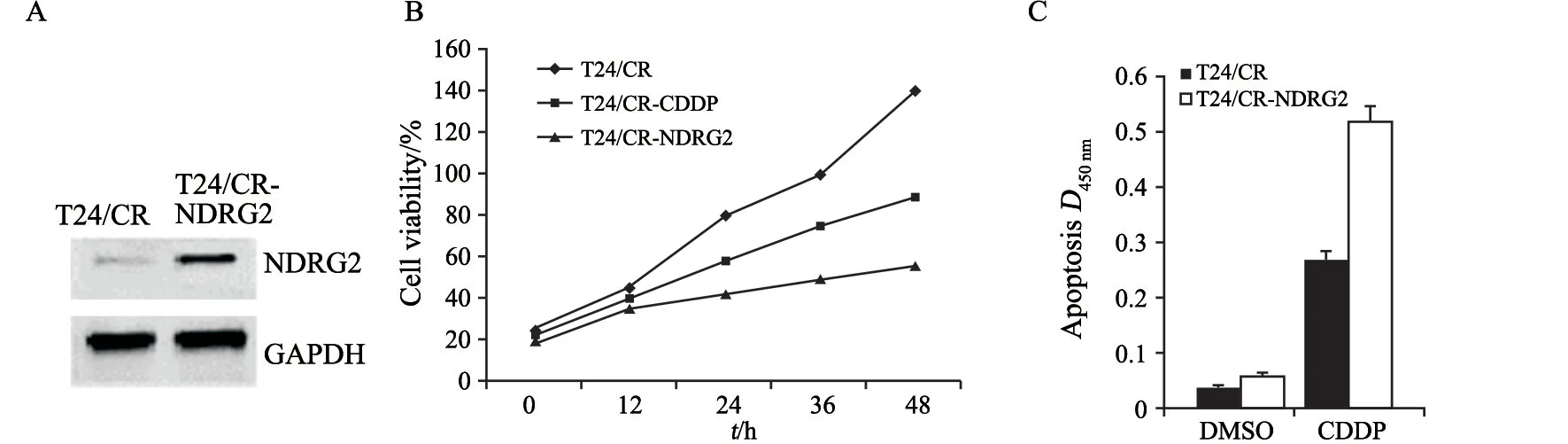
图2 NDRG2过表达可以影响T24/CR细胞的活力及凋亡水平Fig.2 Overexpression of NDRG2 could affect the viability and apoptosis of T24/CR cells
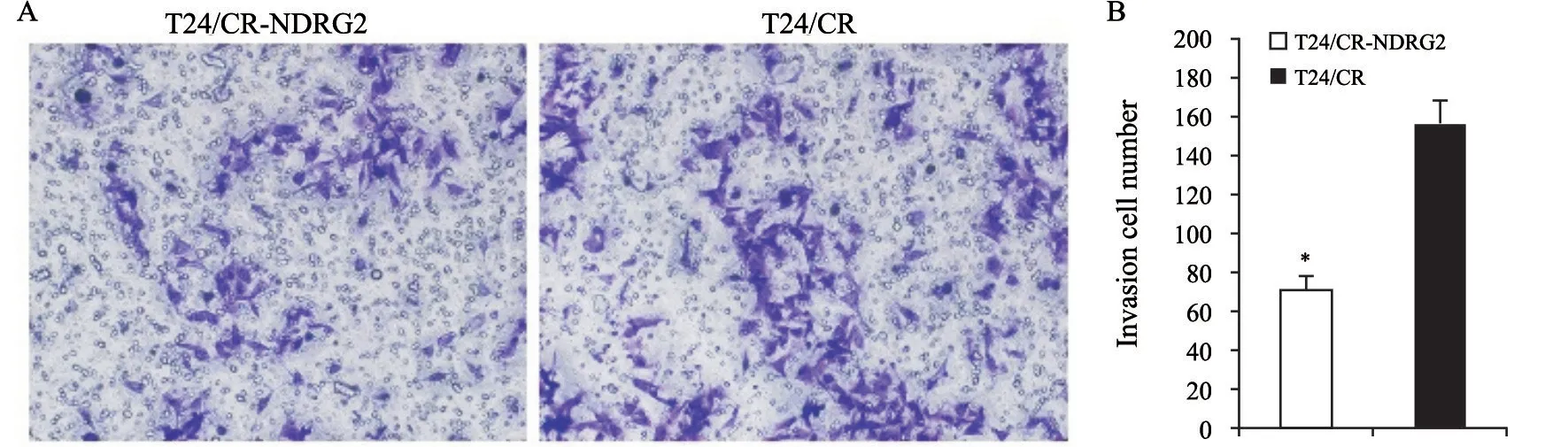
图3 NDRG2过表达可抑制T24/CR耐CDDP细胞侵袭能力Fig.3 Overexpression of NDRG2 could inhibit resistance to cisplatin in T24/CR cells
2.3 过表达NDRG2抑制T24/CR细胞中Bcl-2的表达
为了进一步说明NDRG2蛋白在CDDP诱导的细胞凋亡中的作用,通过Western blot检测T24/CR细胞中Bcl-2的表达。与T24/CR细胞相比,过表达实验组T24/CR细胞中,Bcl-2的表达受到抑制,P-糖蛋白和多药耐药蛋白的表达未受明显影响(图4),通过shRNA转染使NDRG2在T24细胞中低/不表达。随后用Bcl-2-siRNA瞬时转染下调了NDRG2在T24细胞中的表达,并使Bcl-2表达上调,结果显示对NDRG2的表达没有影响(图5A),表明NDRG2可能作用于Bcl-2信号转导的上游。
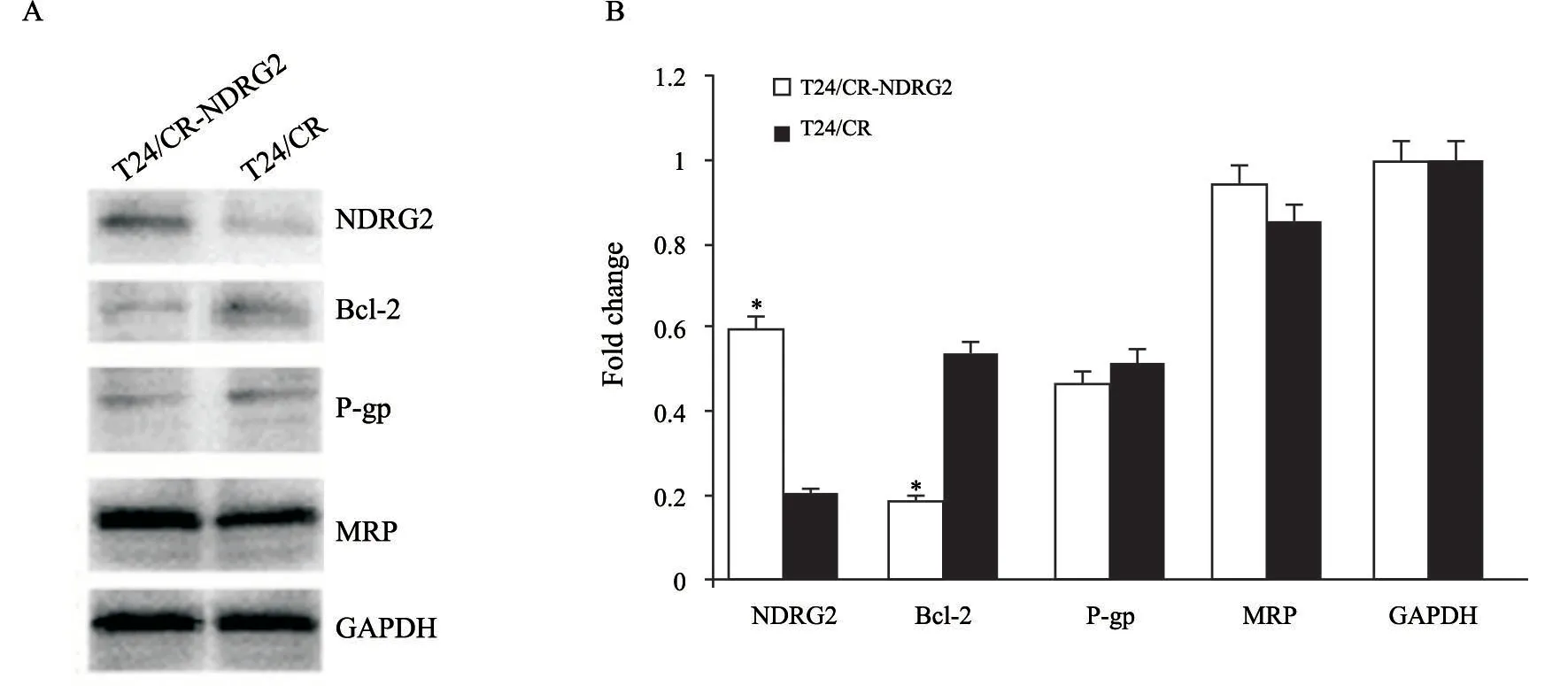
图4 NDRG2 过表达可抑制T24耐CDDP细胞中Bcl-2的表达Fig.4 Overexpression of NDRG2 could inhibit the expression of Bcl-2 in T24/CR cells
2.4 Bcl-2基因的抑制修复了NDRG2基因的缺陷,恢复膀胱癌细胞对CDDP的敏感性
我们研究了NDRG2对Bcl-2基因的激活是否通过改变T24细胞活力和细胞凋亡而引起CDDP抗性。用0.5 μg/mL CDDP温育24 h导致T24细胞活力显著降低和诱导细胞凋亡,而NDRG2的表达抑制导致T24细胞活力增强和凋亡减弱而引起明显的CDDP抗性。更重要的是,下调Bcl-2的表达可有效解除NDRG2低表达对T24细胞活力和凋亡的影响,并恢复CDDP对T24细胞的敏感性(图5B、C);反过来,增加NDRG2的表达,可增强CDDP诱导T24细胞凋亡的敏感性。
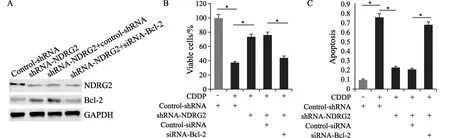
图5 NDRG2调节Bcl-2的表达Fig.5 NDRG2 regulated the expression of Bcl-2
3 讨 论
铂类药物,特别是CDDP,被广泛用于治疗多种实体恶性肿瘤,包括膀胱癌。然而,一些肿瘤患者在治疗前或治疗过程中会出现对CDDP的耐药性。CDDP的耐药率高也是肿瘤患者化疗失败的主要原因。虽然最近提出了CDDP耐药的靶前、靶上、靶后和脱靶机制学说[3],但CDDP耐药的分子机制仍不完全清楚。
Bcl-2在线粒体凋亡中起关键作用,Bcl-2的表达可以预测接受放化疗的晚期膀胱癌患者的存活率[12],Bcl-2蛋白表达的上调可能是膀胱癌细胞出现CDDP耐药的机制之一,通过下调Bcl-2的表达有助于逆转膀胱癌细胞对CDDP耐药 性[13]。NDRG2对细胞功能的调节有两种相反报道,NDRG2在局灶性脑缺血中表现出抗细胞凋亡功能[4],并且在乳腺癌细胞中具有一定的放射抗性[5]。相反,它在尿路上皮癌[6]、乳腺癌细胞[7]、肝癌[8]中表现出促凋亡的功能。研究[12]发现,敲除NDRG2基因可抑制Bcl-2的表达,从而增加宫颈癌HeLa细胞CDDP敏感 性。我们的前期研究已经证实,NDRG2在膀胱癌中发挥着重要的作用,NDRG2在膀胱癌组织中低表达,并且与患者生存呈负相关,体内/外实验证实,过表达NDRG2可抑制膀胱癌细胞的增殖及侵袭能力[11]。因此,本研究旨在探讨NDRG2可否增加膀胱癌细胞对CDDP的敏感性,从而改善膀胱癌患者的预后和生存率。本研究表明,过表达NDRG2可显著抑制Bcl-2的表达,NDRG2可能通过抑制Bcl-2的表达而诱导膀胱癌细胞的凋亡。NDRG2在转录后水平调节Bcl-2表达。已有研究[9]表明,Bcl-2可被胃癌细胞中的microRNA(如miR-15b和miR-16)靶向和调节。这些microRNA与Bcl-2 mRNA的3’非翻译区结合,抑制Bcl-2蛋白的翻译而不改变mRNA表达。Bcl-2的上调是某些肿瘤对放化疗产生耐药的原因之一[10]。然而,目前对化疗反应中控制Bcl表达的转录后或翻译后调控机制知之甚少。
本研究发现,上调NDRG2的表达后,T24/CR耐药细胞的凋亡比例增加,且侵袭性受到抑制,同时Bcl-2的表达受到抑制。是否NDRG2的表达调节了Bcl-2的表达,我们进一步进行了验证,通过siRNA技术使NDRG2在T24细胞中低/不表达。更重要的是,下调Bcl-2的表达可有效解除NDRG2低表达对T24细胞活力和凋亡的影响,并恢复CDDP对T24细胞的敏感性;反过来,增加NDRG2的表达,可增强CDDP诱导T24细胞凋亡的敏感性。
研究表明,NDRG2与CDDP的敏感性增加有关,而细胞的耐药与诱导细胞凋亡的Bcl-2有关,本研究证实NDRG2可调控Bcl-2的表达从而增加膀胱癌CDDP敏感性。这些数据可以帮助我们更好地了解CDDP耐药的分子机制以及NDRG2在肿瘤发展中的确切作用。

