全反式视黄酸对视网膜色素上皮细胞内质网应激反应的诱导作用及途径
吴 娟,曾骏文,崔冬梅
0引言
年龄相关性黄斑病变(age-related macular degeneration,ARMD)是视网膜黄斑区光感受细胞凋亡导致中央视力缺失的一种眼部疾病。ARMD的光感受器凋亡主要由于视网膜色素上皮(retinal pigment epithelial,RPE)细胞失去向光感受器提供氧气和营养,并运走废物质的功能导致[1]。由于RPE特殊的解剖位置、高代谢活性以及对光感受器外段的吞噬作用,使得RPE尤其容易受到伤害[2-3]。全反式视黄酸(ATRA)是视觉循环中不可缺少的部分,作为视网膜内的一种内源性化合物,ATRA通常通过RDH(如RDH11)还原而被清除,或形成一系列困在RPE溶酶体中的视网膜衍生物[4-6]。ATRA在RPE细胞内的过度积累导致细胞毒性并导致细胞凋亡[7-8],并在眼底变性疾病的病因中起到作用。以往的研究表明,由ATRA诱导并通过还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶介导的活性氧(ROS)产生参与了光感受器和RPE细胞的变性退化[9]。但关于RPE细胞变性的分子机制仍不清楚。本课题组在之前的研究中已证实ATRA过度累积导致caspase12被激活,caspase12与内质网应激反应(ERS)关系密切,本文通过对ERS进一步研究了ATRA诱导的ARPE-19凋亡的过程。证明ATRA过度累积激活了ERS中PERK-EIF2α-ATF4及IRE1α-XBP1信号途径,抑制了ATF6信号途径。我们的发现为视网膜病变中的ATRA毒性提供了新的见解。
1材料和方法
1.1材料ARPE-19细胞(美国ATCC细胞库);DMEM/F12培养基(Gibco);胎牛血清、全反式视黄酸(ATRA)(Sigma);蛋白印迹检测系统(merck);Trizol试剂(Invitrogen);Brilliant SYBR Green试剂盒(Takara);引物序列(上海生工科技公司);抗BIP抗体(CST3177)、抗CHOP抗体(CST2895)、抗GAPDH抗体(CST5174);cfx96实时聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测系统(Bio-Rad);Bio-Rad Quantity One成像软件(Bio-Rad);酶标仪(日本OLYMPUS公司);激光共聚焦光谱显微镜(Zeiss)。
1.2方法
1.2.1细胞培养本研究不涉及人体或动物实验,ARPE-19细胞购自美国ATCC细胞库。ARPE-19细胞在DMEM/F12中常规培养,辅以10% BSA,青-链霉素(100μg/mL)。细胞在37℃下含5%二氧化碳的加湿培养箱中培养。每2~3d更换一次培养基。细胞采用含0.25% EDTA的胰蛋白酶于培养箱中消化2min,并以1∶4~1∶6的比例接种于25mm2培养瓶中进行传代培养。取对数生长期的细胞用于后续实验。将ATRA溶解于二甲基亚砜(DMSO)中至10μmol/L的储备浓度。用DMEM/F12稀释ATRA至工作浓度,在-20℃下冷冻成小份,避免光照。
1.2.2 qRT-PCR检测取ARPE-19细胞以2.5×105/mL密度接种于6孔板,用不同浓度的ATRA(0、2.5、5、10、20μmol/L)分别处理ARPE-19细胞24h后收集细胞,并按ATRA浓度分为五组,包括对照组(0μmol/L)和四个浓度实验组,按PureLink RNA mini kit试剂盒的操作说明提取总的RNA,Trizol试剂纯化细胞RNA,逆转录试剂盒逆转录合成cDNA。qRT-PCR检测基因表达情况,配制20μL PCR体系,反应条件:95℃ 10min,95℃ 15s,60℃ 50s,60℃ 50s,40个循环,GAPDH为内参基因,2-ΔΔCT法计算靶基因的相对表达水平。所有样本重复检测3次,取平均值。引物序列由中国上海生工科技公司提供,见表1。
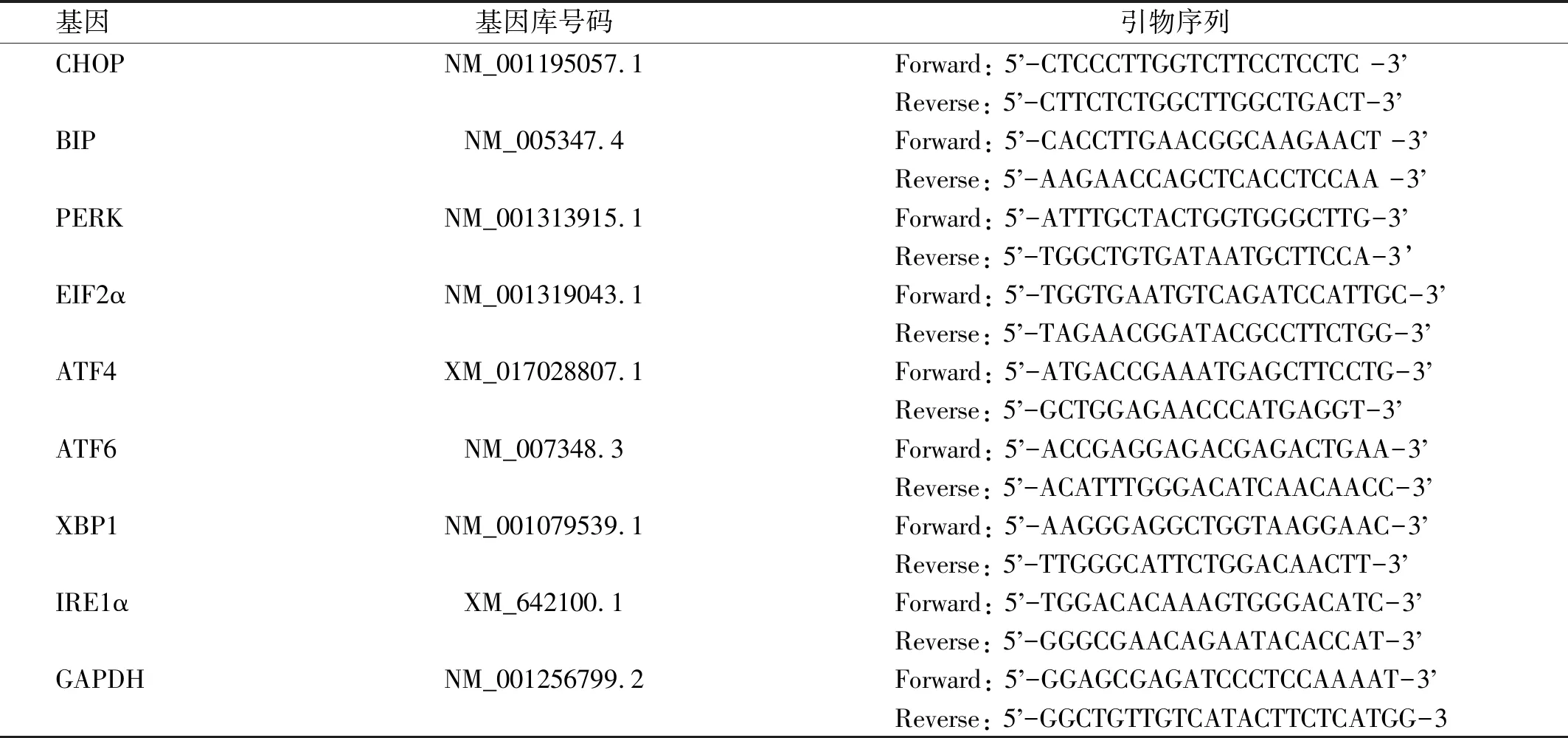
表1 实时定量PCR中引物序列
1.2.3蛋白质印迹分析用不同浓度的ATRA(0、2.5、5、10、15、20μmol/L)处理ARPE-19细胞24h收集细胞。然后用PBS洗涤,并用RIPA裂解缓冲液溶解,然后在4℃以14000r/min离心15min。上清液蛋白采用SDS-PAGE凝胶电泳。转膜,并在室温下用5%脱脂牛奶封闭1h。CHOP(1∶1000)、BIP(1∶1000)一抗孵育,辣根过氧化物酶(HRP)结合山羊抗鼠或山羊抗兔二抗孵育,采用ECL蛋白印迹检测系统观察条带,并使用Bio-Rad Quantity One成像软件分析条带。
1.2.4免疫荧光检测用ATRA(10μmol/L)处理ARPE-19细胞24h收集细胞。在PBS中洗涤3次后,用4%多聚甲醛固定15min,然后在含有1%胎牛血清(BSA)和0.1% Triton X-100的PBS室温中放置2h,加入CHOP(1∶200)和BIP(1∶400)4℃湿盒内孵育过夜,次日用PBS洗涤3次,每次5min,用抗兔或抗鼠二抗(1∶400)孵育1h。用DAPI(5mg/mL)染色细胞核10min,用PBS洗涤后,抗荧光衰减剂封片,激光共聚焦光谱显微镜观察并拍照,图片放大倍数1000,拍摄图片比例尺寸为20μm。
统计学分析:采用统计学软件SPSS 22.0对数据进行统计学分析,并用GraphPad Prism 7作图。本研究中测量指标的计量资料经W检验呈正态分布,经Levene检验方差齐性。对照组与不同浓度实验组间差异总体比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2结果
2.1 ATRA处理ARPE-19细胞后引起ERSCHOP、BIP为ERS的标志性蛋白。用不同浓度的ATRA(0、2.5、5、10、15、20μmol/L)处理ARPE-19细胞24h后,免疫荧光法检测结果提示,ATRA诱导了CHOP(图1A)和BIP(图1B)的产生。Western blot法检测蛋白表达结果见图1C,分析显示CHOP(图1D)、BIP(图1F)蛋白表达随着ATRA浓度累积而上调;同时CHOP(图1E)、BIP(图1G)的mRNA表达也升高。通过3次独立实验,检测的不同组间CHOP蛋白水平比较,差异有统计学意义(F=19.61,P<0.001),当ATRA浓度在2.5、5、10、15、20μmol/L时,CHOP蛋白的产生较对照组显著升高,差异有统计学意义(P=0.009、0.003、0.005、<0.001、<0.001);检测的不同组间BIP蛋白水平比较,差异有统计学意义(F=21.07,P<0.001),当ATRA浓度在2.5、5、10、15、20μmol/L时,CHOP蛋白的产生较对照组呈浓度依赖性升高,差异有统计学意义(P=0.004、0.039、0.019、0.0019、<0.001);检测的不同组间CHOP的mRNA水平比较,差异有统计学意义(F=770.6,P<0.001),当ATRA浓度在5、10、20μmol/L时,CHOP的mRNA水平较对照组升高,差异均有统计学意义(P<0.001);检测的不同组间BIP的mRNA水平比较,差异有统计学意义(F=7.49,P<0.001),当ATRA浓度在2.5μmol/L时,BIP的mRNA水平较对照组下降,差异有统计学意义(P<0.001);当ATRA浓度在5、10μmol/L时,BIP的mRNA水平较对照组上升,差异有统计学意义(P=0.048、<0.001),见表2。
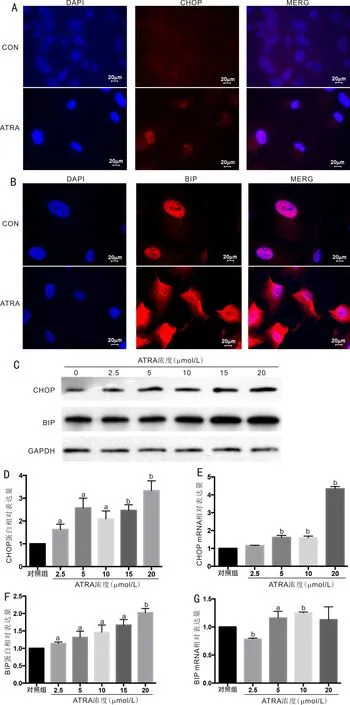
图1 ERS蛋白及mRNA表达 A,B:免疫荧光法CHOP和BIP蛋白表达;C:用不同浓度的ATRA处理ARPE-19 24h,CHOP,BIP的蛋白质印迹表达; D,F:与对照组相比,ATRA增加CHOP和BIP蛋白水平;E,G:qRT-PCR检测随着ATRA累积,CHOP和BIP的mRNA表达增加。DAPI:2-(4-氨基苯基)-6-吲哚甲酰胺二盐酸盐;CON:对照组;aP<0.05,bP<0.001 vs 对照组。

表2 不同浓度ATRA对ERS标志性蛋白CHOP、BIP的蛋白及mRNA表达水平的影响
2.2 ERS三条主要通路反应
2.2.1 PERK-EIF2α-ATF4通路PERK,EIF2α,ATF4为ERS下游PERK-EIF2α-ATF4通路的标志性蛋白,用不同浓度的ATRA(0、2.5、5、10、20μmol/L)处理ARPE-19细胞24h后,PERK(图2A),EIF2α(图2B)、ATF4(图2C)的mRNA表达水平较对照组上调,差异均有统计学意义(P<0.001),证明ATRA过度累积激活ARPE-19细胞ERS中的PERK-EIF2α-ATF4通路。通过3次独立实验,检测的不同组间PERK的mRNA水平比较,差异有统计学意义(F=26.95,P<0.001),当ATRA浓度在2.5、5、10、20μmol/L时,PERK的mRNA水平较对照组水平上升,差异均有统计学意义(P<0.001);检测的不同组间EIF2α的mRNA水平比较,差异有统计学意义(F=55.06,P<0.001),当ATRA浓度在2.5、5、10、20μmol/L时,EIF2α的mRNA水平较对照组水平上升,差异均有统计学意义(P<0.001);检测的不同组间ATF4的mRNA水平比较,差异有统计学意义(F=140.5,P<0.001),当ATRA浓度在2.5、5、10、20μmol/L时,ATF4的mRNA水平较对照组水平上升,差异均有统计学意义(P<0.001),见表3。

图2 不同浓度的ATRA处理ARPE-19细胞24h,PERK-EIF2α-ATF4通路中PERK,EIF2α,ATF4 mRNA的表达水平
2.2.2 IRE1α-XBP1通路IRE1α,XBP1为ERS下游IRE1α-XBP1通路的标志性蛋白,用不同浓度的ATRA(0、2.5、5、10、20μmol/L)处理ARPE-19细胞24h后,XBP1(图3A),IRE1α(图3B)的mRNA水平表达水平较对照组上调,差异均有统计学意义(P<0.001),证明ATRA过度累积激活ARPE-19细胞ERS中的IRE1α-XBP1通路。通过3次独立实验,检测的不同组间IRE1α的mRNA水平比较,差异有统计学意义(F=43.08,P<0.001),当ATRA浓度在10、20μmol/L时,IRE1α的mRNA水平较对照组水平上升,差异均有统计学意义(P<0.001);检测的不同组间XBP1的mRNA水平比较,差异有统计学意义(F=19.90,P<0.001),当ATRA浓度在2.5、5、10、20μmol/L时,XBP1的mRNA水平较对照组水平上升,差异均有统计学意义(P<0.001),见表3。

图3 不同浓度的ATRA处理ARPE-19细胞24h,IRE1α-XBP1通路中IRE1α,XBP1 mRNA表达水平 A:XBP1 mRNA表达水平;B:IRE1α mRNA表达水平。bP<0.001 vs 对照组。

表3 不同浓度ATRA对ERS三条通路标志性蛋白的mRNA表达水平的影响
2.2.3 ATF6通路ATF6为ERS下游ATF6通路的标志性蛋白,用不同浓度的ATRA(0、2.5、5、10、20μmol/L)处理ARPE-19细胞24h后,ATF6的mRNA水平较对照组差异无统计学意义(P=0.36、0.24、0.58、0.61,图4,表3),证明ATRA过度累积未激活ARPE-19细胞ERS中的ATF6通路。通过三次独立实验,检测的不同组间ATF6的mRNA水平比较,差异无统计学意义(F=0.74,P>0.05)。

图4 不同浓度的ATRA处理ARPE-19细胞24h,ATF6通路中ATF6 mRNA表达水平。
3讨论
ERS与氧化应激、血管生成和细胞凋亡相关,被认为是ARMD发生发展的关键致病机制[10]。ERS和未折叠蛋白反应(UPR)可由ARMD危险因素(如氧化、蛋白质毒性和代谢应激)和细胞因子引起,对视网膜变性疾病的研究证明,在其中RPE细胞中存在错误折叠的蛋白质分子[11]。UPR的主要功能是维持正常的内质网功能和保护细胞免受环境损伤[12],其中大部分和ERS相关的途径是由BIP调节的[13-14]。BIP是一种重要的内质网伴侣,调节ERS相关通路,并防止错误折叠和展开的蛋白质的积累,其表达是由ERS和错误折叠的蛋白质触发的[15-16]。这个重要的内质网伴侣防止错误折叠和未折叠蛋白的积累,其表达是由ERS和错误折叠蛋白触发的[17-18]。在我们的研究中,经ATRA处理后的ARPE-19细胞中的BIP表达水平升高,说明ERS参与了这一实验过程。关于未折叠蛋白反应的信号途径,ERS传感器引发的三种途径(PERK、IRE1α和ATF6)在细胞ERS方面最受关注[19]。大多数数据支持这样一种观点,即CHOP是由PERK/EIF2α/ATF4以及IRE1α/XBP1和ATF6亚通路诱导的,从而激活促凋亡基因表达、恢复翻译起始并增加内腔的氧化电位[20]。CHOP是ERS时ATF4转录因子的主要靶点和细胞凋亡的执行者[11]。CHOP的许多转录靶点也与介导细胞凋亡有关。其中包括Ero1α、GADD34和BIM。BIM是一个仅BH3结构域的基因,启动线粒体凋亡途径,导致线粒体膜电势(Δψm)下降。任何通过线粒体呼吸链的电子传递损伤都会导致氧的不完全还原,最终导致ROS的形成[21]。CHOP在ERS期间介导了Ero1α表达的激活,从而加重了应激细胞内质网中ROS的积累[22]。除了PERK介导的UPR外,研究还发现IRE1α有助于ERS应激诱导的细胞死亡[23]。IRE1α有一个RNase结构域,在ERS应激下激活,Oakes等发现IRE1α切割了通常抑制caspase 2合成的microRNA[24],从而引起caspase 2水平升高,最终导致细胞死亡[25]。也有研究发现在人脐静脉内皮细胞中当IRE1α途径被激活,CHOP表达也会自发激活,ROS生成增加,IRE1α抑制剂STF-083010可有效降低CHOP的表达水平及ROS水平[26]。说明PERK及IRE1α介导的UPR均可能诱导CHOP的表达,并进一步导致ROS的积累。在本研究中,ATRA通过PERK-EIF2α-ATF4信号通路和IRE1α-XBP1信号通路激活细胞ERS。随着ATRA浓度的升高,相关通路的mRNA表达也随之升高。当以最高剂量孵育时,PERK相关mRNA的表达趋势会变小,这可能归因于负反馈回路。PERK激活在数小时内诱导ATF4,并且在不久后诱导ATF4的转录靶点,PERK/ATF4信号也具有负反馈环,在1~2d内抑制其活性[27]。先前的研究表明,EIF2α抑制剂Salubrinal,能显著降低ATRA诱导的RPE细胞凋亡水平[28],与本文研究结果相符。ATRA介导的活性氧过度产生是ERS诱导的RPE细胞凋亡的早期事件,并且通过抗氧化作用清除活性氧。抗氧化剂可能是一种有效地保护视网膜细胞免受过量ATRA侵害的策略。
尽管ATRA对视力是必不可少的,但这种分子在RPE细胞内的过度积累会导致细胞毒性。本研究从ERS的角度进行阐述,扩大了我们关于ATRA对人RPE细胞毒性的认识,在减轻ATRA对细胞器有害作用的基础上,为靶向治疗开辟了新的途径。
- 国际眼科杂志的其它文章
- An overview on dry eye disease diagnosis: options for new non-invasive testing technologies
- Change of subretinal fluid thickness and choroidal thickness after scleral buckling surgery
- 人翼状胬肉中miR-486-3p的表达及其潜在靶基因的生物信息学分析
- 重组人生长激素对兔角膜损伤早期修复的研究
- 基于SD-OCT建立新的前膜分级法评估IMEM对年龄相关性白内障患者术后视功能的影响
- 氯喹性视网膜病变的监测方法

