响应面优化酿酒酵母与窖泥酯化细菌协同发酵产丁酸乙酯和己酸乙酯
郭 燕,邓 杰,,任志强,黄治国,,卫春会,,*,黄明才
(1.四川轻化工大学 酿酒生物技术及应用四川省重点实验室,四川 宜宾 643000;2.水富古渡酒业有限公司专家工作站,云南 水富 657800)
乙酸乙酯、乳酸乙酯、丁酸乙酯和己酸乙酯是浓香型白酒的主体香微量成分,约占总酯含量的90%[1]。其中,己酸乙酯对浓香型白酒的贡献最大。己酸是合成己酸乙酯的前体物,因此通过提高浓香型白酒发酵过程中己酸产量来提升浓香型白酒的品质成为了当前研究热点[2-4]。据报道,白酒酿造过程中酯类物质主要由以下2 种途径合成:一种是微生物在自身胞内酶的作用下合成酯类物质[5-7];而作用最为广泛的是另一种途径,即酯类物质通过微生物分泌的胞外酶将周围环境中的有机酸和醇类物质催化合成[8-11]。此外,酒体中酸类物质和醇类物质在自然条件下也能发生酯化作用,但速率及产量远不如上述2 种途径[12-13]。
能将酸类物质和醇类物质进行酯化的微生物统称为酯化菌。目前,参与白酒发酵过程中的酵母菌、细菌和霉菌中均有酯化菌的相关报道,但主要集中在酒曲和酒醅环境中[14-16]。同时,对于这些具有产酯化酶或酯化能力菌株的研究均是在脱离发酵糟醅情况下开展,与生产实际差异较大[17]。而泥窖是我国浓香型白酒特有的发酵容器,且窖泥中微生物的代谢特征及其代谢产物对浓香型白酒质量有重要影响[18-20]。此外,在窖池中,固态发酵结果的再现性比液态发酵好[21]。因此,本研究采用固态发酵法,以窖泥中分离出来的3 株酯化细菌与酿酒酵母为菌种,优化其发酵生产己酸乙酯和丁酸乙酯的工艺,以期为提高浓香型白酒质量提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
拜氏梭菌(Clostridium beijerinckii)、广西梭菌(C. guangxiense)、煎盘梭菌(C. sartagoforme)和酿酒酵母(Saccharomyces cerevisiae)由酿酒微生物技术与应用四川省重点实验室分别从窖泥和大曲中分离得到。
高粱、糠壳,马铃薯 市售;酵母浸粉、蛋白胨、琼脂粉、乙酸钠、磷酸二氢钾、氯化钠、碳酸氢钠、硫酸钠、CaCl2·2H2O、MgCl2·6H2O、葡萄糖、丁酸钠、氢氧化钠、盐酸(分析纯) 成都艾科达化学试剂有限公司;MSE琼脂培养基(mayeux,sandine and elliker agar,MSE)粉、L-半胱氨酸盐酸盐 北京索莱宝科技有限公司;α-淀粉酶(1×104U/g)、糖化酶(1×105U/g)江苏博立生物制品有限公司;乙酸正丁酯、丁酸乙酯、己酸乙酯(色谱纯) 上海安谱实验科技股份有限公司;叠氮化钠、柠檬酸钠、明胶、蔗糖(分析纯) 成都市科隆化学品有限公司。
MSE培养基:酵母提取物5.00 g/L、葡萄糖5.00 g/L、叠氮化钠75.00 mg/L、柠檬酸钠1.00 g/L、胰蛋白胨10.00 g/L、明胶2.50 g/L、蔗糖100 g/L、pH 6.90、琼脂粉15.00 g/L、MSE粉 0.50 g/L。
酯化菌种子培养基:MSE粉0.50 g/L、L-半胱氨酸盐酸盐0.25 g/L、乙酸钠1.00 g/L、磷酸二氢钾0.50 g/L、氯化钠1.00 g/L、碳酸氢钠0.30 g/L、硫酸钠0.50 g/L、CaCl2·2H2O 0.15 g/L、MgCl2·6H2O 0.40 g/L、酵母浸粉1.00 g/L、蛋白胨1.50 g/L、葡萄糖3.00 g/L、丁酸钠2.00 g/L,用5 mol/L NaOH溶液将酯化菌种子培养的pH值调到5.50。
马铃薯葡萄糖培养基(potato dextrose agar,PDA):马铃薯200.00 g/L,葡萄糖20.00 g/L,自然pH值。
高粱发酵培养基:将高粱粉碎至4~6 瓣,配入质量分数40%的糠壳混匀,加入少许水润湿并蒸至有高粱香,冷却后置于水浴锅中加入质量分数0.1%α-淀粉酶和质量分数0.1%糖化酶,水分调节至培养基发酵前初始物量料质量分数的75%,酸度调至2.40 mmol/100 g。
1.2 仪器与设备
AR2140电子分析天平 梅特勒-托利多仪器有限公司;LRH-250生化培养箱 上海齐欣科学仪器有限公司;7890A-5975B气相色谱-质谱联用仪 美国Agilent公司;HT300A固相微萃取仪 意大利HTA公司;AW200SG厌氧工作站 金坛市科技分析仪器有限公司;CI54DS立式压力蒸汽灭菌锅 厦门仪器有限公司;50/30 μm二乙烯丙基/碳分子筛/聚二甲基烷氧基(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取头 上海安谱实验科技股份有限公司。
1.3 方法
1.3.1 菌株的活化
将拜氏梭菌、广西梭菌和煎盘梭菌划线接种于酯化菌种子固体培养基上,于34 ℃,厌氧培养5 d;将酵母菌划线接种于PDA固体培养基上,于30 ℃培养3 d。
1.3.2 种子液的制备
将活化后的拜氏梭菌、广西梭菌和煎盘梭菌各挑取一环分别接于100 mL酯化菌液体种子培养基中,于34 ℃,厌氧条件下将活细胞分别培养至3.70×106、1.35×106、4.35×106CFU/mL,按体积比1∶1∶1进行混合制得酯化菌种子液;将活化后的酵母菌挑取一环接入100 mL PDA液体培养基中,于30 ℃,100 r/min培养至OD600nm值为1.5。
1.3.3 协同发酵实验
在厌氧条件下,按5%接种量将酵母菌种子液接于35 g灭菌后的高粱发酵培养基中,34 ℃培养2 d后,再接入质量分数5%酯化菌种子液,于34 ℃发酵12 d后测定己酸乙酯和丁酸乙酯的产量。以添加质量分数2%无水乙醇代替质量分数5%酵母菌种子液,发酵过程只添加质量分数5%酵母菌种子液、质量分数5%酯化菌种子液和质量分数2%无水乙醇,以及空白培养基为对照组。
1.3.4 酯化菌种子液接种时间的确定
为保证酯化菌的厌氧发酵环境,高粱发酵培养基在酿酒酵母接种2 d后,每间隔6 h接入质量分数5%的酯化菌种子液,共设置6 个时间梯度为48、52、56、60、64、68 h,分别置于34 ℃厌氧环境中发酵12 d,以己酸乙酯和丁酸乙酯的产量为指标,确定酯化菌种子液的最佳接种时间。
1.3.5 发酵条件优化
1.3.5.1 单因素试验
在发酵培养基的基础上,选择酯化菌种子液的接种量分别为1.00%、3.00%、5.00%、7.00%、9.00%、11.00%;高粱发酵培养基的水分质量分数分别为65.00%、70.00%、75.00%、80.00%、85.00%、90.00%;高粱发酵培养基的酸度分别为2.00、2.20、2.40、2.60、2.80、3.00 mmol/100 g;发酵温度分别为24、28、32、36、40、44 ℃,在厌氧条件下发酵12 d,以己酸乙酯和丁酸乙酯的产量为指标,确定各因素的最佳发酵条件。
1.3.5.2 优化发酵条件响应面试验设计
在单因素试验的基础上,根据Box-Behnken试验设计原理,运用Design Expert 8.0.6软件对高粱发酵培养基的水分质量分数、酸度、发酵温度、酯化菌种子液接种量进行试验设计,以己酸乙酯和丁酸乙酯的Y为响应值,设计4因素3水平的响应面试验(表1),以确定3 株酯化菌和酿酒酵母协同发酵产己酸乙酯和丁酸乙酯的最优发酵条件。

表1 响应面试验因素及水平Table 1 Coded levels and corresponding actual levels of independent variables used for Box-Behnken design
1.3.6 己酸乙酯和丁酸乙酯定性和定量分析
1.3.6.1 固相微萃取条件
称取3.00 g发酵完成的样品和50.00 μL质量浓度为20.00 mg/100 mL的乙酸正丁酯装入15 mL顶空瓶中,超声振荡10 min混匀后于55 ℃先平衡15 min,再萃取30 min,随后进行手动进样。
1.3.6.2 气相色谱条件
毛细管色谱柱为DB-WAX(60.00 mm×0.25 mm,0.25 μm);不分流;进样口温度为230 ℃;程序升温;45 ℃保持1 min,以6 ℃/min升温至160 ℃,保持1 min,再以20 ℃/min升温至230 ℃,保持6 min;载气:99.999%氦气,流速为1 mL/min。
1.3.6.3 质谱条件
电子离子源;电子能量:70 eV;采集模式:全扫描,质量扫描范围20~550 u,溶剂延迟3 min;离子源温度:230 ℃;四极杆温度:150 ℃,接口温度:230 ℃。
1.3.6.4 定性方法
将萃取完成后的进样针于230 ℃进样口中解吸5 min,通过所测得质谱图与NIST05a.L标准谱库(美国Agilent公司提供)比对,选择匹配度大于或等于80%(最大值为100%)的物质进行定性分析,并结合标准品的质谱图确认结果的正确性。
1.3.6.5 定量方法
采用内标法。以20.00 mg/100 mL的乙酸正丁酯为标准物,根据式(1)可得出丁酸乙酯和己酸乙酯的产量。

式中:fm为质量校正因子,其中fm(己酸乙酯)为1.18,fm(丁酸乙酯)为1.01;Ai为待测物峰面积;As为标准物峰面积;ms为标准物含量/(mg/100 g);mi为待测物含量/(mg/100 g)。
1.4 数据处理
在响应面分析中,将己酸乙酯和丁酸乙酯的检测指标采用Hassan方法归一化为0~1之间的值[22],计算公式按式(2)所示:

式中:di为每组实验所测得的真实值;dmax为实验组中的最高值;dmin为实验组中的最低值。考虑到己酸乙酯是浓香白酒中的主体香,而丁酸乙酯在浓香型白酒中的量少,但起辅助和烘托作用。因此,将己酸乙酯和丁酸乙酯生的权重分别设为0.8和0.2,根据式(3)计算包含己酸乙酯和丁酸乙酯的Y:
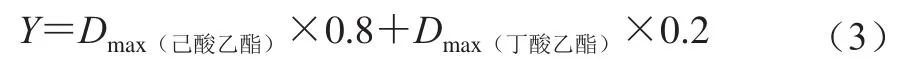
2 结果与分析
2.1 接种方式对发酵结果的影响
由表2可知,高粱发酵培养基在质量分数不同接种方式得到的发酵产物有所不同。只添加5.00%酿酒酵母和质量分数2.00%无水乙醇的高粱发酵培养基在发酵完成后既没有丁酸乙酯生成,也没有己酸乙酯生成。只接种质量分数5.00%酯化菌种子液的高粱发酵培养基在发酵结束后产生了0.25 mg/100 g丁酸乙酯和0.58 mg/100 g己酸乙酯。在报道中,C. beijerinckii可代谢葡萄糖产生乙醇、丁醇和异丙醇[23];C. sartagoforme可产生丁酸和少量酯类物质[24];C. guangxiense在无乙醇添加的情况下可产生己酸、丁酸及少量的己酸乙酯和丁酸乙酯[25]。结合空白对照组和乙醇发酵实验,进一步证实了3 株酯化细菌可通过自身或者协同作用产生己酸乙酯和丁酸乙酯。在组合接种方式中,酿酒酵母与酯化细菌协同发酵产己酸乙酯的能力显著高于无水乙醇和酯化细菌之间的作用(P<0.05),而在丁酸乙酯的合成上差异不显著(P>0.05)。与只接种酯化细菌相比,乙醇的添加可显著促进己酸乙酯和丁酸乙酯的合成(P<0.05),并且添加酿酒酵母比直接添加无水乙醇效果更好(P<0.05),这说明一定量的乙醇不但可以为酯类物质的合成提供底物,还可能为梭菌合成己酸提供碳源[26],使其进一步合成己酸乙酯。同时,这也阐明了酿酒酵母除了为酯化细菌提供乙醇环境之外,还可能存在酶作用以促进己酸乙酯和丁酸乙酯的合成[27]。
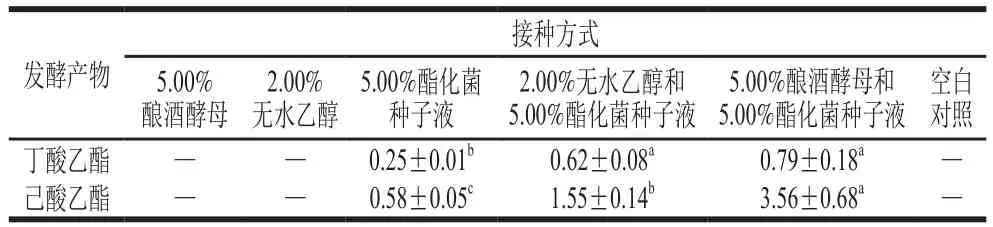
表2 酿酒酵母和3 株酯化菌协同发酵结果Table 2 Effect of single and mixed culture fermentation of S. cerevisiae and three strains of esterifying bacteria on the production of ethyl hexanoate and ethyl butyrate mg/100 g
2.2 酯化菌种子液的最佳接种时间
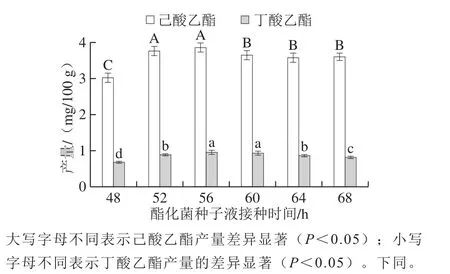
图1 接种时间对己酸乙酯和丁酸乙酯产量的影响Fig.1 Effect of inoculation time on the yields of ethyl hexanoate and ethyl butyrate
如图1所示,随着接种时间的延长,己酸乙酯和丁酸乙酯的产量均呈先增后降的变化趋势。其中,在第56小时,己酸乙酯和丁酸乙酯产量均达最高值,分别为3.86 mg/100 g和0.96 mg/100 g,显著高于其他接种时间(P<0.05),这可能是由于酿酒酵母在56 h左右生长达到稳定,而此时培养基中的氧气已被消耗殆尽,并且酵母菌厌氧发酵积累了一定量的乙醇,从而促进了酯化菌与酵母菌合成己酸乙酯和丁酸乙酯的协同作用。而随着接种时间的继续延长,酵母菌的生长代谢不仅会持续消耗培养基中的底物,过量的乙醇和其他代谢物还可能会抑制酯化菌的生长以及与酿酒酵母的协同发酵作用[28],使得己酸乙酯和丁酸乙酯的产量降低。因此,选择56 h为酯化菌种子液的最佳接种时间。
2.3 协同发酵接种量对己酸乙酯和丁酸乙酯产量的影响
接种量决定了菌种在发酵过程中的生长繁殖速率,并且直接影响发酵周期[29]。由图2可知,随着酯化菌种子液接种量的增加,己酸乙酯的产量呈先上升后趋于稳定的变化趋势,且在接种量为5.00%时,己酸乙酯的产量达最大,为3.35 mg/100 g,显著高于其他接种量(P<0.05)。当酯化菌种子液的接种量大于5.00%时,己酸乙酯的产量差异不显著(P>0.05)。丁酸乙酯的产量则是随着酯化菌种子液的增加呈先上升后下降的变化趋势,且在接种量为5.00%时,丁酸乙酯的产量达最大,为0.83 mg/100 g,显著高于其他接种量(P<0.05)。这说明当酯化菌种子液接种量为5.00%时,酯化细菌活力旺盛,环境适应能力强,能够使己酸乙酯和丁酸乙酯的发酵体系发挥最大作用。因此,确定酯化菌种子液的最佳接种量为5.00%。
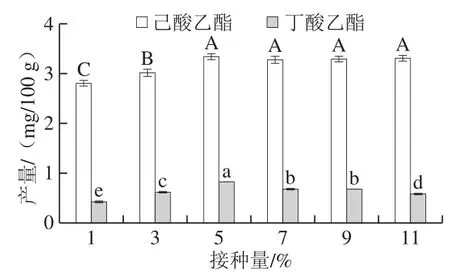
图2 接种量对己酸乙酯和丁酸乙酯产量的影响Fig.2 Effect of inoculum quantity on the yields of ethyl caproate and ethyl butyrate
2.4 协同发酵温度对己酸乙酯和丁酸乙酯产量的影响
温度通过改变蛋白质、酶和核酸的结构和活性来影响微生物的生长和体内的生物化学反应[30-31]。由图3所示,随着发酵温度的升高,丁酸乙酯和己酸乙酯的产量均呈先升后降的变化趋势。当发酵温度为28 ℃时,丁酸乙酯的产量达最高,为1.02 mg/100 g,显著高于其他发酵温度(P<0.05)。而当温度为32 ℃时,己酸乙酯产量达到最高,为3.56 mg/100 g,显著高于其他发酵温度(P<0.05)。浓香型白酒糟醅的发酵温度一般不高于35 ℃,而略微偏高的温度对发酵过程中产酸和产酯有积极作用[32],这说明该结果符合实际生产的需求。由于己酸乙酯为浓香型白酒的主体风味物质,且在32 ℃时丁酸乙酯和己酸乙酯的产量之和高于28 ℃时的产量。因此,选择32 ℃为最佳为发酵温度。

图3 发酵温度对己酸乙酯和丁酸乙酯产量的影响Fig.3 Effect of fermentation temperature on the yields of ethyl caproate and ethyl butyrate
2.5 协同发酵水分质量分数对己酸乙酯和丁酸乙酯产量的影响
在浓香型白酒生产过程中,酒醅中的水主要来源于配料时“打量水”,且入窖池时的水分质量分数一般控制在56.00%左右[33]。但随着发酵的进行,微生物的生长与代谢会产生大量的游离水。因此,在发酵中期即酯化生香期,酒醅的水分质量分数约在60.00%~90.00%之间,中下层在70.00%~90.00%之间[34]。由图4所示,随着水分质量分数的增加,丁酸乙酯和己酸乙酯的产量均呈先上升后下降的变化趋势,且当水分质量分数为80.00%时,丁酸乙酯和己酸乙酯的产量均达到最高,分别为0.86 mg/100 g和3.91 mg/100 g,显著高于其他水分质量分数的产量(P<0.05)。因此,确定最佳水分质量分数为80%。
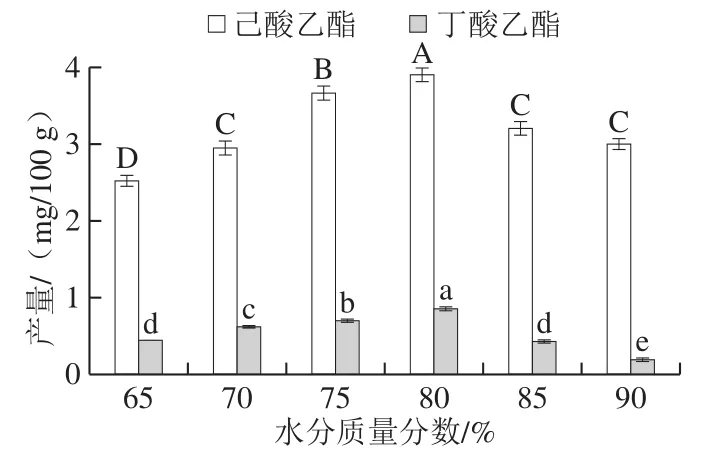
图4 水分质量分数对己酸乙酯和丁酸乙酯产量的影响Fig.4 Effect of moisture content on the yields of ethyl caproate and ethyl butyrate
2.6 协同发酵酸度对产己酸乙酯和丁酸乙酯产量的影响
相较于pH值,酸度更能准确地反映酒醅中的酸碱性[35]。在酒醅中,将100.00 g糟醅中的酸消耗1.00 mmol NaOH定义为1 度酸度[36]。在实际生产中,浓香型白酒酒醅的入池酸度大约在1.50~2.20 mmol/100 g,但随着酒醅发酵的进行,各种有机酸的不断产生和积累,酒醅的酸度会发生变化[37]。如图5所示,随着酸度的升高,己酸乙酯和丁酸乙酯的产量均呈先升后降的变化趋势。其中,在酸度为2.60 mmol/100 g时,丁酸乙酯和己酸乙酯产量均达到最高,分别为1.03 mg/100 g和3.91 mg/100 g,显著高于其他酸度(P<0.05)。这说明适当增高酸度有助于酿酒酵母与酯化细菌之间的产酯作用,但酸度过高可能会抑制酿酒酵母或者酯化菌的生长,使其发酵能力减弱。因此,选择发酵起始的最佳酸度值为2.60 mmol/100 g。
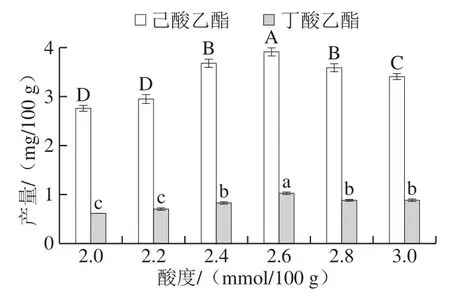
图5 酸度对己酸乙酯和丁酸乙酯产量的影响Fig.5 Effect of acidity on the yields of ethyl caproate and ethyl butyrate
2.7 发酵条件响应面试验结果
2.7.1 Box-Behnken试验设计及结果
通过对数据进行建模的响应面分析法不仅可以从多因素中确定起主要作用的自变量,并确定各变量之间的相互作用,还能以允许的期望值选择变量的最佳条件[38-40]。根据单因素试验结果,利用Box-Behnken试验设计原理对温度(A)、水分质量分数(B)、酸度(C)和接种量(D)设计4因素3水平共29 组试验(表3)。其中,析因部分试验24 次,中心点重复试验5 次。
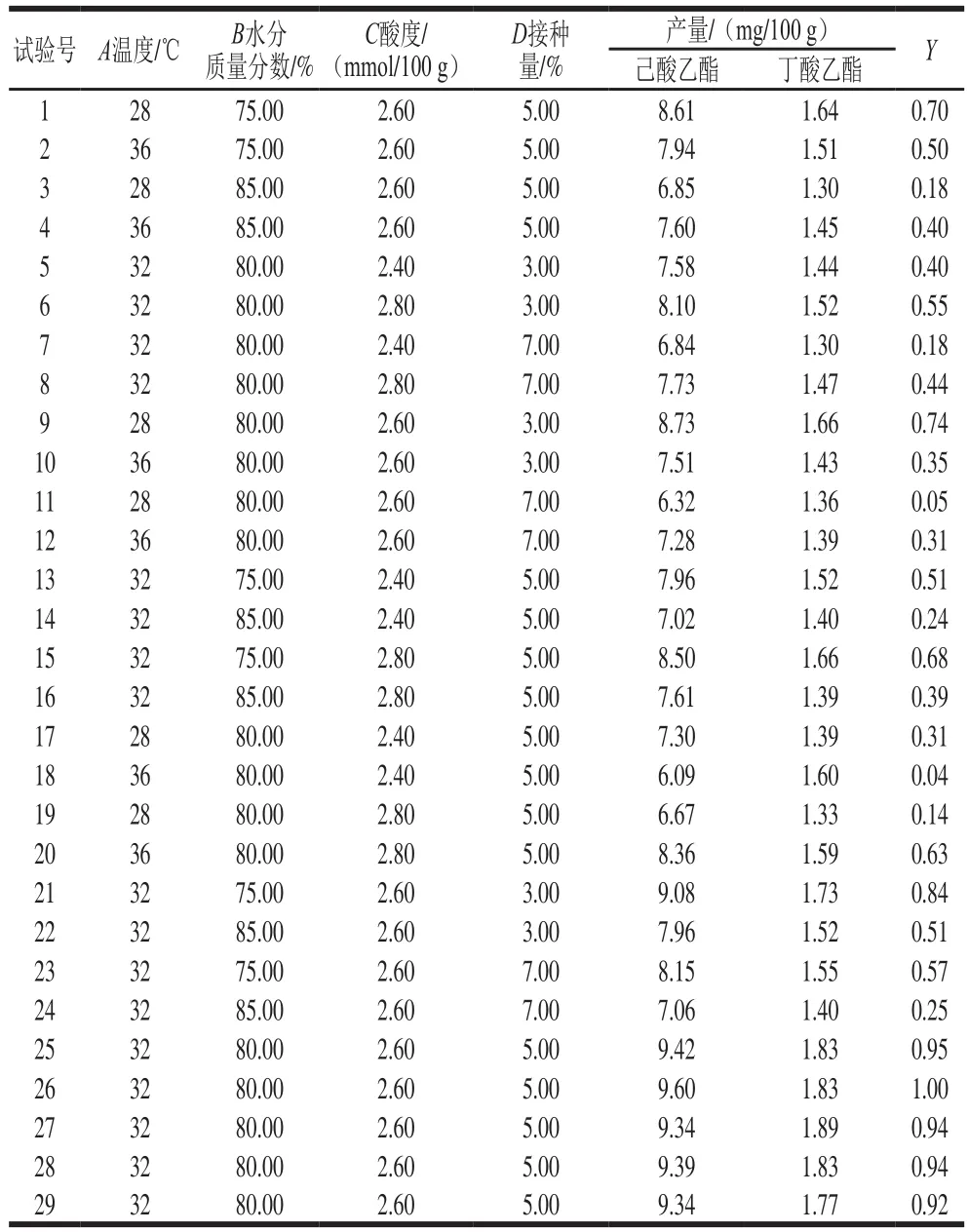
表3 响应面试验设计及结果Table 3 Box-Behnken design with response variables
2.7.2 模型方程的建立与显著性检验
根据表3的试验结果,利用Design Expert 8.0.6软件对Y和各因素进行多元回归分析,同时拟得多元二次回归方程为:Y=0.95+0.15B+0.10C-0.13D+0.11AB+0.19AC+0.16AD+0.03CD-0.34A2-0.17B2-0.32C2-0.24D2,其中A、B、C、D分别表示温度、水分质量分数、酸度、接种量。方程决定系数R2为0.981 7,说明该回归方程的拟合度较好,可通过回归方程对实际试验结果进行方差分析,其结果见表4。
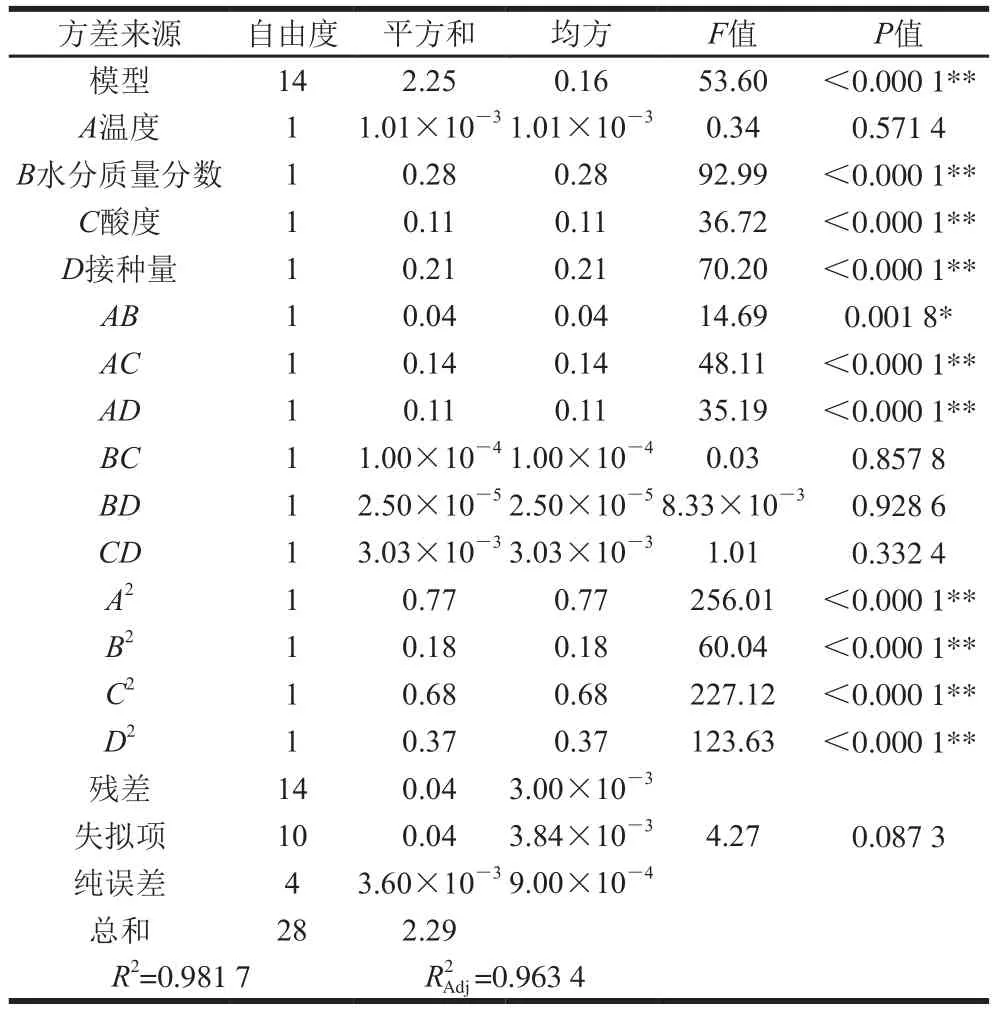
表4 Box-Behnken试验结果方差分析Table 4 Analysis of variance of response surface regression model
由表4可知,二次回归模型P<0.000 1,达到极显著水平;决定系数R2为0.981 7,说明该模型能解释98%响应值的变化,表明预测结果与实际结果有着较好的一致性;模型的复合相关系数为0.963 4,表明试验结果有96.34%受试验因素的影响;变异失拟项P值不显著(0.087 3>0.05),说明试验无失拟因素存在,回归模型能充分反映实际情况。
方差分析中的显著性检验可以判断自变量对因变量的影响。由表4可知,B、C和D对Y的影响极显著(P<0.01),而A影响不显著(P>0.05);模型中的交互项AC和AD对Y的影响极显著(P<0.01),AB影响显著(P<0.05),而BC、BD和CD影响不显著(P>0.05);模型中的二次项A2、B2、C2和D2对Y的影响均达极显著水平(P<0.01)。由此可知,B、C、D对Y的影响均大于A,即水分质量分数、接种量和酸度对Y的影响均大于温度。
2.7.3 各因素交互作用的响应面分析
为了直观反映温度(A)、水分(B)、酸度(C)和接种量(D)共4 个影响因素之间的交互作用对Y的影响,利用Design Expert 8.0.6软件绘制了各因素与响应值之间的三维曲面图和等高线分析图,见图6。曲面越陡峭、倾斜度越高说明各因素之间的交互作用对响应值的影响越大;等高线的疏密程度及呈现的形状可以反映各因素之间的交互作用的显著性[41-42]。图6a1、a2、b1、b2、c1、c2相较于其他图,等高线分布密集,且呈椭圆形,对应的曲面较为陡峭,说明温度分别与水分质量分数、酸度和接种量之间的交互作用明显,且对响应值的影响较为显著,与表4中的数据有着较好的一致性。
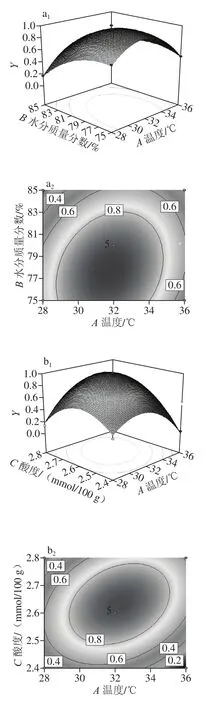

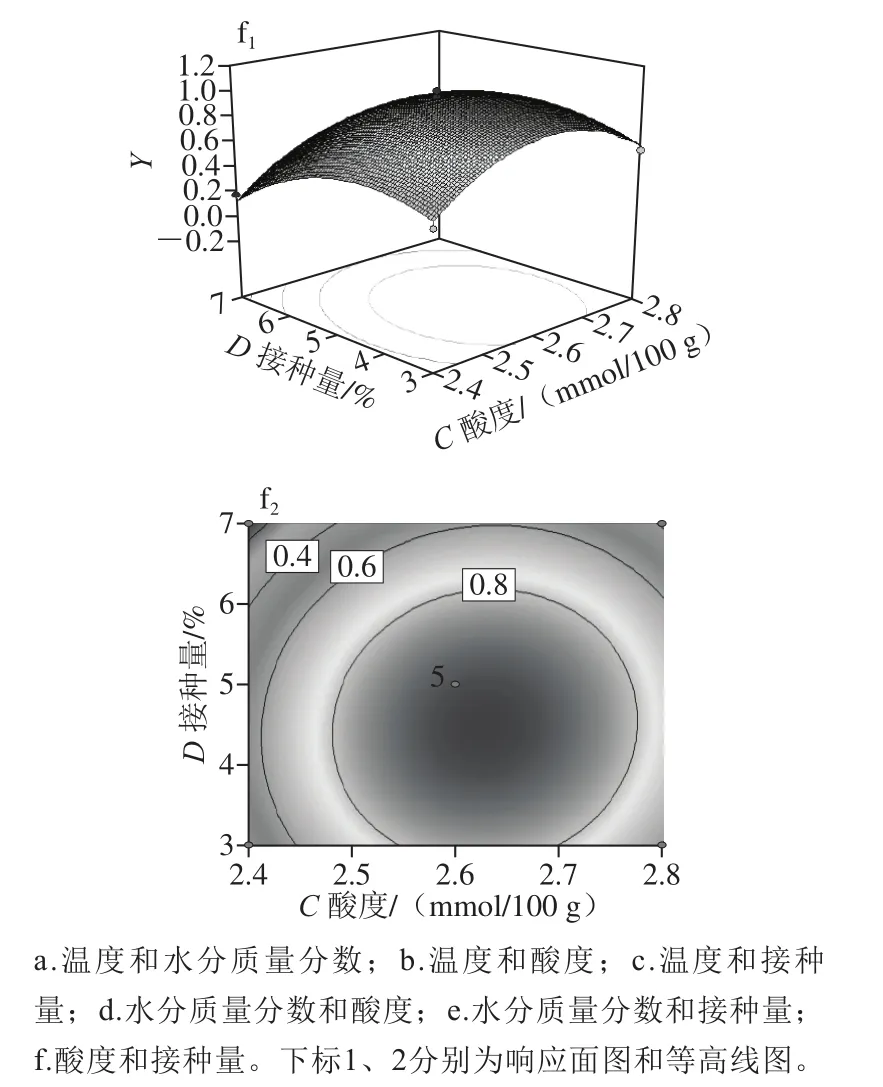
图6 温度、水分质量分数、酸度、接种量响应面图Fig.6 Response surface plots showing the effect of interaction of temperature, moisture content, acidity and inoculum quantity
2.7.4 验证实验
根据Design Expert 8.0.6软件分析得出,当Y的期望值为1.00且己酸乙酯的量为最大时,酿酒酵母与3 株酯化菌协同发酵条件为温度31.61 ℃、水分质量分数77.74%、酸度2.62 mmol/100 g、接种量4.59%,此时己酸乙酯和丁酸乙酯产量分别为9.64 mg/100 g和1.85 mg/100 g。为了满足实际操作的需求,将最佳发酵条件调整为温度32 ℃、水分质量分数78.00%、酸度2.60 mmol/100 g、接种量4.60%。同时,为了检验模型预测的准确性,以4因素3水平试验组中Y最高组的工艺条件作为优化后的对照组,其发酵条件为温度为32 ℃、水分质量分数为80.00%、酸度为2.60 mmol/100 g、接种量为5.00%,此时的己酸乙酯和丁酸乙酯产量分别为9.60 mg/100 g和1.83 mg/100g,在相同条件下分别重复进行5 次实验,结果如图7所示。
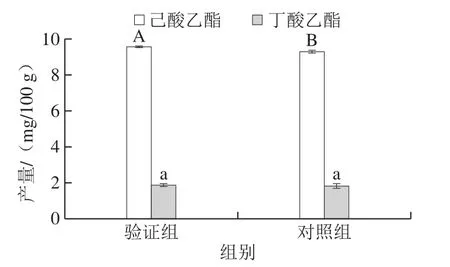
图7 验证实验结果Fig.7 Yields of ethyl caproate and ethyl butyrate under unoptimized and optimized fermentation conditions
由图7可知,在模型预测的工艺条件下,3 株酯化细菌与酿酒酵母协同发酵产己酸乙酯的量为9.55 mg/100 g,显著高于对照组己酸乙酯的产量9.30 mg/100 g(P<0.05);而丁酸乙酯的产量为1.87 mg/100 g,与对照组丁酸乙酯的产量1.78 mg/100 g差异不显著(P>0.05)。优化条件后的己酸乙酯产量达预期值的99.07%,丁酸乙酯产量达预期值的100%,预测值与实际值的拟合性较好,优化工艺具有一定可行性。
3 结 论
本实验通过单因素试验和响应面优化分析得出,水分质量分数、酸度和接种量对己酸乙酯和丁酸乙酯的产量影响极显著(P<0.01),而温度影响不显著(P>0.05),但温度与水分质量分数、酸度和接种量之间的交互作用影响显著(P<0.05)。酿酒酵母与3 株酯化细菌协同发酵产己酸乙酯和丁酸乙酯的最佳生产工艺为温度32 ℃、水分质量分数78.00%、酸度2.60 mmol/100 g、接种量4.60%。在最佳条件下,己酸乙酯和丁酸乙酯的产量分别为9.55 mg/100 g和1.87 mg/100 g。相较于初始条件,响应面优化后的发酵条件使己酸乙酯和丁酸乙酯的产量分别增加了1.68 倍和1.38 倍。
目前,基于不同种群间的相互作用和以高粱为基质的纯种固态发酵生产己酸乙酯和丁酸乙酯的方法鲜见报道,但这对功能微生物在实际生产中的应用有着重要意义。浓香型白酒的酿造不仅仅是一个复杂群落相互作用的过程,还与生产原料、环境等息息相关。解析白酒发酵过程中功能微生物的相互作用与风味物质生成之间的联系一直成为业界难题。从纯种微生物出发,采用固态发酵模型,由单一微生物的作用延伸至多种微生物的共同作用可能成为该研究的突破点。

