基于代谢组学和转录组学分析工业面包酵母(Saccharomyces cerevisiae)ABY3冷冻胁迫应答机制
孟 露,刘晗诚,刘雅涵,林 雪,*,刘四新,李从发
(1.海南大学食品科学与工程学院,海南 海口 570228;2.海南大学理学院,海南 海口 570228)
近年来,冷冻面团技术因具有简化面团发酵产品生产流程、降低生产成本及减少人力资源浪费等优点被广泛应用[1-3]。在我国,馒头、包子等不加糖面团发酵面食更为丰富,且在提倡低糖低脂健康饮食的大环境下,不加糖或低糖(加糖量低于6%)面包受到众人的偏爱。然而,经冷冻储藏的面团品质会大大降低,如面团内部形成的冰晶和冰晶重结晶不仅破坏面筋蛋白的网络结构,还使酵母活性受到极大的损伤[4-6]。酵母的生存能力是影响冷冻面团质量的关键因素,酵母存活率与发酵力的下降使面团发酵时间延长,面团内部不能形成良好的海绵状结构,导致面团一系列品质问题,如外观出现裂痕、色泽暗淡、口感不佳和异味等[7-9]。
代谢组学与转录组学是系统生物学研究中的重要技术手段,通过检测环境变化中生物体代谢产物的变化及相关基因的差异表达,揭示生命活动的调控途径[10]。近年来,越来越多的研究者通过多组学结合的方法探究酵母胞内外代谢体系及细胞自身的调控机制,使其更好地发挥模式生物的价值,并促进其在工业生产上的应用。多组学方法被广泛应用于酵母耐性机理的研究,如Santos等[11]通过基因组学、转录组学、蛋白组学和代谢组学分析了酿酒酵母耐药性;Geng Peng等[12]通过基因组学、转录组学、蛋白组学和代谢组学分析了酿酒酵母在乙酸胁迫下的应答机制;Strucko等[13]通过转录组学、蛋白组学和代谢组学分析了酿酒酵母在不同胁迫条件下磷酸甘油代谢的调节方式;Xia Zhengchao等[14]通过转录组学、蛋白组学和代谢组学分析了酿酒酵母低氧胁迫下的应激调节机制。而以组学的分析方法研究酵母冷冻应答机制的报道较少,如罗煜等[15]通过代谢组学分析了异常威克汉姆酵母冷冻胁迫下糖代谢变化及冷冻胁迫相关的特征代谢物。目前,以多组学分析方法探究酵母冷冻应答机制的相关研究鲜见报道,本研究通过代谢组学与转录组学分析,从代谢物水平和mRNA水平揭示面包酵母冷冻胁迫应答机制,旨在为酵母耐性调节机制的研究提供思路,为冷冻面团优化及技术发展奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
工业面包酵母(Saccharomyces cerevisiae)ABY3由本实验室保存。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖20 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,固体培养基添加琼脂粉20 g/L,pH值自然,121 ℃灭菌15 min。
葡萄糖模拟面团培养基:葡萄糖40 g/L,硫酸铵2.5 g/L,尿素5 g/L,磷酸二氢钾16 g/L,磷酸氢二钠5 g/L,硫酸镁0.6 g/L,烟酸22.5 mg/L,泛酸5.0 mg/L,VB12.5 mg/L,VB61.25 mg/L,VB21.0 mg/L,叶酸0.5 mg/L,蒸馏水配制,100 ℃灭菌30 min备用。
1.2 仪器与设备
Exion UPLC-QTOF 5600 PLUS液相色谱-质谱联用仪(配有电喷雾离子源) 美国AB SCIEX公司;ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm) 美国Waters公司;纯水机 台湾艾科有限公司;高速冷冻离心机 日本日立科奇有限公司;自动压力蒸汽灭菌锅 厦门致微仪器有限公司;生化培养箱上海旻泉有限公司;电子分析天平 梅特勒-托利多仪器有限公司;电热鼓风干燥箱 鹤壁市科奥仪器仪表制造有限公司。
1.3 方法
1.3.1 冷冻胁迫下存活率测定
挑取1 环酵母细胞于YEPD培养基中,30 ℃、180 r/min培养12 h;以10%(V/V)的接种量转YEPD培养基中,30 ℃、180 r/min培养24 h至稳定期(OD600nm为1.5左右);4 000 r/min离心5 min,无菌水洗涤2 次后收集菌体备用。将上述离心收集得到的酵母(含水量73%左右)按2.0 g/100 mL的接种量接到葡萄糖模拟面团培养基中,30 ℃预发酵30 min,取样稀释适当倍数点板并涂板计数为u1,剩余样品-20 ℃冷冻7 d后,30 ℃发酵30 min,取样稀释适当倍数点板并涂板计数为u2。冷冻细胞存活率/%=(u2/u1)×100。实验设置3 个重复。
1.3.2 冷冻胁迫下发酵力测定
称取上述离心收集得到的酵母4.5 g,与2.0 g NaCl、72.5 mL水、140 g标准面粉混合,30 ℃预发酵30 min后,称取50 g面团放入250 mL量筒中发酵,记录未经冷冻面团2 h CO2产气量;同时称取50 g面团于-20 ℃冷冻,7 d后,于30 ℃解冻30 min后放入250 mL量筒中继续发酵,记录2 h CO2产气量。计算单位干质量菌体在60 min的产气量作为发酵力。实验设置3 个重复。
1.3.3 非靶向代谢组学分析
将葡萄糖模拟面团培养液中,冷冻前和冷冻后发酵30 min的细胞培养液(菌量约4 mg)转移到1.5 mL的离心管中,4~8 ℃离心5 min,在Milli-Q水(4 ℃)中洗涤2 次。用低温甲醇提取法提取细胞内代谢物,冷冻干燥成颗粒,无需加热。在液相色谱-串联质谱分析前,加入100 μL的色谱级水,使每个标准样品和每个生物样品重新悬浮。使用自动取样器将大约2 μL的样品注入液相色谱-串联质谱系统[16]。色谱柱选用ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm),使用Exion UPLC-QTOF 5600 PLUS液相色谱-质谱联用仪,以电喷雾电离模式进行所有分析,条件如下:气帘气压力:35 psi;正离子喷雾电压:5 500 V;负离子喷雾电压:-4 500 V;温度:450 ℃;离子源气体1压力:50 psi;离子源气体2压力:50 psi。实验设置4 个重复。
1.3.4 转录组学分析
将葡萄糖模拟面团培养液中,冷冻前和冷冻后发酵30 min的细胞培养液(菌量约4 mg)转移到1.5 mL的离心管中,4~8 ℃离心5 min,在Milli-Q水(4 ℃)中洗涤2 次。通过Trizol提取试剂盒进行RNA提取,利用Nanodrop检测RNA浓度,琼脂糖凝胶检测RNA完整性以及基因组污染情况。检测合格的RNA用于后续测序。将提取后的RNA送入基迪奥生物公司进行转录组测序分析。实验设置3 个重复。
1.4 数据分析
实验中各组数据均以平均值±标准误差表示,结合Studentt检验和最小显著性差异法方法证实菌株间差异,P<0.05,差异显著。代谢组学中,以P<0.05且差异倍数(fold change,FC)>1作为差异代谢物的鉴别标准,对P<0.05差异代谢物进行KEGG通路的富集分析。使用R语言软件包进行主成分分析。转录组学中,以错误发现率(false discovery rate,FDR)<0.05且FC>1作为差异基因,并对差异基因进行KEGG通路的富集分析。
2 结果与分析
2.1 面包酵母ABY3冷冻胁迫存活率及不加糖面团发酵性能
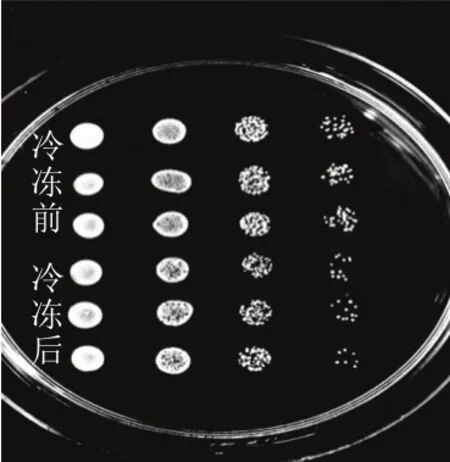
图1 面包酵母ABY3冷冻前后生长性能差异Fig.1 Comparison of the growth performance of ABY3 before and after freezing
为了研究低温对面包酵母细胞的影响,从存活率及发酵性能2 个指标进行判定。将冷冻前预发酵30 min的培养液与冷冻处理7 d后发酵30 min的培养液,分别稀释4 个梯度浓度进行点板,如图1所示,组内3 组平行样品菌落数基本一致,而冷冻前与冷冻后的样品组间表现出菌落数差异,冷冻后的酵母存活数量明显少于冷冻前。为计算ABY3冷冻胁迫存活率及验证图1现象,将相同条件处理的发酵液适当稀释后涂板计数,统计得出冷冻后的存活率为(43±2.0)%,该存活率与图1表现出的组间菌落差异数量基本一致,表明超过半数的酵母细胞在低温胁迫下死亡。
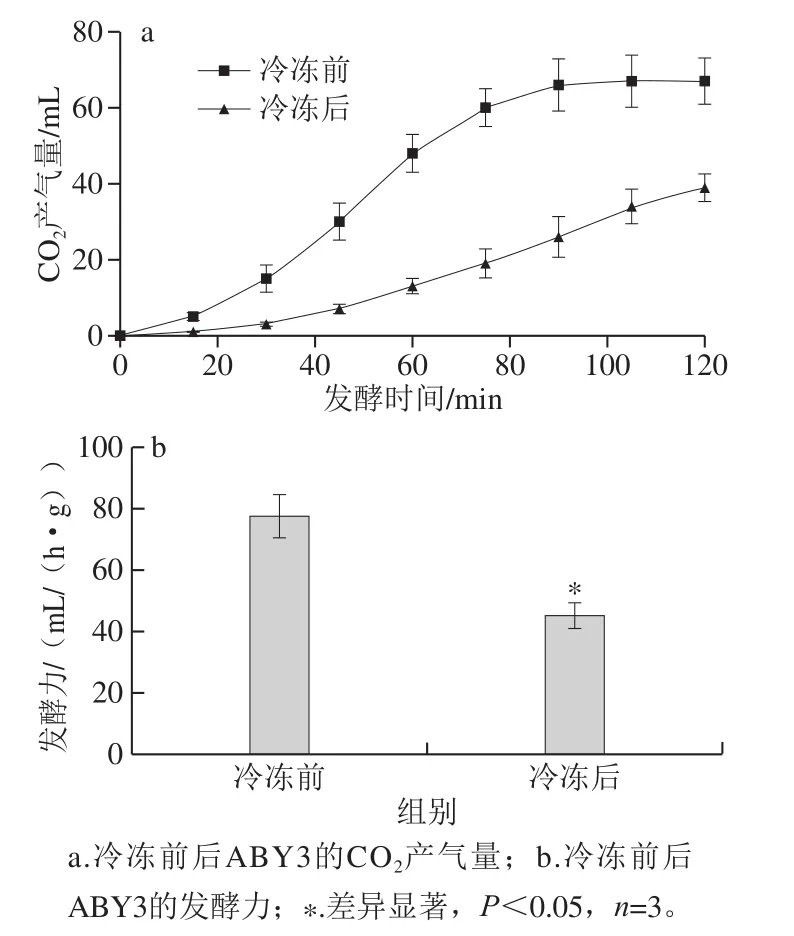
图2 面包酵母ABY3冷冻前后在不加糖面团中的发酵性能Fig.2 Fermentation properties of frozen and non-frozen baker’s yeast ABY3 in dough without added sugar
通过不加糖面团发酵实验,记录面团冷冻7 d前后的产气量变化,可以体现面包酵母ABY3冷冻前后的发酵性能。如图2a所示,在90 min菌株ABY3冷冻前的面团发酵基本达到终点并趋于稳定,50 g面团累计产气量约为67 mL,而菌株ABY3冷冻后的面团在相同时间的产气量只有26 mL,且在120 min仍处于缓慢发酵的状态。在实际应用中,酵母的发酵效率是影响面团发酵产品品质和生产效率的关键因素,过长的发酵时间是导致面团外观差、口感欠佳的重要原因之一。发酵力可以有效反映面包酵母发酵效率。如图2b所示,冷冻后ABY3的发酵力较冷冻前下降42%(P<0.05)。
综上结果表明,冷冻胁迫不仅影响面包酵母生长性能,对面包酵母细胞具有致死性,还会影响面包酵母代谢性能,从而降低面团发酵效率。冷冻胁迫下面包酵母应答机制牵涉到复杂多变的生理调节,采用代谢组学与转录组学分析,从代谢物水平和mRNA水平揭示面包酵母冷冻胁迫应答机制。
2.2 面包酵母ABY3冷冻胁迫下的代谢组学分析
为探究低温胁迫对面包酵母胞内代谢物质的影响,对冷冻前后模拟面团培养液预发酵的面包酵母ABY3进行胞内代谢组学分析。代谢组学定性的代谢物共77 种,图3a主成分分析(principal component analysis,PCA)显示,处理组间有较明显差异及组间重复性,具有分析价值。将冷冻前后的显著差异代谢物(P<0.05且FC>1)相对含量以z-score标准化方式进行数据处理并制作热图,如图3b所示,显著差异代谢物共24 种,其中上调7 种,下调17 种。
酵母在低温发酵中表现出对有机氮源氨基酸的偏好,冷冻处理后,酵母胞内氨基酸的含量普遍下调,该结果与Tai等[17]研究结果一致。Takagi等[18]发现酿酒酵母中脯氨酸以及带电荷氨基酸如谷氨酸、精氨酸、赖氨酸等会有明显的低温保护剂作用。另外,酵母胞内氨基酸的积累对其他环境胁迫同样起到细胞保护剂作用[19-22],可见氨基酸是维持细胞生长代谢平衡的重要物质。而冷冻胁迫下,面包酵母胞内氨基酸的匮乏可能是导致酵母存活率下调的原因之一。
上调的物质中涉及到3 种脂肪酸:棕榈酸、油酸和十三烷酸。脂肪酸是微生物细胞膜中含量丰富且稳定的化学组分,因此该类物质在胁迫条件下变化被人们所关注[23]。细胞膜作为细胞的保护屏障,在环境适应中通过脂质变化,维持细胞形态、实现信号传导及调节渗透压[24]。温度降低会严重降低细胞膜的流动性和通透性,影响跨膜蛋白活性[25]。酵母细胞可通过多种调节方式保持细胞膜适当的流动性,其中较为主要、研究较多的调节方式涉及增加脂肪酸的不饱和度和减少平均链长[26]。实验结果表明,脂代谢响应于冷冻胁迫,冷冻胁迫下面包酵母中不饱和脂肪酸油酸含量有所升高,从而有利于保持细胞膜流动性,而长链脂肪酸棕榈酸和中链脂肪酸十三烷酸含量的增加可能是脂代谢响应于酵母细胞冷冻胁迫的另一调节方式。
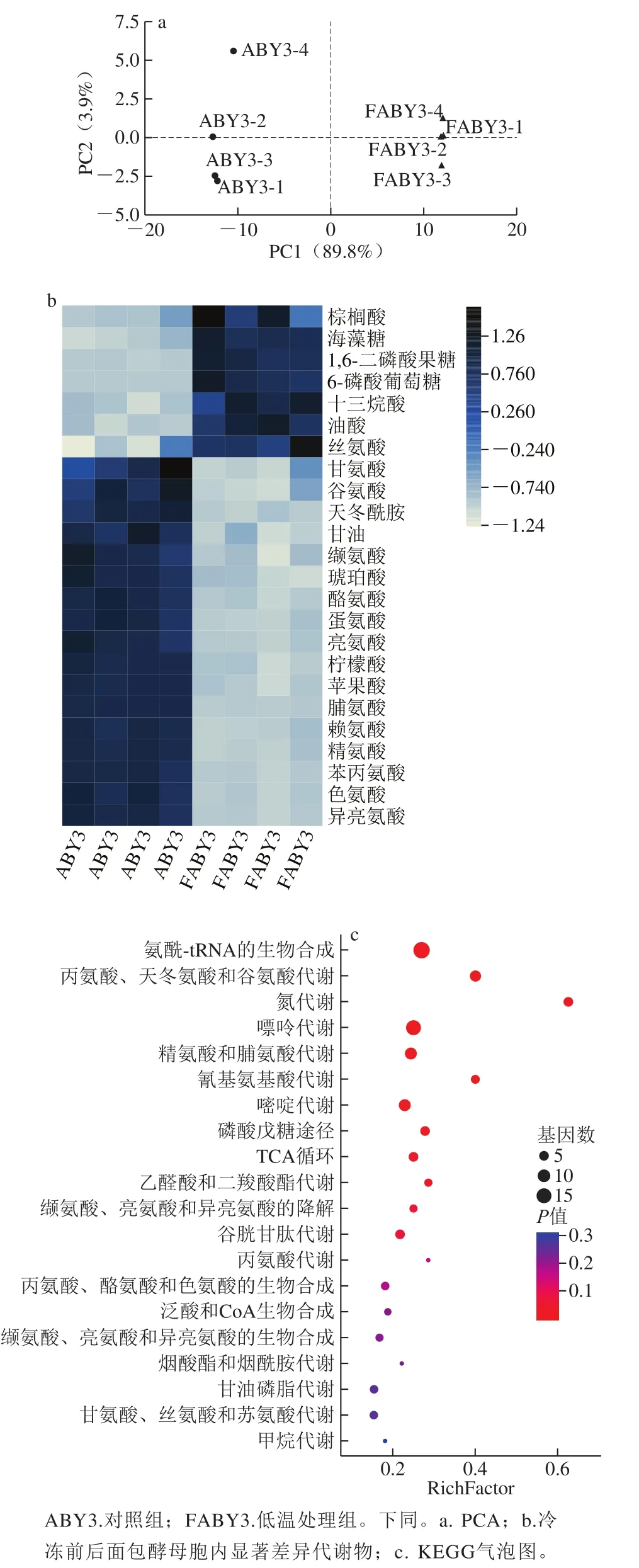
图3 面包酵母响应于冷冻胁迫下的代谢组学分析Fig.3 Metabolomic analysis of baker’s yeast in response to freezing stress
在上调的冷冻差异代谢物中,海藻糖一直被认为是影响酵母冷冻耐受性的一个重要因素,在保护酵母蛋白质和质膜稳定性方面起到重要作用[27-29]。在胁迫条件下,胞内海藻糖通过“水替代”“玻璃态”或“优先排阻”多种机制保护细胞免受恶劣环境对细胞的损伤[30]。在保护酵母细胞的同时海藻糖还作为重要的能源物质储存于胞内,以维持细胞的存活和发酵[31]。实验结果表明,海藻糖代谢途径响应于冷冻胁迫,使面包酵母在发酵过程中积累海藻糖以应对环境胁迫,该结果与Aguilera等[32]研究结果相符。
此外,进一步对差异代谢物(P<0.05)进行KEGG通路分析,如图3c所示,在影响力排名前20的差异代谢通路中,主要的差异代谢通路都与氨基酸代谢相关。综上推测,冷冻胁迫致使面包酵母细胞积累海藻糖和不饱和脂肪酸,对细胞起到了一定程度的保护作用,但冷冻条件下冰晶对细胞膜的损伤不可忽视,其中长链脂肪酸的增多及冷冻对跨膜蛋白活性的影响极有可能一定程度影响了营养物质的跨膜运输,导致胞内营养物质氨基酸匮乏,致使氨酰-tRNA生物合成底物不足,氮代谢减缓,从而影响细胞生长代谢。
2.3 面包酵母ABY3冷冻胁迫下的转录组学分析

图4 面包酵母响应于冷冻胁迫下的转录组学分析Fig.4 Transcriptomic analysis of baker’s yeast in response to freezing stress
为进一步探究冷冻胁迫下,面包酵母ABY3胞内代谢调控途径,对冷冻前后模拟面团培养液预发酵的面包酵母ABY3进行胞内的转录组学分析。如图4a所示,冷冻前后的面包酵母相比,显著差异基因(FDR<0.05且FC>1)共494 个,其中上调246 个,下调248 个。对显著差异基因进行代谢通路分析(图4b),并对差异通路所涉及到的差异基因进行汇总(表1),发现在排名前20的差异代谢通路中,氮代谢、氨基酸代谢、氨酰-tRNA生物合成、脂肪酸代谢和海藻糖代谢相关调控基因的表达表现出显著差异,该结果与代谢组所涉及的差异代谢通路基本相符。
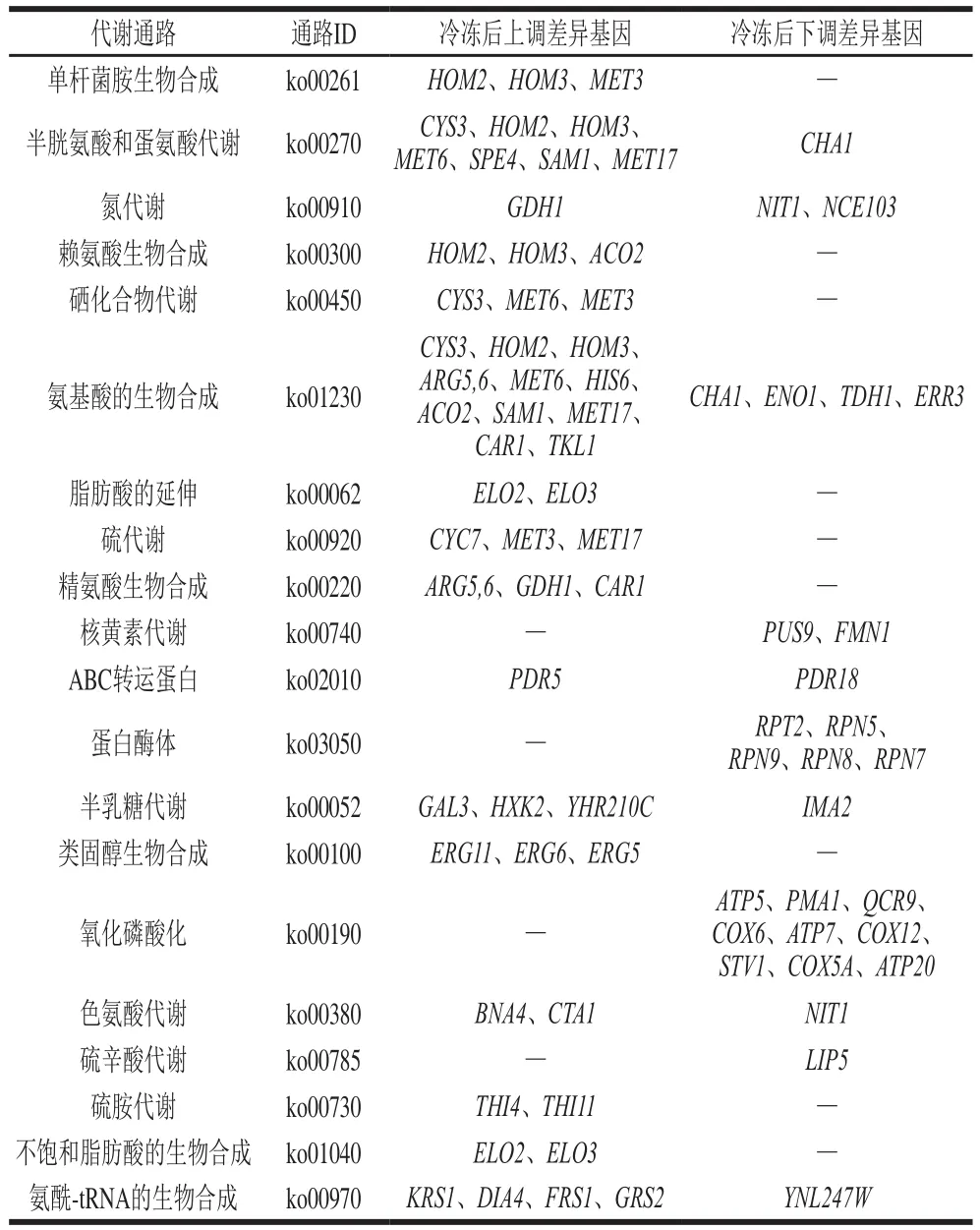
表1 面包酵母响应冷冻胁迫的显著差异基因Table 1 Significantly differentially expressed genes in baker’s yeast in response to freezing stress
冷冻后,面包酵母细胞中与氮代谢和氨基酸代谢相关的基因普遍上调,该结果与Schade等[33]报道一致。在氮代谢中,细胞对氮的吸收通过氮分解代谢阻遏机制调节[34],与解除氮代谢阻遏相关的谷氨酸脱氢酶编码基因GDH1[35]在冷冻胁迫后显著上调(图5a),该阻遏机制的解除促进氮代谢。在氮源利用上,低温环境下酵母细胞更偏好于利用氨基酸而不是铵,而氨基酸的利用致使氨基酸代谢活跃[36]。因此推测冷冻胁迫可能使酵母细胞实现氮分解代谢的去阻遏,加强了有机氮源氨基酸的应用。冷冻后,氨酰-tRNA生物合成途径中,可用于tRNA连接的L-氨基酸普遍下调,而不同氨基酸与tRNA连接酶的相关调控基因呈现上调。已有文献表明,氨酰-tRNA合成途径中相关酶活性响应于胞内氨基酸的匮乏,且与细胞的生长速率相关[37]。因氨酰-tRNA合成途径在蛋白质合成中起到至关重要的作用,所以该途径与细胞生长代谢调节密切相关。目前,还未有研究表明氨酰-tRNA合成途径响应于环境胁迫,其中的应激调节机制未知。综上,冷冻胁迫下氨酰-tRNA生物合途径中相关调控基因响应于胞内氨基酸的匮乏普遍上调,推测氨酰-tRNA的合成途径是被冷冻的胁迫环境激活,具体的作用机理有待研究。
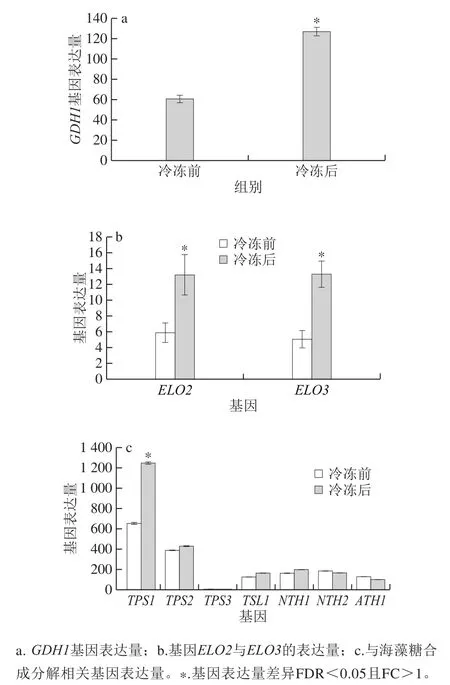
图5 面包酵母冷冻前后差异基因表达量Fig.5 Differential gene expression in baker’s yeast before and after freezing
低温条件下,脂质成分变化是酵母细胞响应低温环境的重要调节方式。转录组数据中,与脂肪酸代谢相关的脂肪酸延长酶编码基因ELO2和ELO3[38],在冷冻胁迫后呈现上调(图5b)。脂肪酸延长酶参与脂肪酸代谢,与膜脂的代谢密切相关[39]。酵母中含有3 种脂肪酸延长酶:Elo1延长C14-FA到C16-FA;Elo2延长C16-FA和C18-FA到C24-FA;Elo3延长C18-FA到C26-FA[40]。ELO2和ELO3作为合成极长链脂肪酸其中的关键基因,对脂肪酸在细胞中的代谢平衡有重要作用[41]。有相关研究表明,过表达脂肪酸延长酶的编码基因,可以使不饱和脂肪酸与中、长链脂肪酸相对含量增加[42]。基于以上分析推测,冷冻胁迫诱导酵母ELO2和ELO3基因表达,使酵母胞内油酸、棕榈酸和十三烷酸相对含量增加,从而间接调节脂代谢在环境适应中的平衡。
对海藻糖代谢相关基因进行分析,发现冷冻后,海藻糖合成酶编码基因TPS1、TPS2、TPS3和TSL1呈现不同幅度上调,其中TPS1基因的表达量较冷冻前上调1 倍,而海藻糖分解相关中性海藻糖酶编码基因NTH1和NTH2以及酸性海藻糖酶编码基因ATH1并未表现出显著差异(图5c)。以上结果表明,冷冻胁迫增强海藻糖合成酶编码基因表达,促进胞内海藻糖积累,从而有利于保护细胞维持机体正常生长代谢。
通过转录组学分析得出,受冷冻胁迫影响,酵母氮分解代谢阻遏被解除,作为酵母的低温偏好有机氮源氨基酸被大量消耗并活跃氨基酸代谢。而氮分解代谢阻遏被解除的情况下,细胞生长仍被明显遏制的主要原因极有可能是胞内氨基酸的匮乏。胞内氨基酸作为蛋白质和酶的合成原料,是细胞生长代谢的重要物质。代谢组学数据显示,冷冻胁迫后,胞内氨基酸的匮乏并没有因活跃的氨基酸代谢得到及时补充;转录组学数据显示,31 个与氨基酸转运相关的调节基因在冷冻胁迫后虽未表现出显著差异,但其中25 个基因冻后呈现不同程度的下调(表2)。推测冷冻胁迫后胞内氨基酸匮乏的原因为:胞内外的氨基酸在氮代谢与氨基酸代谢中被大量消耗,而氨基酸合成所需的碳源,在低温条件下部分流入糖酵解途径,部分作为贮藏性碳源被积累[43],致使合成氨基酸的碳架不足;另一方面,可能受质膜损伤和氨基酸转运相关基因下调的影响,一定程度限制了氨基酸的跨膜运输与转运效率。综上,面包酵母在冷冻胁迫后加强有机氮源氨基酸的利用,极有可能加剧胞内氨基酸匮乏,致使细胞生长被遏制。
此外,冷冻胁迫下中长链脂肪酸增多,致使质膜僵硬化,对细胞活性有严重影响。而膜蛋白同样是影响细胞活性的重要物质,其参与细胞多种生理调节过程,涉及物质运输,细胞的存活、增殖、分化,形态的发生与器官的形成以及各种信号的传递[44]。转录组学数据表明,与细胞膜蛋白表达相关的19 个基因较冷冻前表现出显著差异,其中9 个基因上调,10 个基因下调(表3)。值得关注的是,渗透压传感器SHO1的编码基因SHO1在冷冻后显著下调,该基因既是膜蛋白的相关调节基因,还对细胞的渗透压调节起到关键作用[45]。由此可见,冷冻胁迫下,膜蛋白相关基因的调节同样是影响细胞活性的原因。

表2 面包酵母冷冻胁迫后与氨基酸转运相关基因的表达情况Table 2 Expression of genes related to amino acid transport in baker’s yeast after freezing stress
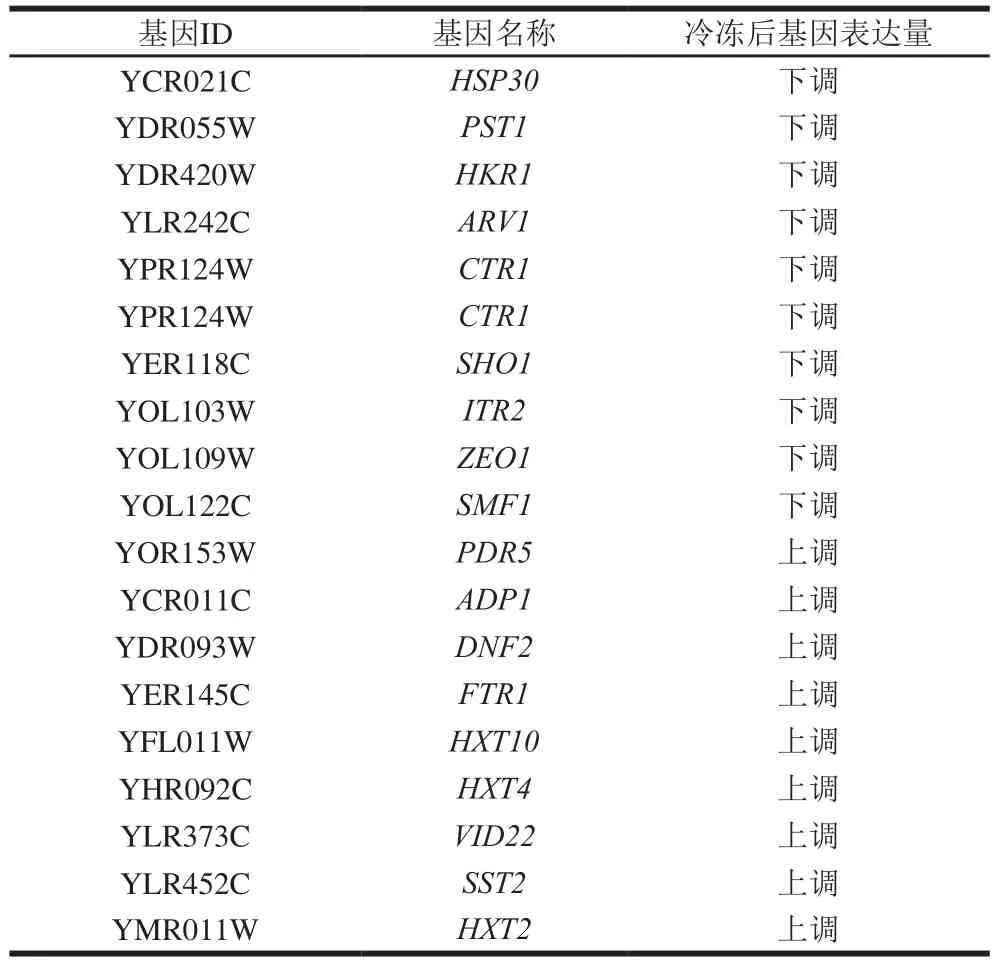
表3 面包酵母冷冻胁迫后与细胞膜上蛋白相关的显著差异基因表达情况Table 3 Significant differential gene expression related to cell membrane proteins in baker’s yeast after freezing stress
3 结 论
面包酵母ABY3在-20 ℃冷冻7 d的条件下,细胞存活率为43%,面团发酵力下降42%,表明冷冻胁迫极大损伤面包酵母生长和发酵性能。代谢组和转录组学分析结果表明,冷冻胁迫下,胞内氨基酸的匮乏与质膜僵硬化可能是影响细胞生长和发酵性能的主要原因,海藻糖积累作为细胞胁迫下的应激保护行为,并不能从根源解决冷冻胁迫对细胞的损伤,对细胞的保护有限。氨基酸的匮乏不仅使细胞应对胁迫环境的能力下降,还使蛋白质合成缺少原料,即便与蛋白质合成相关的氨酰-tRNA生物合成途径被激活,也不足以完全解除蛋白质的合成阻碍,从而致使胁迫后酶的合成不足,影响酵母细胞生长代谢。另外,低温培养通过质膜僵硬化增加膜脂分子的需求[32],虽然冷冻胁迫诱导脂肪酸延长酶编码基因ELO2、ELO3表达,积累不饱和脂肪酸,维护脂质代谢平衡,但不饱和脂肪酸相对含量增多的同时长链脂肪酸相对含量同样增多,并不能完全缓解质膜僵硬化,从而影响细胞生长。本实验研究初步推测了面包酵母对冷冻胁迫的应答机制,在后续研究中,为证实结论,将对相关通路的调控基因进行表达验证,完善酵母细胞自身调节机制。

