传统酸面团菌群结构及其酵制馒头风味物质分析
李晓敏,韩 伟,黎 琪,王 晴,檀馨悦,邹球龙,张晓琳,*
(1.中粮营养健康研究院有限公司,营养健康与食品安全北京市重点实验室,老年营养食品研究北京市工程实验室,北京 102209;2.国家粮食和物资储备局科学研究院,北京 100037)
馒头是我国特有的蒸制面食品,具有结构紧密、口感适宜、便于消化、经济实惠的特点,深受我国人民喜爱[1]。与如今普遍使用商业化酵母发酵不同,传统馒头发酵使用的是自然发酵酸面团。自然发酵酸面团是取自上次发酵后经妥善保存的少量样品,即民间所谓“老面”、“面肥”、“面头”、“酵子”、“酵面”和“面起子”[2]。
酸面团发酵是一种古老的食品生物技术,因近年发现其对烘焙食品的感官、结构、营养及货架期等均有积极意义而被重新审视[3-4]。酸面团中复杂的乳酸菌组成与传统发酵馒头的风味与口感直接相关。乳酸菌在发酵过程中会通过同型发酵和异型发酵产生非挥发性有机酸,并在发酵过程中与酵母菌互利共生,通过生化反应产生醇、醛、酮、酯和羰基化合物,形成种类丰富的风味物质[5-6]。国内外学者对于酸面团菌群结构分析发现,优势细菌有旧金山乳杆菌(Lactobacillus sanfranciscensis)、植物乳杆菌(L. plantarum)和类食品乳杆菌(L. paralimentarius)等,优势真菌有酿酒酵母(Saccharomyces cerevisiae)、扁平云假丝酵母(Candida humilis)、Kazachstania barnettii和K. exigua等,且微生物多样性与原料,尤其是面粉种类存在一定相关性[7-8]。对酸面团挥发性风味物质检测发现,主要包括酮类、醇类、醛类、酸类和酯类化合物等,且采用的萃取检测方法不同,风味物质的种类和含量也不同[9-10]。酸面团作为一个微生态体系,菌群结构复杂,在保存过程中菌群也在不断变化,且各种微生物持续进行如糖化反应、蛋白质分解、酯化反应和产气等一系列生化反应,因此,采用酸面团发酵技术制作馒头难以保证产品质量的稳定性。目前利用该技术制作馒头也仅限于手工限量生产,未广泛应用于工业生产中。与此同时,酸面团发酵技术制作馒头因其风味和质构方面的优势,深受消费者的喜爱。
本研究采用高通量测序手段解析传统发酵酸面团样品中的微生物菌群结构,得到优势菌群信息;同时运用顶空固相微萃取-气相色谱-质谱(headspace-solid phase microextraction-gas chromatograph-mass spectrometry,HS-SPME-GC-MS)联用技术分析其酵制馒头风味物质成分,旨在探讨酸面团菌群结构对风味物质的影响,为微生物菌群结构影响风味物质形成的机理提供重要参考。
1 材料与方法
1.1 材料与试剂
酸面团分别采集自山西(SX)、河北(HB)、青海(QH)、甘肃(GS)和河南(HN);小麦粉 北京古船食品有限公司。
MRS(Man Rogosa Sharpe)肉汤培养基(固体培养基添加1.5%的琼脂)、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基 北京陆桥技术股份有限公司;E.Z.N.A.®Soil DNA Kit 美国Omega BioTek公司;其他试剂或药品为国产分析纯或化学纯。
1.2 仪器与设备
S210 pH计 美国Mettler-Toledo公司;HJ-3数显恒温磁力搅拌器 常州荣华仪器制造有限公司;和面机美国北美电器;SMD-603S醒发箱 无锡胜麦机械有限公司;57330-U固相微萃取装置、75 μm碳分子筛/聚二甲基硅氧烷(carboxen/polydimethylsiloxane,CAR/PDMS)萃取头 美国Supelco公司;GC-MS联用仪日本Shimadzu公司;SW-CJ-2FD型超净工作台 苏净安泰空气技术有限公司;LRH-250F型恒温恒湿培养箱上海一恒科学仪器有限公司;HVE-50立式压力蒸汽灭菌器 日本Hirayama公司。
1.3 方法
1.3.1 pH值和可滴定酸度(titratable acidity,TTA)的测定
称取10 g酸面团,加入90 mL去离子水,搅拌15 min至酸面团完全混匀,测定pH值。以0.1 mol/L NaOH溶液滴定该悬浊液至pH 8.5时,消耗的NaOH溶液体积(mL)即为该样品的TTA值。每个样品平行测定3 次。
1.3.2 乳酸菌和酵母菌菌落数测定
称取10 g酸面团,加入90 mL质量浓度为0.85 g/100 mL无菌生理盐水,搅拌至酸面团完全混匀,采用10 倍梯度稀释,将稀释液涂布于含有0.02%放线菌素的MRS培养基平板,37 ℃厌氧条件下恒温培养48 h,记录乳酸菌菌落数。将稀释液涂布于含有0.03%链霉素PDA培养基平板,30 ℃恒温培养60 h,记录酵母菌菌落数。
1.3.3 菌群多样性分析
根据E.Z.N.A.®Soil DNA Kit操作手册提取酸面团中微生物总DNA。采用338F-806R为引物扩增16S rDNA V3-V4区序列。采用SSU 0817F-SSU 1196R为引物扩增18S rDNA V4-V5区序列,将聚合酶链式反应产物送至上海美吉生物医药科技有限公司,Illumina MiSeq平台测序。使用软件UPARSE依据97%相似度对非重复序列进行可操作分类单元(operational taxonomic units,OTU)聚类。使用RDP Classifier贝叶斯算法对得到的OTU序列进行分类学分析。
1.3.4 酸面团发酵制作馒头
称取50 g酸面团,加入300 mL去离子水,搅拌15 min至酸面团完全混匀,再加入500 g面粉,混合均匀后揉至面团表面光滑,放置在温度37 ℃、相对湿度85%的醒发箱中醒发3 h,取出发酵膨胀的酸面团,加入500 g面粉及3 g碱,揉匀后制成馒头状面坯,继续在温度37 ℃、相对湿度85%的醒发箱中醒发40 min,取出蒸汽条件下蒸制20 min,放冷后备用。
1.3.5 SPME-GC-MS检测馒头中挥发性风味物质
挥发性成分的萃取:称取3 g馒头样品于15 mL样品瓶中,将样品瓶置于75 ℃水浴锅内,平衡30 min,将老化好的CAR/PDMS萃取头插入样品瓶的上空,75 ℃水浴锅内顶空萃取30 min后进样。每次萃取前,将萃取头在250 ℃条件下洗脱10 min[10]。
GC条件:色谱柱为DB-5MS(60 m×0.32 mm,1 μm),载气为 99.9999%高纯氦气,进样模式为不分流;柱箱升温程序经优化为:初始炉温50 ℃,保持2 min,以5 ℃/min升至220 ℃,保持3 min,再以3 ℃/min升至250 ℃,保持5 min。
MS条件:接口温度280 ℃;连接杆温度150 ℃;电子电离源,电子能量70 eV,离子源温度230 ℃,采集方式为全扫描,质量扫描范围m/z40~550。
挥发性成分定性定量分析:GC-MS图经计算机和人工检索把每个峰同时与NIST 08.Library和Wiley Library匹配,确定挥发性物质的化学成分。峰面积表示物质相对含量。
2 结果与分析
2.1 酸面团酸度与菌落总数分析
如表1所示,乳酸菌菌落数范围为4.89~8.31(lg(CFU/g)),各地差异显著(P<0.05),以SX样品最大,HN样品最少。酵母菌菌落数变化范围为4.75~6.08(lg(CFU/g)),SX和QH两地样品显著高于其他地区(P<0.05)。不同地区样品乳酸菌和酵母的比例不同,SX和QH样品中乳酸菌和酵母菌的比例大于100∶1,HB和GS样品中两者的比例为10∶1,而HN样品中两者的比例为1∶1,与其他研究结果一致[11-12]。由于SX和QH样品中乳酸菌菌落数相对较高,则pH值较低,但所有样品的pH值并无显著性差异。所有样品TTA值在3.73~4.30 mL(0.1 mol/L NaOH溶液)之间,SX和GS样品的TTA值显著高于其他样品。结果表明传统酸面团样品中富含乳酸菌和酵母菌,不同地区乳酸菌和酵母菌的含量和比例差异明显,可能和当地的地理位置、气候、面粉种类和发酵程度等因素有关[13]。而产酸微生物种类和数量不同,各样品所产生的有机酸种类和含量也不同,成为影响酵制馒头风味物质的关键因素[12,14]。
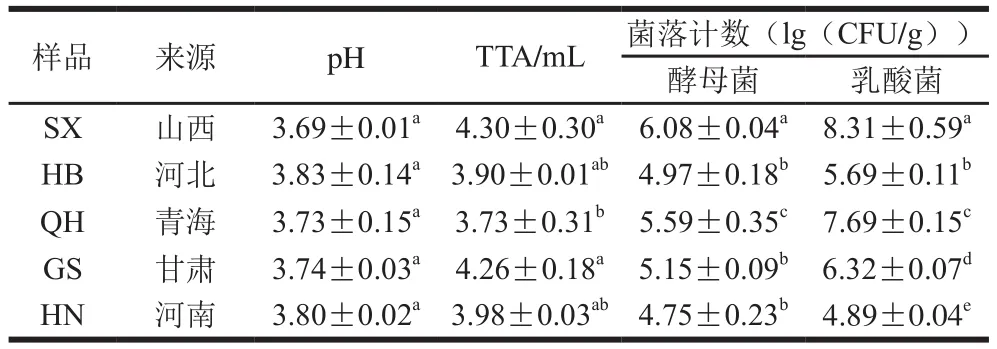
表1 酸面团样品酸度与菌落总数结果Table 1 Acidity and lactic acid bacteria and yeast counts in sourdough samples
2.2 酸面团中菌群多样性分析
2.2.1 细菌多样性分析

图1 酸面团样品细菌在门(A)和属(B)水平的相对含量Fig.1 Relative abundance of bacterial community composition in sourdough samples at the phylum (A) and genus (B) levels
如图1A所示,细菌分属5 个门,分别为放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻菌门(Cyanobacteria)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)。厚壁菌门在所有样品中都占有绝对优势,除SX样品相对含量达89.3%外,其余样品中相对含量均在99%以上,蓝藻菌门和变形菌门在SX样品中相对含量分别达7.0%和3.6%,而在其余样品中相对含量均不足1%。此外,拟杆菌门只在SX样品中出现,放线菌门在SX、GS和HN样品中都有出现,但相对含量很少,不足0.1%。
如图1B所示,共有26 个属被检测到。SX样品含有种类最多,为20 种,其次为HB和HN样品,分别为12 种和15 种。5 个样品中的优势属有乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)和乳球菌属(Lactococcus)。乳杆菌属在HN样品中相对含量最多,为96.5%,在SX和QH样品次之,分别为87.8%和32.4%,在HB和GS样品中相对含量最少,分别为19.6%和16.2%。魏斯氏菌属在HB和GS相对含量分别高达79.8%和83.2%,而在其余样品中相对含量不足1%。除乳杆菌外,QH中的优势菌为乳球菌属和明串珠菌属(Leuconostoc),相对含量分别为57.7%和6.6%,而这两种菌除明串珠菌属在HN中相对含量达2.2%外,在其他样品中相对含量相对较少,不足1%。SX样品中另外两种含量相对较多的为醋杆菌属(Acetobacter)和chloroplast_norank(分别为2.7%和7.0%),chloroplast_norank在其他样品中也有被检测到,但含量很少。肉食杆菌属(Carnobacterium)、金黄杆菌属(Chryseobacterium)和埃希氏杆菌属-志贺氏杆菌(Escherichia-Shigella)为SX样品所特有,相对含量较少。芽孢杆菌属(Bacillus)在所有样品中均有出现,而假单胞菌属(Pseudomonas)只在SX、HB和QH样品中出现,两者相对含量均不足0.1%,肠球菌属(Enterococcus)、芽孢八叠球菌属(Sporosarcina)和链球菌属(Streptococcus)也只在QH样品中出现。
与其他关于酸面团的研究相似,乳杆菌属为优势菌群[15-16],且乳杆菌作为乳酸菌中最重要的组成部分,不仅对人体肠道平衡起重要作用,还是目前市场上比较成熟的益生菌产品[17]。有研究显示,乳杆菌中产胞外多糖的菌种对于面团的起酵性能有增强作用[18]。刘同杰等[12]对传统酸面团中的细菌进行分离鉴定,得到大部分为乳杆菌属,包括短乳杆菌(L. brevis)、植物乳杆菌和旧金山乳杆菌等。醋杆菌属是香醋生产中的优势菌种,对于有机酸产生和风味物质形成均有重要作用[19],有研究提出Chloroplast在天津独流老醋醋酸发酵过程中为优势科[20],然而,张海燕等[16]在老面的研究中提出叶绿体序列的出现可能是老面店铺污染所致。乳球菌属被报道对于泡菜的风味形成起重要作用,同时在酸奶发酵过程中对于酸化和风味形成至关重要[21-22]。明串珠菌被报道能产生葡聚糖和VK等物质,在面制品风味上拥有潜在的应用价值,且其含量越高风味物质的产生可能越多[23-24],而芽孢杆菌属能够分泌较高水平的α-淀粉酶,对样品的糖化作用有利[25]。值得注意的是,埃希氏菌属-志贺氏杆菌作为肠杆菌科(Enterobacteria)的一个属,是粪便中的主要菌属[26],而肠杆菌科分条件致病菌和非条件致病菌,部分为肠道内正常菌群,部分能降解糖产生有机酸[27],研究发现肠杆菌在酒曲中为优势细菌,且对于米酒的酸味口感有重要作用[28]。
2.2.2 真菌多样性分析

图2 酸面团样品真菌在门(A)和属(B)水平的相对含量Fig.2 Relative abundance of fungal community composition in sourdough samples at the phylum (A) and genus (B) levels
在图2A中,共检测出6 个真菌物种,除Eukaryota_unclassified未被鉴定外,其余分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、纤毛门(Ciliophora)、Mucoromycotina和Phragmoplastophyta。与其他发酵食品研究结果一致[28-30],子囊菌门为优势菌,除GS样品中相对含量为83.9%外,其余样品中相对含量均达到99.0%以上,在SX样品中最高为99.96%,说明其在酸面团发酵中起重要作用。担子菌门和Phragmoplastophyta在所有样品中都有检出,除担子菌门在GS样品中相对含量达到15.9%外,两者在所有样品中相对含量均不足1%,且纤毛门、Eukaryota_unclassified和Mucoromycotina分别只在GS、SX和HN样品中出现,相对含量均很少。
在图2B中,从属水平看,共检出30 个物种,不同样品的优势菌种类和含量有所差异;其中GS样品检测种类最多,为22 种,QH样品检测种类最少,为13 种。总体来说,真菌的优势属为酵母属(Saccharomyces)、毕赤酵母属(Pichia)、假丝酵母属(Candida)、耐碱酵母属(Galactomyces)、曲霉属(Aspergillus)、赤霉菌属(Gibberella)和Filobasidiaceae_norank。SX样品中优势属为毕赤酵母属、酵母属和耐碱酵母属,相对含量分别为92.0%、5.5%和1.4%。HB样品中含量较多的是酵母属和假丝酵母属,分别达到77.3%和12.7%,其余为曲霉属、毕赤酵母属和赤霉菌属,相对含量分别为3.9%、3.0%和1.6%。曲霉属和赤霉菌属在所有样品中都有检测到,除在GS样品中相对含量分别达8.8%和4.6%外,在其余样品中相对含量均不足1%。QH样品中酵母属占有绝对优势,相对含量高达97.5%,另一优势菌为毕赤酵母属,相对含量为1.9%。酵母属在GS和HN中同样为优势菌,相对含量分别高达68.4%和96.8%。此外,Filobasidiaceae_norank在GS样品中相对含量为12.9%,而在其余样品中相对含量很少。剩余23 个属为非优势菌属,所有样品中都出现但未鉴定的包括Liliopsida_norank和Onygenales_unclassified;Eukaryota_unclassified只出现在SX中,Ascomycota_unclassified、Hannaella和Microbotryomycetes_unclassified只在HB中出现,而只在HN样品中出现的为Hypocreales_unclassified、Issatchenkia和毛霉属(Mucor)。
毛霉在黄酒的生产过程中与风味物质含量呈正相关[31],曲霉属和赤霉菌属在其他相关研究中也有发现[30]。曲霉属属于丝状真菌,为酱香酒醅、酱香大曲[32]、浓香大曲[33]和黄酒麦曲中的优势功能菌属[34],代谢产生多种酶类、有机酸和脂肪酸等产物,对于酒体风味的提升有重要作用[35-36]。酵母属是酸面团中的主要微生物,对于面团的起酵性和疏松性有至关重要的作用,在发酵过程中,面粉中蛋白质吸水膨胀形成面筋质阻止酿酒酵母产生的二氧化碳溢出,从而提高面团的保气能力,同时增加面团的营养与风味物质[37]。刘建利等[30]对18 个面引子的真菌多样性进行分析证实,除其中1 个样品的优势属为哈萨克酵母属外,其余17 个样品优势属均为酵母属,此外,还在样品中检测出不同丰度的假丝酵母属、曲霉属和赤霉属,与本研究结果一致。张国华[38]采用聚合酶链式反应-变性梯度凝胶电泳法研究我国5 个小麦主产区的面食发酵剂中微生物结果显示,除酿酒酵母为主要优势菌外,还发现杰丁毕赤酵母(P. jadinii)、异常毕赤酵母(P. anomala)、热带假丝酵母(C. tropicalis)等非酿酒酵母。非酿酒酵母(假丝酵母属和毕赤酵母属等)属于好氧型酵母,对面团发酵也显示出一定的起酵性能[39]和风味提升作用[40]。发酵过程中,非酿酒酵母可以产生甘油、乙酸乙酯、高级醇及其他挥发性化合物[41],对葡萄酒、白酒和豆酱等发酵食品的风味物质形成有重要作用[41-43]。但也有非酿酒酵母对产品的感官特征产生不良气味和影响的报道,张鹏[44]在泡菜发酵的过程中发现毕赤酵母属酵母的大量繁殖会使其表面有白膜产生并带有一定的恶臭味;同样,毕赤酵母在酸粥发酵过程中对风味品质形成无积极影响[45]。
2.3 酵制馒头的挥发性风味物质分析
利用酸面团样品发酵制作馒头,采用HS-SPME-GC-MS检测馒头中的挥发性风味物质。经解谱,样品中共检出42 种挥发性成分,包括醇类、醛类、酯类、芳香类、烃类等(表2、图3)。其中HB样品种类最多,为30 种,SX、QH和GS样品分别为26 种,HN样品为25 种,且不同馒头样品风味物质总含量排序为SX>HN>GS>QH>HB。所有酸面团馒头的挥发性成分以醇类、醛类、酯类和芳香类为主,这与文献[46-48]研究结果一致。
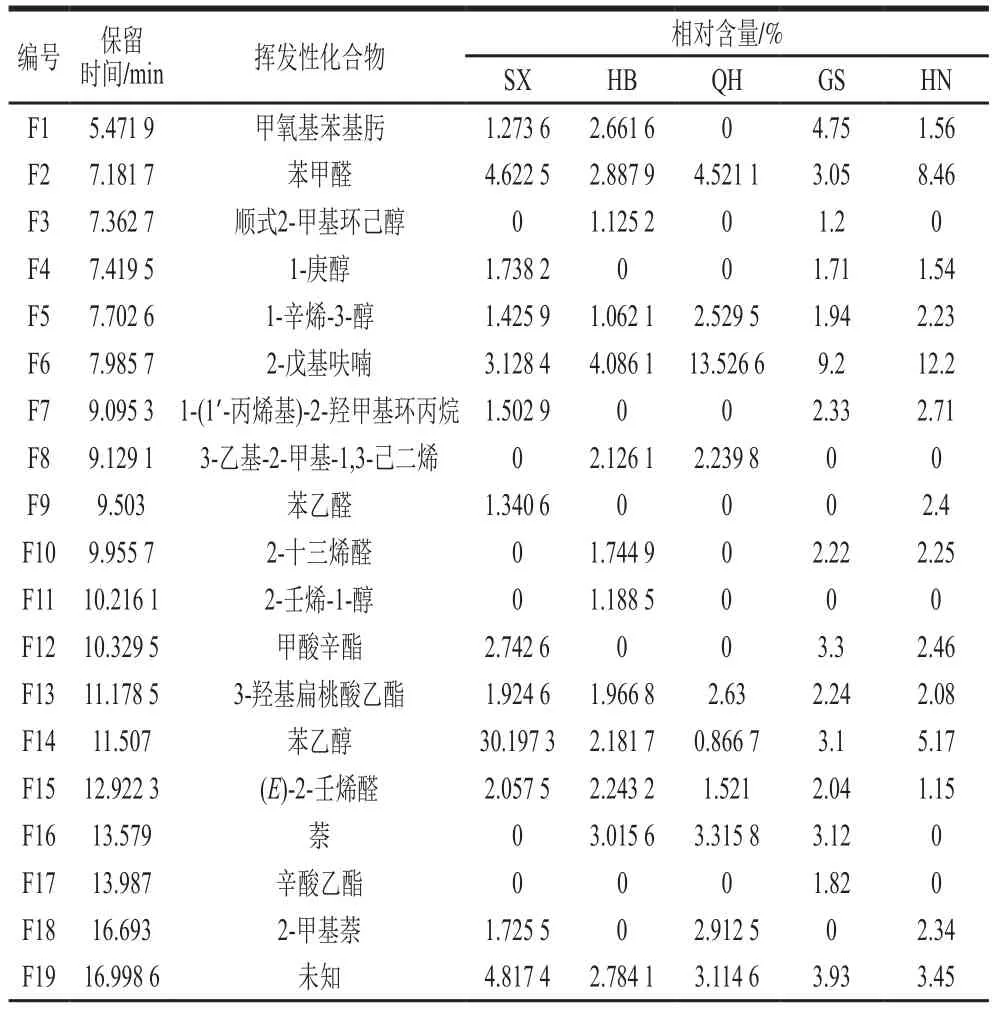
表2 不同馒头挥发性风味物质分析结果Table 2 Volatile flavor compounds identified in traditional sourdough and steamed bread made with it

续表2
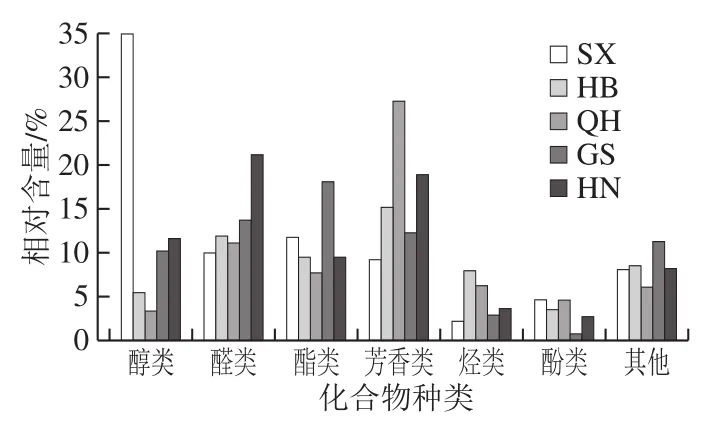
图3 不同馒头中挥发性风味物质类别Fig.3 Relative contents of different classes of of volatile flavor compounds in steamed breads made with different sourdough samples
SX样品中醇类、醛类和酯类约占70.0%,且醇类以苯乙醇为主,占总含量37.1%,远多于其他样品,这可能是由于SX样品中非酿酒酵母相对较多,产生更多高级醇的原因[49]。HB和GS样品中醇、醛、酯和芳香类物质含量分布比较均匀,GS中酯类相对含量较多,包括甲酸辛酯、辛酸乙酯、棕榈酸乙酯和亚油酸乙酯等。QH样品中相对含量较多的是芳香类,占总含量39.8%。HN样品中醛类和芳香类物质相对含量较多,且醛类物质相对含量均高于其他样品,包括苯甲醛、苯乙醛、2-十三烯醛和(E,E)-2,4-葵二烯醛等,(E,E)-2,4-葵二烯醛散发甜橙香气,同时带有脂肪气息,此外,2-戊基呋喃作为一种不饱和醇,具有蘑菇、薰衣草和干草香气,在其他老面馒头中也有检测到[50]。辛酸乙酯是GS中特有的挥发性风味物质,苯并环庚三烯和1,2,3-三甲基-4-丙烯基-萘是HB中特有的挥发性风味物质,亚硫酸壬基戊酯和二氢-5-戊基-2(3H)-呋喃酮是SX中特有的挥发性风味物质,6-叔丁基-2,4-二甲基苯酚、4-仲丁基-2,6-二叔丁基苯酚和棕榈酸是QH中特有的挥发性风味物质,这些物质共同组成了酸面团制品的独特香气。苯乙醇多存在苹果、草莓和蜂蜜等天然植物中,具有玫瑰花香味,是馒头的重要呈香物质[51]。苯乙醛可以作为香精使用,具有浓郁的玫瑰花香气;苯甲醛具有令人愉快的坚果香、水果香和杏仁香[52-53],是重要的食品用香料;萘有温和芳香气味,甲酸辛酯和辛酸乙酯均可以用作香料,分别用于调制水果香精和调味料,而亚油酸乙酯为浓香型白酒的重要香气成分[54]。本研究除棕榈酸外并没有检测出其他酸类物质,而刘娜等[50]研究结果显示,碱的加入会导致酸面团馒头酸类物质含量下降,对醛酮类、芳杂环类、内酯类和烷烃类化合物几乎没有影响。本研究还检出一定量的烷烯烃类,而由于烯烃类物质阈值较大,对风味提升贡献不大[54]。

图5 酸面团中真菌菌群与挥发性风味物质的相关性分析热图Fig.5 Correlation heat map between fungal flora and volatile flavor components in sourdough samples
2.4 酸面团优势菌群与挥发性风味物质相关性分析
由图4可知,链球菌属、芽孢八叠球菌属、肠球菌属、埃希氏杆菌属-志贺氏杆菌、金黄杆菌属、醋杆菌属、肉食杆菌属、葡萄球菌属(Staphylococcus)、梭菌属(Clostridium)、Kluyvera、不动杆菌属(Acinetobacter)与挥发性风味物质呈显著正相关;乳球菌属、芽孢杆菌属和假单胞菌属与挥发性风味物质呈显著负相关。挥发性风味物质与细菌菌群结构关系复杂,某一成分可能受多种微生物协调作用。明串珠菌属对2-甲基萘、十六烷有显著正向作用,对甲氧基苯基肟、顺式2-甲基环己醇和邻苯二甲酸二异丁酯有显著负向作用,而魏斯氏菌属则恰好相反,对2-甲基萘、十六烷有显著负向作用,而对甲氧基苯基肟、顺式2-甲基环己醇和邻苯二甲酸二异丁酯有显著正向作用。乳杆菌属为酸面团中主要优势细菌,对苯甲醛、苯乙醛和十六烷有显著正向作用,而对顺式2-甲基环己醇则为显著负向作用,因此,乳杆菌属含量最高的HN样品中检测出的醛类物质含量也最多。此外,片球菌属对1-庚醇的正向作用可能也是SX样品中醇含量高的原因之一。
由图5可知,除Cochliobolus与挥发性风味物质呈显著负相关之外,大部分真菌与挥发性风味物质呈显著正相关,而毕赤酵母属、Trichosporon、Liliopsida_norank、Agaricales_unclassified和Wallemia则与个别挥发性物质呈显著负相关,如三甲基硅烷基-2,4-二[(三甲基硅烷基)氧基]苯甲酸酯、2,4,6-辛三烯醛和苯乙醇等。酿酒酵母是面团发酵过程的主要微生物群体,它可以将面粉中约95%的可发酵糖转化成乙醇和二氧化碳,剩余糖则参加次级代谢,生成一些风味物质[55]。本研究结果显示,酿酒酵母对2-戊基呋喃有显著正向作用。赤霉属和曲霉属对甲氧基苯基肟、顺式2-甲基环己醇和邻苯二甲酸二异丁酯有显著的正向作用,GS样品中赤霉属和曲霉属含量较高可能是其酯类物质含量高的原因之一。SX样品中耐碱酵母属含量较高,而耐碱酵母对苯乙醇和1-庚醇的正向作用显著。
3 结 论
本研究通过分析酸面团中菌群结构发现,细菌的优势菌群为乳杆菌属、乳球菌属和魏斯氏菌属,真菌属的优势菌群为酵母属、毕赤酵母属、假丝酵母属,菌群结构的不同显著影响了风味物质的种类和含量。采用HS-SPME-GC-MS检测酸面团酵制馒头中的挥发性风味物质,共检出42 种挥发性成分,以醇类、醛类、酯类和芳香类为主,风味物质在种类和含量上也存在较大差异性。结果表明酿酒酵母对风味物质生成有显著正向作用,乳杆菌属、明串珠菌属和魏斯氏菌属等微生物与大部分挥发性风味物质呈显著正相关,而与部分物质呈显著负相关。本实验增进了酸面团样品中微生物菌群结构和挥发性风味物质相关性的基础研究,为进一步研究微生物菌群结构对风味物质形成的机理提供参考,为下一步通过深入挖掘菌群信息、提升馒头特征风味物质和品质研究提供方向,为开发具有特征性香气成分、工业化生产主食发酵剂提供理论依据。

