植物乳杆菌p-8转化亚油酸为共轭亚油酸的分析
赵 微,张 峰,张和平,赵国芬,*
(1.内蒙古农业大学生命科学学院,内蒙古 呼和浩特 010018;2.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
共轭亚油酸(conjugated linoleic acid,CLA)是亚油酸(linoleic acid,LA)代谢产生的不同位置和几何异构体的统称,也是细菌解除LA毒性的一种机制。其中cis9,trans11-CLA(c9,t11-CLA)、trans10,cis12-CLA(t10,c12-CLA)和trans9,trans11-CLA(t9,t11-CLA)是3 种主要发挥益生功能的异构体[1]。目前,CLA以具有抗肿瘤、抗动脉粥样硬化、调节免疫系统和降脂等生理功能,在食品和药学领域有很好的应用[2-6]。CLA的天然来源是反刍动物食品[7],但含量低,不能满足人们的需求。CLA也可化学异构法、微生物转化和重组酶法生产。化学异构法生产的CLA产量高,但异构体多样,分离纯化困难,副产物残留,应用不安全[8]。微生物直接发酵生产CLA,存在发酵成本高、条件不易控制和CLA产量不足而难以商品化的问题。酶催化得到的CLA活性异构体单一,条件易控制,产量高,并且重组酶更是产量高、纯度高和效率高,不失为一个很好的途径。而要想获得重组酶,高产CLA的细菌是其很好的基因来源。

图1 L. plantarum转化CLA途径Fig.1 Pathway for the conversion of LA to CLA in L. plantarum
许多细菌可以转化LA为CLA,主要包含瘤胃细菌[9-10]、乳酸菌[11-12]和丙酸杆菌[13-14]三类。不同微生物转化LA生成CLA的机制和异构体不同。目前,有关LA生成CLA途径主要有5 种:第一,如反刍动物瘤胃溶纤维丁酸菌由c12,t11-LA异构酶催化LA异构为c9,t11-CLA[15],该酶活性不受辅助因子和氧气的影响;第二,如痤疮丙酸杆菌由c12,t11-LA异构酶催化LA异构化为t10,c12-CLA[16];第三,由一个亚油酸异构酶系催化LA转化为c9,t11-CLA、t10,c12-CLA和t9,t11-CLA,异构酶系包括脂肪酸水合酶(CLA-HY)、羟基脂肪酸脱氢酶(CLA-DH)、乙酰乙酸脱羧酶(CLA-DC)(图1A),如植物乳杆菌(Lactobacillus plantarum)AKU1009a[17];第四,也是由CLA-HY、CLA-DH和CLA-DC共同催化完成,但转化产物主要是c9,t11-CLA和t9,t11-CLA(图1B),如L. plantarumZS2058[18];第五,最近报道一些乳酸杆菌将LA经CLA-HY催化为10-羟基-顺12-十八碳烯酸(10-hydroxy-cis-12-octadecenoic acid,10-HOE),然后在多功能烯醇化酶的作用下将10-HOE转化为c9,t11-CLA,如L. plantarumATCC8014[19-20]。
L. plantarump-8是实验室前期从内蒙古传统发酵酸奶中分离得到。临床研究表明,该菌可提高奶牛产奶量、提高肉鸡免疫能力、缓解成年人压力和焦虑等[21],其发酵豆乳和葵花籽油后用紫外法检测到有CLA的生成[22],但L. plantarump-8催化LA转化为CLA的机制目前尚不清楚。本实验研究L. plantarump-8菌体、菌体破碎液(天然粗酶)和重组亚油酸异构酶系转化CLA的能力与机制,旨在为利用重组酶催化生产CLA提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与质粒
本实验所用L. plantarump-8菌株和重组质粒pET-28a(+)-CLA-HY、pET-28a(+)-CLA-DH、pET-28a(+)-CLA-DC由本实验室构建和保藏,E. coliTransetta(DE3)和E. coliBL21(DE3)Chemically Competent Cells购自北京全式金生物技术有限公司。
1.1.2 试剂
LA(≥99%)、c9,t11-CLA(≥96%)、t10,c12-CLA(≥96%)、t9,t11-CLA(≥98%) 美国Sigma公司;一抗(Rabbit Anti-His tag antibody) 北京博奥森生物技术有限公司;二抗(Goat anti-Rabbit IRDye®800CW) 美国LI-COR公司;总RNA提取试剂盒北京天根生化有限公司;PrimeScript™ 1st Strand cDNA Synthesis Kit 大连TaKaRa公司;Power SYBR Green PCR Master Mix 美国Invitrogen公司;其他试剂均为国产或进口分析纯;气相色谱溶剂均为国产色谱纯。
1.1.3 培养基
MRS乳酸菌培养基和LB大肠杆菌培养基配制参考文献[23]。
1.2 仪器与设备
恒温摇床 上海福玛实验设备有限公司;低温高速离心机 美国Sigma公司;JY92-2D超声波细胞破碎机 宁波新芝科技股份有限公司;高温高压灭菌锅 日本Hirayama公司;垂直板电泳槽 北京百晶公司;W-CJ-2FD单面净化工作台 苏州净化设备有限公司;450气相色谱仪 美国瓦里安公司;DSQ II气相色谱-质谱联用仪 美国Thermo公司;qTOWER384G实时荧光定量聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)仪 德国耶拿公司;ODYSSEY 9120红外激光扫描成像系统 美国LI-COR公司。
1.3 方法
1.3.1L. plantarump-8菌体催化LA转化CLA
挑取L. plantarump-8单菌落在MRS培养基中连续培养2 代后,按1%接种量接种于含有0.5 mg/mL LA的MRS培养基中,对照组不添加LA,在37 ℃恒温培养箱中静置培养3 d。6 000 r/min、4 ℃离心10 min收集上清液和菌体。上清液用于CLA分析。菌体重悬于KPB缓冲液(20 mmol/L,pH 6.5)中,清洗2 次,在冰浴中进行超声破碎后(功率400 W;间歇4 s,破碎2 s,共30 min),进行两种处理,一部分菌体破碎液用于CLA分析;为了比较菌体直接催化和天然粗酶催化的效果,一部分用作天然粗酶液体外再催化LA转化CLA。每组3 个重复。
1.3.2L. plantarump-8天然酶催化LA转化CLA
体外反应总体系为1 mL,在KPB缓冲液(20 mmol/L,pH 6.5)中包含35 μmol/L LA、0.2%吐温80、0.1 mmol/L黄素腺嘌呤二核苷酸(flavin denine dinucleotide,FAD)、5 mmol/L烟酰胺腺嘌呤二核苷酸还原态(nicotinamide adenine dinucleotide reduction,NADH)和5 mmol/L烟酰胺腺嘌呤二核苷酸氧化态(nicotinamide adenine dinucleotide oxidation,NAD+),实验组为200 μL 1.3.1节的菌体破碎液,对照组为200 μL煮沸15 min灭活的菌体破碎液。将反应体系放置于150 r/min的摇床中37 ℃反应1、3、5 d和7 d。取上清液进行CLA分析。
1.3.3L. plantarump-8菌体催化LA转化CLA关键酶的mRNA表达量分析
杨波[18]研究发现乳酸菌产生CLA相关酶基因的表达量在10 h最大,所以本实验在L. plantarump-8在培养10 h菌体进行各酶转录水平分析[24]。挑取L. plantarump-8单菌落在MRS培养基中连续培养2 代后,按1%的接种量接种于含有LA(0.05 mg/mL)的MRS培养基中,在37 ℃恒温培养箱中静置培养10 h。离心收集菌体,使用总RNA提取试剂盒说明书提取总RNA。取1 μg RNA按照PrimeScript™ 1st Strand cDNA Synthesis Kit的说明书进行反转录。将所得的cDNA参照Power SYBR Green PCR Master Mix的说明书准备real-time PCR体系,用real-time PCR仪进行分析,引物见表1。
real-time PCR数据分析:以16S rRNA为内参基因,根据real-time PCR所得Ct值,按照2-ΔΔCt法分析每个基因相较于对照组的相对表达量[18]。
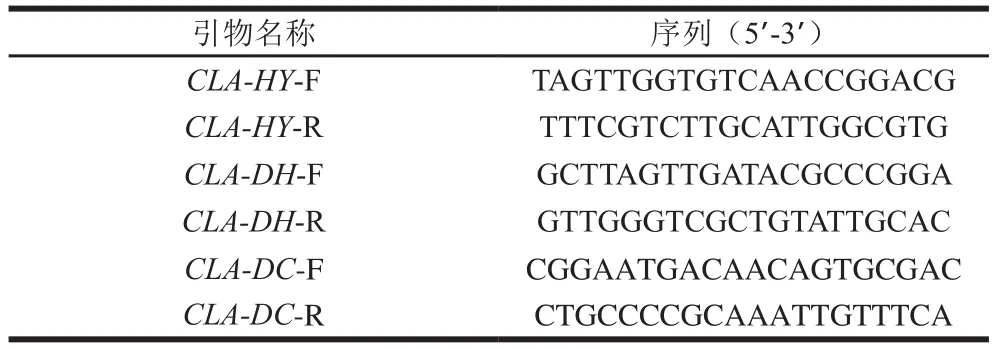
表1 用于real-time PCR的引物Table 1 Primers used for real-time PCR
1.3.4 重组CLA-HY、CLA-DH和CLA-DC的诱导表达
将重组质粒pET-28a(+)-CLA-HY和pET-28a(+)-CLA-DC分别转化入E. coliBL21(DE3)中,重组质粒pET-28a(+)-CLA-DH转化入E. coliTransetta(DE3)中,用于表达重组CLA-HY、CLA-DH和CLA-DC。分别挑取转化后单菌落于含有50 μg/mL卡那霉素的LB培养基中,在转速为180 r/min的摇床中37 ℃培养过夜。按2%接种量接种于含有50 μg/mL卡那霉素的LB培养基中,在转速为180 r/min的摇床中37 ℃培养至菌体浓度在OD600nm为0.6~0.8之间。随后加入异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)至终浓度为0.1 mmol/L,在转速130 r/min摇床中16 ℃诱导14 h表达重组CLA-HY、CLA-DH和CLA-DC,收集菌体并破碎,12 000 r/min离心1 h取上清液。上清液经12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白后,进行Western Blot鉴定。
1.3.5 重组亚油酸异构酶系催化LA转化CLA
分别含有等湿质量的重组CLA-HY、CLA-DH和CLA-DC的菌体破碎液(粗酶液)进行体外LA转化CLA的能力测定。对重组酶活性的体外检测采用两种方法:一步法和分步法。每一种方法分3 组,即对照组、无辅助因子和辅助因子组,每组3 个重复。
一步法即将3 个酶混合后催化法。为了比较辅助因子对酶催化的影响,无辅助因子组的反应总体系为1 mL,在KPB缓冲液(20 mmol/L,pH 6.5)中包含35 μmol亚油酸、0.2%吐温80和重组CLA-HY、CLA-DH和CLA-DC的粗酶液各200 μL。有辅助因子组的反应体系在无辅助因子体系基础中含0.1 μmol/mL FAD、5 μmol/mL NADH和5 μmol/mL NAD+。对照组除酶为煮沸15 min灭活的菌体破碎液外,其他成分与无辅助因子组相同。将反应体系放置于150 r/min的摇床中37 ℃反应1、3、5 d和7 d。取上清液进行CLA分析。
分步法即分5 步依次加入含重组CLA-HY、CLADH、CLA-DC、CLA-DH和CLA-HY的菌体破碎催化反应。无辅助因子组和有辅助因子的每一步反应体系为KPB缓冲液(20 mmol/L,pH 6.5)中包含表2中各成分(终含量)。对照组除酶为煮沸15 min灭活的菌体破碎液外,其他成分与无辅助因子组相同。每一步反应条件:在150 r/min的摇床中37 ℃反应2 d。每一步反应结束后,取上清液进行CLA分析。
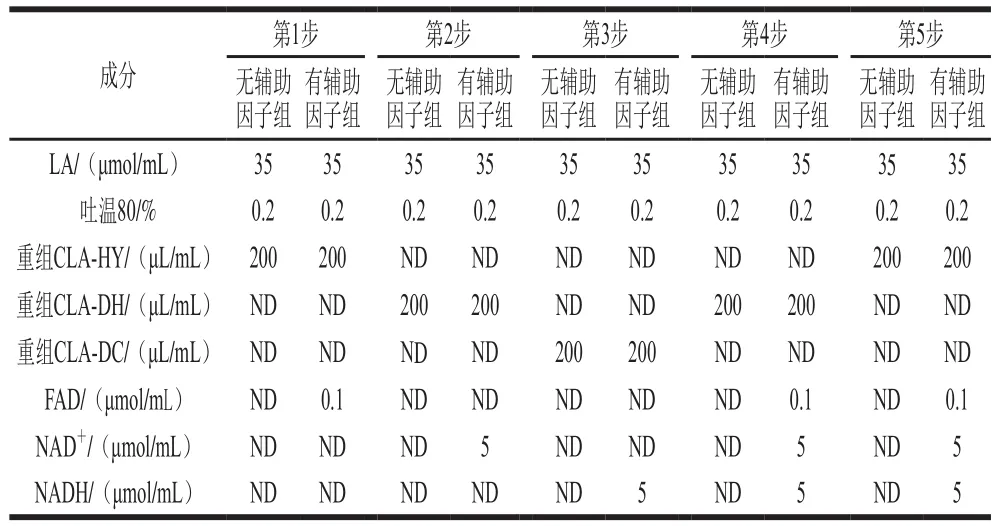
表2 分步法各反应体系成分Table 2 Reaction system components for each step in the stepwise method
1.3.6 样品中CLA甲酯化及气相色谱检测条件
取各待测样品1 mL,分别加入1 mL异丙醇和5 mL正己烷,充分振荡30 s萃取脂肪酸,4 500 r/min离心5 min,吸取上层正己烷相,用N2吹干。加入2 mL 4%盐酸-甲醇溶液,50 ℃水浴20 min进行甲酯化,加入1 mL H2O,再加入5 mL正己烷萃取甲酯化后的脂肪酸,N2吹干后回溶于500 μL正己烷中。使用Varian 450气相色谱仪对甲酯化后的脂肪酸和各CLA甲酯标准品进行分析。色谱柱:SP2560(100 m×0.25 mm, 0.2 μm);检测器:火焰离子化检测仪;升温条件:120 ℃保持5 min后以3 ℃/min的速率升至230 ℃,保持3 min,再以1.5 ℃/min的速率升至240 ℃,保持13 min;检测器温度:260 ℃;气体流速:H230.0 mL/min,Air 300.0 mL/min,N21.0 mL/min;进样量:1 μL;分流比:1∶10。检测后采用面积归一化法分析CLA占总脂肪酸(total fatty acid,TFA)的百分比[25]。
1.3.7 来源于7 株乳酸菌的CLA-HY的结构分析
从NCBI数据库(https://www.ncbi.nlm.nih.gov/)中获得来源于动物双歧杆菌(Bifidobacterium animalis)BB-12(GenBank:ADC85468.1)、L. plantarumZS2058(GenBank:ALF15778.1)、L. plantarumST-III(GenBank:ADN97339.1)、L. plantarumATCC8014(GenBank:CBY45494.1)、L. plantarumWCFS1(GenBank:NP_783979.1)、嗜酸乳杆菌(Lactobacillus acidophilus)NCFM(GenBank:AAV42528.1)和L. plantarump-8(GenBank:AGL62865.2)的CLA-HY氨基酸序列,使用DNAMAN软件对各氨基酸序列进行比对分析。进一步使用SWISS-MODEL(https://swissmodel.expasy.org/)进行同源建模,分析各个氨基酸的三维结构及活性中心。使用Pymol软件显示蛋白质的三维结构。
1.4 数据处理
2 结果与分析
2.1 L. plantarum p-8及菌体破碎液催化LA转化CLA
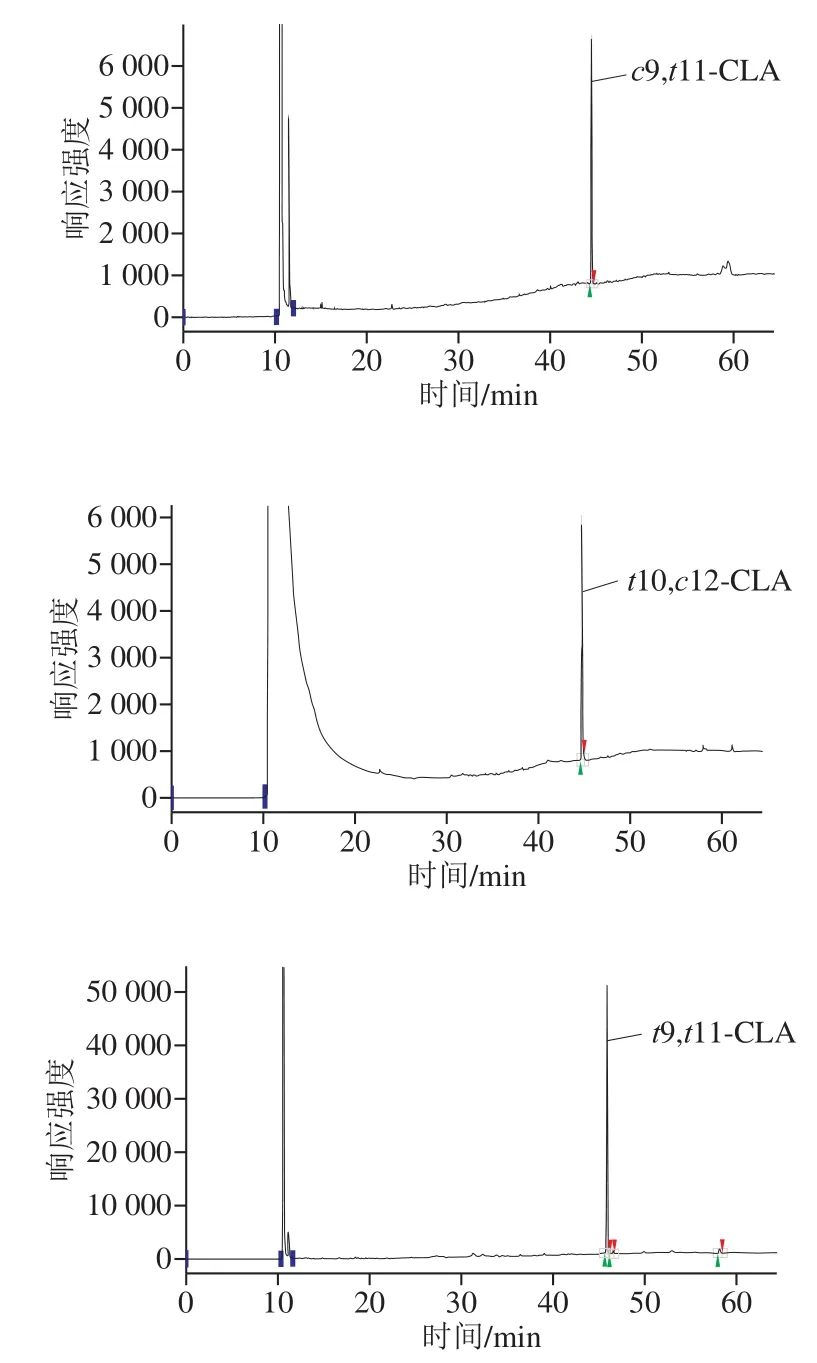
图2 c9,t1 1-CLA、t10,c12-CLA和t9,t11-CLA甲酯化标准品气相色谱分析Fig.2 GC chromatograms of c9,t11-CLA, t10,c12-CLA and t9,t11-CLA standards
c9,t11-CLA、t10,c12-CLA和t9,t11-CLA甲酯化标准品的出峰时间分别在44.42、44.74 min和45.60 min处(图2)。对L. plantarump-8菌体催化LA 3 d后的发酵上清液和菌体破碎液用气相色谱进行脂肪酸组成分析。发现培养基中不添加LA时,无论发酵上清液还是菌体均无CLA产生,而添加LA的发酵上清液中c9,t11-CLA、t10,c12-CLA和t9,t11-CLA占TFA比例分别为(1.079±0.103)%(转化率2.0%)、(0.928±0.054)%(转化率1.7%)和(0.475±0.063)%(转化率0.9%)(图3),转化率并不高;菌体中只有c9,t11-CLA,占TFA比例为(0.096±0.034)%。说明L. plantarump-8菌体在有LA存在时可催化LA转化CLA,并主要被转运到胞外。据报道,亚油酸异构酶是诱导酶[26],无底物LA时不表达;添加底物LA后,酶被诱导表达,进而催化LA转化CLA。
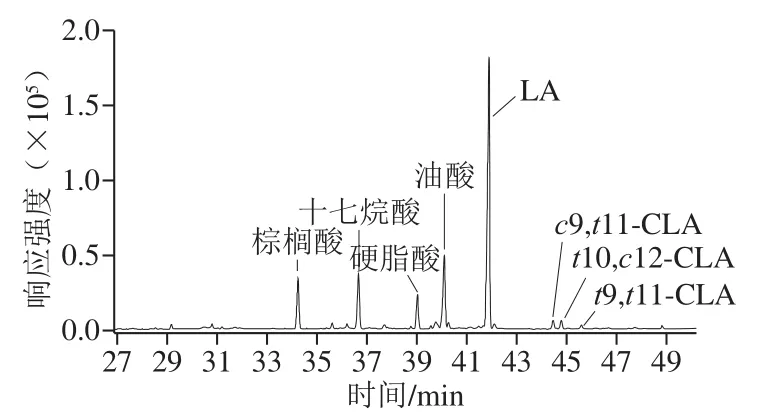
图3 L. plantarum p-8菌体发酵上清液CLA气相色谱分析Fig.3 GC chromatogram of CLA present in fermentation supernatant of L. plantarum p-8
为了比较菌体直接催化和酶催化的效果,一部分培养基中添加LA培养3 d的菌体破碎液用作天然粗酶液体外再催化LA转化CLA,发现天然酶催化1、3、5 d和7 d后均有c9,t11-CLA、t10,c12-CLA和t9,t11-CLA产生,其不同时间段的3 种CLA占TFA比例见图4。随着反应时间的延长,3 种CLA占TFA比例呈增加趋势,反应至7 d,c9,t11-CLA、t10,c12-CLA和t9,t11-CLA占TFA比例分别为(2.415±0.276)%、(2.675±0.176)%和(1.902±0.086)%。显然,用粗酶液和菌体催化,都有CLA产生,但粗酶液催化能力高于菌体催化,是因为细胞催化时细胞膜阻碍了反应顺利进行,粗酶液经细胞破碎后细胞膜屏障去除,使得酶与底物更加充分接触所致;另外,天然酶催化时有辅助因子添加,增加了辅助因子总浓度使得酶活性增加[19]。此外,粗酶液催化出现t10,c12-CLA占TFA比例超过c9,t11-CLA的现象。这种现象可能与氧浓度有关,菌体催化和天然酶催化环境的氧浓度不同,菌体催化是酶在细胞内催化,氧浓度低,与缺氧会影响菌体产各CLA异构体占TFA比例的报道吻合[27];也有可能是CLA-HY构象有一定柔性,在细胞内和暴露于细胞外活性中心的构象发生一些变化,影响了酶与底物的亲和力或对底物的选择性,使得CLA-HY更易与LA结合,利于10-HOE积累,也使得逆反应CLA-HY与底物10-HOE的结合力提高,且超过了10-HOE与CLADH的结合力所致。
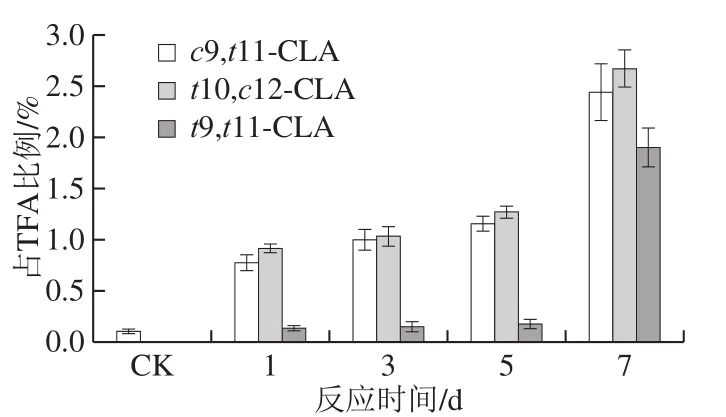
图4 L. plantarum p-8的天然酶体外转化不同时间的CLA含量Fig.4 Contents of CLA converted by natural enzyme of L. plantarum p-8 on different days in vitro
2.2 L. plantarum p-8催化LA转化CLA关键酶的mRNA表达量分析
亚油酸异构酶系的表达量直接影响LA转化CLA的效率,其含量高低取决于其转录和翻译水平高低。为了探究L. plantarump-8 LA转化为CLA的能力较低是否与CLA-HY、CLA-DH和CLA-DC基因的转录水平有关系,利用real-time PCR以16S rRNA基因为内参分析了在0.05 mg/mL LA诱导下3 个基因mRNA的相对表达量。结果表明,3 个基因mRNA的相对表达量都较低,CLAHY基因的mRNA相对表达量是CLA-DH和CLA-DC的2.5 倍,且CLA-DH和CLA-DC的mRNA相对表达量接近(图5)。
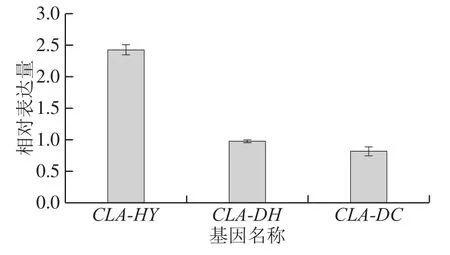
图5 亚油酸异构酶系各基因mRNA的相对表达量Fig.5 Relative mRNA expression of CLA genes
2.3 重组CLA-HY、CLA-DH和CLA-DC的诱导表达
将重组质粒p ET-28a(+)-CLA-HY和p ET-28a(+)-CLA-DC分别转化入E. coliBL21(DE3)中,重组质粒p ET-28a(+)-CLA-DH转化入E. coliTransetta(DE3)中,经IPTG诱导表达后进行SDS-PAGE和Western Blot检测。结果表明,3 个重组菌的菌体破碎液分别在约68(CLA-HY)、38 k Da(CLA-DH)和35 kDa(CLA-DC)处各有1 条含量明显很高的蛋白条带(图6),与根据氨基酸分子质量计算的3 个蛋白分子质量基本一致。所表达目的蛋白的N端和C端均保留了原核载体自身的6×His标签,旨在用于与His-tag抗体进行特异性相互作用[18]。因此本研究利用His-tag抗体与目的蛋白进行Western Blot检验,在相应大小位置处有杂交条带,说明3 个重组酶均成功表达(图7)。
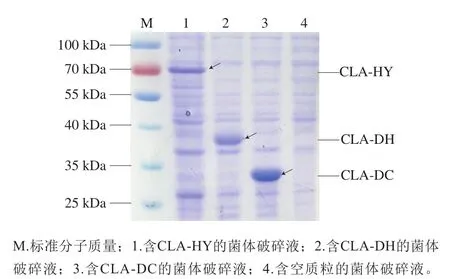
图6 SDS-PAGE检测重组CLA-HY、CLA-DH和CLA-DCFig.6 SDS-PAGE analysis of recombinant CLA-HY,CLA-DH and CLA-DC
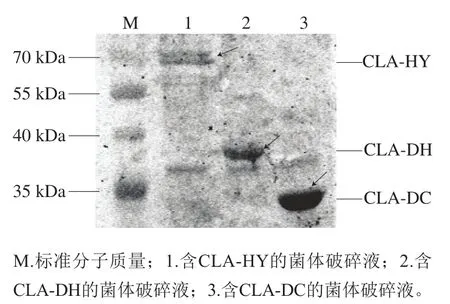
图 7Western Blot鉴定重组蛋白CLA-HY、CLA-DH和CLA-DCFig.7 Identification of recombinant CLA-HY, CLA-DH and CLA-DC by Western blot
2.4 重组CLA-HY、CLA-DH和CLA-DC混合(一步法)催化LA转化CLA
为考察重组亚油酸异构酶系是否有活性,将分别含重组CLA-HY、CLA-DH和CLA-DC的菌体破碎液混合加入反应体系中,进行体外LA转化CLA反应1、3、5 d和7 d,对照组由于酶灭活,各时间点产物均无CLA产生;无辅助因子各时间点产物均无CLA产生,说明工程菌表达的重组酶缺乏辅助因子或辅助因子水平较低,不能催化LA转化CLA;有辅助因子组各时间点产物均检测到3 种CLA的产生,且c9,t11-CLA占TFA比例高于t10,c12-CLA和t9,t11-CLA(图8)。随着反应时间的延长,c9,t11-CLA占TFA比例呈现上升趋势,在反应7 d可达(5.819±0.345)%,比天然酶转化c9,t11-CLA的含量提高2.7 倍。但是t10,c12-CLA含量呈下降趋势。显然,等湿质量体外单独高效表达的3 个重组酶的菌体破碎液混合,CLA-DH和CLA-DC占TFA比例提高,比天然混合酶的占比高,促进反应向生成c9,t11-CLA和t9,t11-CLA的方向进行。同时发现底物中混有的油酸含量减少,c9-十八碳烯酸和t11-十八碳烯酸的含量增加,说明亚油酸异构酶系也能催化油酸转化(图9)。
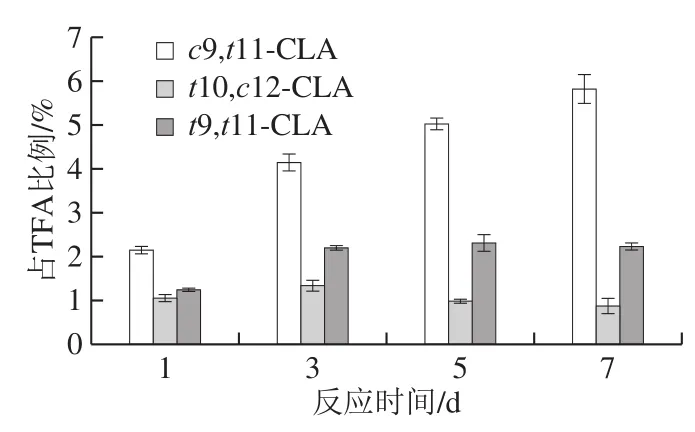
图8 重组酶体外催化反应不同时间的CLA含量(一步法)Fig.8 Contents of CLA catalyzed by one-step method using recombinant enzymes in vitro on different days

图9 重组酶催化反应7 d气相色谱分析CLA(一步法)Fig.9 GC chromatogram of CLA converted by one-step method using recombinant enzymes on day 7
2.5 重组CLA-HY、CLA-DH和CLA-DC分步法催化LA转化CLA
亚油酸异构酶催化的反应是有序进行的,且每一步反应的酶和需要的辅助因子不同。为了探究每步反应需要的条件和产物,反应体系中分5 步依次加入含重组CLA-HY、CLA-DH、CLA-DC、CLA-DH和CLA-HY的菌体破碎液并每次加入的辅助因子不同,进行体外催化LA转化CLA的研究,结果见表3。发现对照组由于酶灭活,5 步反应产物中均无CLA产生。无辅助因子组的5 步反应产物均没有检测到3 种CLA。辅助因子组第1步中加入CLA-HY和FAD有少量的10-HOE和t10,c12-CLA产生,说明CLA-HY即可催化LA向10-HOE方向,也可使得生成的10-HOE被CLA-HY催化生成t10,c12-CLA;第2步中加入CLA-DH和NAD+后除10-HOE和t10,c12-CLA,又出现了10-氧代-顺12-十八碳烯酸,可能是CLA-DH脱氢产生NADH使得FAD转化为FADH2,增强了CLA-HY转化10-氧代-顺12-十八碳烯酸为t10,c12-CLA的能力[28];第3步再加入CLA-DC、NADH和第4步再加入CLA-DH、NADH、NAD+和FAD,产物中均出现了10-羟基-顺11-十八碳烯酸和3 种CLA异构体,CLA按占TFA比例从多到少依次为c9,t11-CLA、t9,t11-CLA、t10,c12-CLA。第5步再加入CLA-HY、NADH、NAD+和FAD,产物中t10,c12-CLA的含量增加。说明3 个重组酶混合加入(一步法)和按催化顺序依次加入(分步法)需有辅助因子存在才能催化LA转化CLA,因为重组酶自身缺乏辅助因子或辅助因子含量少。第4步的反应产物中c9,t11-CLA占TFA比例达(4.780±0.321)%,t9,t11-CLA为(1.069±0.015)%,比第3步和第5步都高,可能是CLADH再加入,提高了CLA-DH/(CLA-DH+CLA-HY)使得LA转化为c9,t11-CLA和t9,t11-CLA效率提升。第5步中加入CLA-HY后,c9,t11-CLA和t9,t11-CLA占TFA比例下降,而t10,c12-CLA占TFA比例增高,可能是由于提高CLA-HY占比,促使反应向10-HOE转化为t10,c12-CLA方向进行。

表3 重组亚油酸异构酶系分步催化LA转化产物占TFA比例Table 3 Percentages of LA transformation products catalyzed by stepwise method using recombinant linoleate isomerase%
2.6 7 株乳酸菌CLA-HY 的结构分析
在相关研究中发现不同L. plantarum所产生的共轭亚油酸的异构体类型不同,主要区别在于有无t10,c12-CLA,L. plantarump-8转化亚油酸生成的t10,c12-CLA占比最高,推测不同的乳酸菌产t10,c12-CLA的能力差别可能与这些菌CLA-HY结构有关系。所以研究7 株乳杆菌的CLA-HY的结构,为后续通过酶改造提高重组酶催化LA转化为CLA的能力奠定基础。采用生物信息学的方法分析了L. plantarump-8、L. plantarumZS2058、L. plantarumST-III、L. plantarumATCC8014、L. plantarumWCFS1、B. animalisBB-12和L. acidophilusNCFM的CLAHY的一级结构和三维结构。利用DNAMAN软件比对7 个菌株的氨基酸序列,序列比对结果见图10,发现5 株L. plantarum的CLA-HY的氨基酸序列同源性高达99.97%;只有第25位和第286位氨基酸不同。L. plantarump-8第25位是谷氨酸(E),而其他4 株L. plantarum为天冬氨酸(D);L. plantarumATCC8014在第286位是天冬氨酸(D),其他4 株为谷氨酸(E)。天冬氨酸和谷氨酸都是侧链带负电的氨基酸,只是天冬氨酸的侧链比谷氨酸少1 个碳原子,推测其不影响蛋白的三维结构和功能的发挥。L. plantarump-8的CLA-HY与B. animalisBB-12和L. acidophilusNCFM的CLA-HY的序列同源性较低,分别为22.05%和26.81%,有多处位点的氨基酸不同。

图10 氨基酸序列比对分析Fig.10 Alignment analysis of amino acid sequences
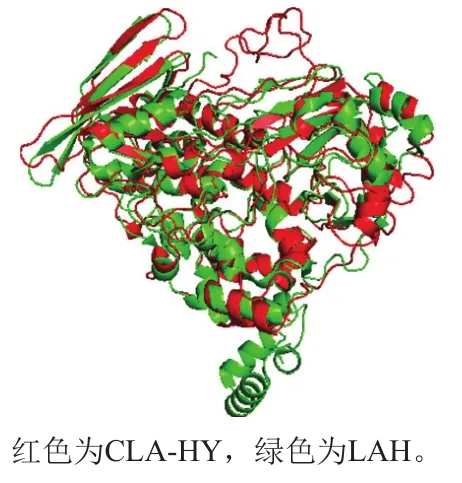
图11 L. plantarump-8的CLA-HY与LAH的三维结构比对Fig.11 Structural comparison of CLA-HY from L. plantarum p-8 and LAH
基于序列一致性较高的前提下同源建模,L. plantarump-8的CLA-HY与L. acidophilus的水合酶(L. acidophilushydratase,LAH,PDB ID:4IA5)的序列同源性为26.81%,以LAH为模板建模后,与LAH相比多了1 个Loop,少了1 个结构域(图11)。L. plantarump-8的CLA-HY的序列与已获得晶体结构的红串红球菌油酸水合酶(Rhodococcus erythropolisoleate hydratase,OhyRe)序列同一性高达54.83%,可信度相较更高,所以用OhyRe建模更好。以OhyRe的三维结构(PDB ID:5ODO)为模板,对L. plantarump-8的CLA-HY进行同源建模并对两者的三维结构进行比对,经Pymol软件分析的叠图(图12)显示,CLA-HY和OhyRe均有3 个结构域,比对后共有5 处不同,分别是2 处α-螺旋和3 处Loop。由于不同之处位于蛋白质的表面,所以推测其主要与蛋白质的疏水性有关,但疏水性会影响到酶分子的溶解性、聚合体形式以及与底物的靠近难易度,进而影响到催化的效率。根据模型推测两个酶的活性中心一致,可能催化机制相同。初步序列分析揭示了与OhyRe相同,都有1 个FAD结合的特征基序GXGXXGX21E/D存在,同样反映在Rossmann折叠上;FAD结合位点是一个大的环状结构,足够结合底物,用聚乙二醇模拟底物与OhyRe的结合,也证实了这一点。说明FAD与酶的功能紧密相关,底物结合位点与FAD位点位于3 个结构域连接处的疏水空腔中。M77和Y205是OhyRe的两个必需基团[29],对应于L. plantarump-8 CLA-HY的M76和Y180。实际底物与酶分子的结合与必需基团以及预测出5 处不同区域的确切功能还需要进一步通过蛋白质突变技术、蛋白质结晶或分子对接的方式探索。另外,B. animalisBB-12与L. acidophilusNCFM没有高同源性模板,暂时无法利用服务器比较同源建模。
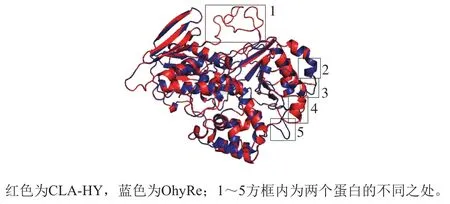
图12 L. plantarum p-8的CLA-HY与OhyRe的三维结构的比对Fig.12 Structural comparison of CLA-HY from L. plantarum p-8 and OhyRe
3 讨 论
L. plantarump-8的重组CLA-HY有FAD时可催化LA转化为10-HOE,然后加入重组CLA-DH和NAD+产物中又出现了10-氧代-顺12-十八碳烯酸,这与实验室前期报道的结果吻合[30],而再加入重组CLA-DC和NADH后产物中主要有c9,t11-CLA、t10,c12-CLA和t9,t11-CLA三种异构体。无论用菌体催化还是天然酶催化LA,都能产生c9,t11-CLA、t10,c12-CLA和t9,t11-CLA三种异构体。所以,L. plantarump-8的亚油酸异构酶系具有完整的生物转化CLA的酶系和活性,但转化能力不高,且根据产物可以推测L. plantarump-8与Kinsino等[17]报道的L. plantarumAUK1009 LA转化CLA途径一致(图1A),包括水合、脱氢、双键异构、加氢和脱水反应。即LA由CLA-HY催化水合生成10-HOE,产物10-HOE有两种去向,一种直接经CLA-HY催化脱水生成t10,c12-CLA;另一种由CLADH催化脱氢生成10-氧代-顺12-十八碳烯酸,然后由CLA-DC催化生成10-氧代-反11-十八碳烯酸,经CLA-DH催化加氢生成10-羟基-反11-十八碳烯酸,最后经CLA-HY催化脱水生成c9,t11-CLA和t9,t11-CLA。同时,该转化过程需要FAD、NAD+和NADH。
不同乳酸菌转化LA为CLA的能力取决于亚油酸异构酶系完整性、蛋白结构、表达量以及酶系中3 个酶的表达量之比。无完整的酶系,则不具备催化功能。异构酶系各酶的结构不同,催化能力则不同。3 个酶的表达量不同致使CLA各异构体产量不同,同时CLA-DH含量增加使得CLA产量增加。杨波[18]对88 株L. plantarum催化LA转化CLA的能力进行了研究,发现部分L. plantarum可以转化LA生成CLA,也有部分菌株不能转化。L. plantarump-8转化LA生成的c9,t11-CLA、t10,c12-CLA和t9,t11-CLA的转化率分别2.0%、1.7%和0.9%,与杨波[18]报道的保加利亚乳杆菌(Lactobacillus bulgaricus)CCFM29、L. plantarumCCFM192、L. plantarumCCFM238、L. plantarumCCFM169等的转化率及CLA异构体组成相近。对L. plantarump-8转化LA为CLA途径中的3 个必需酶的mRNA表达量分析发现,在0.05 mg/mL LA诱导下CLA-HY、CLA-DH和CLA-DC的mRNA相对表达量分别为2.357、0.969和0.872,都处于相对较低的状态,从而使得总体CLA产量较低,这与杨波[18]报道的L. plantarumZS2058等高产CLA乳酸菌的CLA-HY亚油酸异构酶系各酶表达量高,而L. plantarumST-III等低产CLA的亚油酸异构酶系各基因转录水平较低相吻合。另外,在分步加入重组酶催化LA转化CLA时,第4步反应即在已经加入3 个酶后再加入CLA-DH,CLA的生成量增加,也说明增加CLA-DH在3 个酶中的占比,可使CLA增产。
基因组序列分析发现,L. plantarump-8的CLA-DH和CLA-DC基因为一个基因簇,即一个转录单位,中间间隔一个短序列,受一个启动子控制,而CLA-HY为另一个基因簇成员,有另外的调控机制。L. plantarump-8CLADH和CLA-DC的mRNA转录量基本相同,而CLA-HY的mRNA转录量却比之高出2.5 倍也证明了这一点。LA对细菌有一定毒性,LA转化为CLA是细菌的一种脱毒机制。对LA抑制越敏感的菌株,其将LA转化为CLA的能力也越强[31]。L. plantarump-8的CLA-HY的表达强于CLA-DH和CLA-DC,可能是由于CLA-HY受LA诱导才能表达,当其产物10-HOE积累到一定程度才能进一步诱导CLA-DH和CLA-DC表达;也有可能是2 个启动子的强弱不等。在无LA时L. plantarump-8菌体发酵不能催化CLA的生成,进一步说明CLA-HY基因受LA的诱导才表达,与Bischoff等[32]报道的肌球蛋白交叉反应抗原基因,也就是CLA-HY基因受胁迫响应替代转录因子调节,是一个诱导表达型基因相吻合。
L. plantarump-8催化LA转化CLA的检测方法不同,测得结果偏差较大,分辨力也有差异。用SP2560(100 m×0.25 mm,0.2 μm)柱气相色谱法测得L. plantarump-8菌体催化3 d时发酵上清液LA转化为c9,t11-CLA、t10,c12-CLA和t9,t11-CLA的转化率分别为2.0%、1.7%和0.9%,CLA总转化率为4.6%。而刘勇[22]报道用230 nm波长处吸光度检得L. plantarump-8发酵葵花油时LA转化CLA的转化率最高为4.7%,发酵豆乳中LA转化CLA的转化率为10.9%,PEG-20 m柱气相色谱测得CLA只占TFA的0.33%(折算LA转化CLA的转化率为0.6%),转化率非常低,且没有分析出CLA异构体类型和组成。杜美婷等[24]报道用230 nm波长处吸光度法,得到L. plantarump-8添加0.9 mg/mL LA转化CLA量为69.2 μg/mL,转化率为6.92%。这些结果不同的原因是CLA和LA在230 nm波长处都有最强吸收值,必然会对CLA的吸光度有很大干扰,影响CLA精确定量,而是否能分开CLA异构体类型在于气相色谱的分辨力,刘勇[22]用20 m长的PEG色谱柱,只能测出总CLA,不能将CLA各种异构体分开。同时这些不同之处也与测试的时间点、萃取条件等有关。
不同乳酸菌转化LA为CLA的异构体组成与CLA-HY对底物与产物结合力有关。本研究发现催化LA转化为CLA的途径符合Kishino等[17]推测的模型,说明L. plantarump-8的CLA-HY脱水活性的底物可以是10-HOE、10-羟基-反11-十八碳烯脂肪酸和10-羟基-十八碳脂肪酸,L. plantarump-8转化LA为CLA的异构体类型比L. plantarumZS2058多样,可能相较L. plantarump-8的CLA-HY对底物的选择性更宽。酶与产物的亲和力越小,即生成的产物越容易从酶分子上脱落,推动反应向这个方向进行,进而这种产物的比例越高。L. plantarump-8的CLA-HY以任何物质为底物,催化的脱水反应可产生t10双键和c9双键两种,且与两种产物的亲和力相近,所以,各异构体比例差异不大。另外,既然符合Kishino等[17]推测的模型,那么CLA-HY对LA和10-羟基-反11-十八碳烯脂肪酸亲和力比对10-HOE的亲和力大,生成CLA的量才越大。Kishino等[17]推测的模型也说明CLA-DH有相对专一性,既可以催化脱氢,也可催化加氢反应。
L. plantarump-8的重组CLA-HY、CLA-DH和CLADC在有辅助因子帮助下无论混合加入催化还是分步依次加入催化均提高了LA转化CLA的效率。对照组和无FAD、NAD+和NADH组中均未检测到CLA,而添加辅助因子的3 个重组酶混合催化反应7 d时,c9,t11-CLA占TFA比例可高达(5.819±0.345)%,比经LA诱导后的L. plantarump-8菌体破碎液转化能力提高了约2.7 倍,是由于重组酶催化时重组CLA-HY和CLA-DH占比和3 个酶的总浓度都有所提高。其中分步法的催化效率低于一步法,可能是由于L. plantarump-8的CLA-DH和CLA-DC是同一个启动子,3 个酶可能在胞内是以酶复合体催化反应,在体外用重组酶催化反应时,分步反应中在第3步才加入CLA-DC,所以导致CLA产量低于一步法,并且在第4步中加入CLA-DH后,产物含量确有提高,这也进一步证实了酶复合物催化能力高的可能性。另外,经分析催化反应过程中酶系中各酶在反应体系中的比例对各CLA异构体的产量至关重要,在第5步再加入CLA-HY后,反应向生成t10,c12-CLA的方向进行,则降低了其他CLA异构体的含量。
同一菌株的CLA-HY催化LA转化为CLA的能力与异构体的组成与环境中的氧浓度、NADH浓度、NAD+浓度和CLA-DH/(CLA-HY+CLA-DH+CLA-DC)有关。实验证明,L. plantarump-8全细胞催化和细胞破碎催化不同在于酶在破碎前后接触的氧浓度显然不同,3 种CLA异构体的比例发生了很大变化。重组酶分步催化反应时,在第4步和第3步中CLA异构体的比例较其他阶段发生了很大的变化,说明添加CLA-DH和辅助因子可以改变各CLA异构体产量。
4 结 论
本研究中L. plantarump-8在含有LA的MRS上清液和菌体破碎液体外催化LA时,都可以低效产生c9,t11-CLA、t10,c12-CLA和t9,t11-CLA,但菌体中只有很少的t10,c12-CLA。影响CLA低产的原因可能是亚油酸异构酶系(CLA-HY、CLA-DH和CLA-DC)的表达量都较低,且彼此之间存在差异,CLA-HY的表达量高于CLA-DH和CLA-DC。独立表达的重组亚油酸异构酶系在FAD和NAD+的辅助作用下才可完成LA转化为CLA,一步法催化反应7 d,c9,t11-CLA含量高于L. plantarump-8菌体粗酶催化,但是t10,c12-CLA含量却低于L. plantarump-8菌体粗酶催化。L. plantarump-8转化LA生成CLA的过程包含水合、脱氢、双键移位、氧化和脱水反应多步反应,转化途径与L. plantarumAUK1009一致。亚油酸异构酶系中的关键酶CLA-HY成功同源建模后,发现其有3 个结构域,底物结合位点与FAD位点位于3 个结构域连接处疏水空腔中,M76和Y180是2 个必需基团。

