腐乳丁酸及产丁酸菌发酵特性分析
马艳莉,段 哲,梁静静,李素萍,丁玉峰
(1.南阳理工学院 河南省工业微生物资源与发酵技术重点实验室,河南 南阳 473004;2.河北农业大学食品科技学院,河北 保定 071000)
肠道微生态健康是近年来备受关注的健康问题,发酵食品对微生态的影响引起世界关注,国际上对发酵食品研究已深入到肠道微生态领域[1-3]。腐乳是大豆经磨浆、成坯、前酵、腌制、后酵等过程制作的传统发酵豆制品,历史悠久、风味独特、营养丰富,其中最具特色的为青方腐乳[4]。青方腐乳又被称为“臭豆腐”,外观呈青色,更多呈豆青色,是众多腐乳种类中最具特色的一类。通常认为,青方腐乳在发酵过程中因部分蛋白质降解,游离出硫氢基和氨基,产生具有硫臭和氨臭等特殊强烈刺激性气味,因此又被称为臭腐乳。
短链脂肪酸是指碳原子数小于6的有机脂肪酸,近年来,由于发现其在微生态健康方面的重要作用而被广泛关注[5-7]。丁酸是最重要的短链脂肪酸,在调节肠道菌群平衡、维持肠道微生态健康方面发挥积极作用[8],丁酸还是组蛋白去乙酰化酶的抑制剂,有助于免疫细胞育成,具有抗细胞增生、促进癌细胞凋亡的能力[9]。目前已有多个丁酸的前体药物被合成和研究[10-11]。因此,在食品范围内寻找含有丁酸的产品具有重要意义。但是,由于高浓度丁酸具有刺激性臭味,往往被作为破坏食品风味品质的组分,前期研究发现,丁酸是青方腐乳关键挥发性风味成分,风味阈值较低,对青方腐乳特征性臭味贡献较大,在青方腐乳中含量为2.44 μg/g[12]。青方腐乳“闻着臭,吃着香”的独特风味为部分人所喜爱,甚至是嗜爱,有一定的消费基础,因此,青方腐乳中高丁酸含量不会引起风味品质下降,青方腐乳有可能成为丁酸的载体,促进丁酸消费,有助于其功能性发挥。
研究表明,多种微生物可以产丁酸,丁酸梭菌(Clostridium butyricum)是最受关注、研究最多的产丁酸微生物[13-14]。1933年,丁酸梭菌最早在日本被发现并报道,目前将其活菌制剂作为整肠剂用于调节肠道微生态平衡已有60多年。作为益生菌,丁酸梭菌在维持肠道菌群平衡、增强免疫力、预防肿瘤发生等方面有很好的功效[15]。
本研究在前期确定丁酸是青方腐乳特征性风味物质[12],并从青方腐乳中分离鉴定出丁酸梭菌BP01[16]的基础上,使用高效液相色谱(high performance liquid chromatography,HPLC)法比较不同类型腐乳丁酸及其他短链脂肪酸含量,并研究青方腐乳生产过程中丁酸变化规律,对亨盖特厌氧滚管法结合分子生物学技术从青方腐乳中分离鉴定的丁酸产生菌部分发酵特性进行分析,研究结果将有利于发现富含丁酸的食品资源,并为丁酸梭菌进一步应用提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
青方、红方、白方、低盐红腐乳及不同品牌青方腐乳为市售商品,购自北京某大型超市。所用菌种大肠杆菌(Escherichia coliO78)和金黄色葡萄球菌(Staphylococcus aureus26003)来自中国科学院微生物研究所,蜡样芽孢杆菌(Bacillus cereus)为实验室保藏。
短链脂肪酸标准品(色谱纯)、酪蛋白 美国Sigma公司;酵母粉、蛋白胨、琼脂粉 英国Oxoid公司;乙腈(色谱纯) 美国Dima公司。
1.2 仪器与设备
LC-10A HPLC仪、UV mini 1240紫外-分光光度计日本Shimadz公司;HPS-250生化培养箱 哈尔滨市东明医疗仪器厂;A05077厌氧培养罐 重庆江雪科技有限公司;YXQ-SG46-280A蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;HZQ-F160振荡培养箱 哈尔滨市东联电子技术开发有限公司;TDL-40B台式离心机、TGL-16B冷冻离心机 上海安亭有限责任公司;KQ-100E超声波清洗器 昆山市超声仪器有限公司;WSZ-100A涡旋振荡器 上海一恒科技有限公司。
1.3 方法
1.3.1 丁酸及其他短链脂肪酸含量测定
采用HPLC法测定样品中丁酸及其他短链脂肪酸的含量,参考Zhang Jianhua等[17]的方法,略有改动。
样品提取液制备:称取样品冻干粉0.50 g于50 mL离心管中,加入40 mL蒸馏水,超声振荡30 min,8 000 r/min离心20 min,取上清液,过0.45 μm滤膜制得样品提取液。
HPLC检测条件:色谱柱:Shimadzu SCR-101(H)(7.9 mm×300 mm,10 μm);流动相:5 mmol/L硫酸溶液;柱温:40 ℃;流速:1.0 mL/min;检测波长:210 nm。
1.3.2 丁酸产生菌发酵特性测定
1.3.2.1 生长曲线和pH值曲线测定
将丁酸产生菌活化后稀释到104CFU/mL,取0.1 mL接种到9.9 mL梭菌增殖培养基中,37 ℃厌氧培养,间隔适当时间分别取厌氧管混匀后测其OD600nm和pH值,绘制生长曲线和pH值曲线。
1.3.2.2 不同碳源培养基配制及丁酸产生菌的培养
以葡萄糖为碳源的培养基按照梭菌增殖培养基(RCM培养基)配制:胰蛋白胨10.0 g、酵母浸膏3.0 g、牛肉浸膏10.0 g、葡萄糖5.0 g、三水合乙酸钠3.0 g、氯化钠5.0 g、半胱氨酸盐0.5 g、0.5%美蓝0.2 mL、琼脂15.0 g(固体培养基添加)、蒸馏水1 000 mL,调节pH值为7.0,灭菌20 min备用。
以乳酸为碳源的培养基配制:将梭菌增殖培养基中葡萄糖替换为同样含量的乳酸;以葡萄糖和乳酸为碳源的培养基配制:将梭菌增殖培养基中葡萄糖减半,使用乳酸替换。将0.1 mL活化后稀释到104CFU/mL的丁酸产生菌接种到9.9 mL以上3 种培养基中,37 ℃厌氧培养24 h后,按照1.3.1节方法测定其发酵液中丁酸含量。
1.3.2.3 抑菌能力实验
采用琼脂扩散法对丁酸产生菌抑菌能力进行测定。以大肠杆菌O78、金黄色葡萄球菌26003和蜡样芽孢杆菌作为指示菌研究其抑菌能力,每个菌株活化2 次,并将菌悬液浓度调整为107CFU/mL。吸取稀释后的指示菌菌悬液0.1 mL,涂布在营养琼脂培养基上并静置5 min,使用直径为6 mm的无菌打孔器打孔,吸取50 μL离心后的丁酸产生菌发酵液,分别加入不同孔中,在厌氧条件下培养24 h,观察是否出现抑菌圈,并记录包括孔直径在内的抑菌圈直径,同时用未接种BP01菌株的RCM培养液作为空白对照。
1.3.2.4 食盐耐受性实验
在梭菌增殖培养基中分别添加0、5、8、11 g/100 mL的食盐,将0.1 mL活化后稀释到104CFU/mL的丁酸产生菌接种到9.9 mL以上4 种培养基中,37 ℃厌氧培养24 h后,测其OD600nm值,研究其食盐耐受性。
1.3.2.5 温度适应性实验
将0.1 mL活化后稀释到104CFU/mL的丁酸产生菌接种到9.9 mL梭菌增殖培养基中,分别在20、28、37 ℃和45 ℃厌氧培养24 h后,测其OD600nm值,研究其温度适应性。
1.4 数据处理及分析
使用SPSS 23.0软件进行方差分析,Duncan多重检验确定数据间的差异,P<0.05,差异显著。每个样品测定3 次,测定其平均值。
2 结果与分析
2.1 青方腐乳丁酸及其他短链脂肪酸分析
短链脂肪酸是指碳链中碳原子数小于6的有机脂肪酸,近年研究发现,短链脂肪酸在调节肠道菌群平衡、改善肠道功能、调节免疫、抗肿瘤和调控基因表达等方面发挥积极作用[18]。作为短链脂肪酸中最主要的代表,丁酸是结肠黏膜上皮细胞的主要能量来源,在调节肠道微生态平衡方面发挥重要作用,受到广泛关注[19]。在前期对青方腐乳关键挥发性风味物质研究中发现,丁酸是青方腐乳关键性风味成分之一,对其特征性风味形成起重要作用,在此基础上,使用HPLC法测定了同一品牌青方、红方、白方和低盐红腐乳的丁酸含量,结果如图1所示,青方腐乳丁酸含量明显高于其他3 种类型腐乳,其含量达到25.4 mg/g(干质量,下同),而红方、白方和低盐红腐乳丁酸含量较低,且三者之间没有显著性差异。不同类型腐乳发酵方式最大的区别在于后酵汤料中添加的辅料不同,红方腐乳诱人的红色是由于后酵过程中添加了红曲米,红方腐乳后酵汤料中还添加面曲、白酒、食盐、糖、香料等辅料;白方腐乳在生产过程中不添加红曲米,保持本色,但是添加白酒;低盐腐乳生产过程中降低了食盐使用量,添加白酒;青方腐乳与红方、白方、低盐腐乳相比后酵汤料不添加白酒,汤料中只含有食盐、黄浆水和少量花椒,没有白酒、外源蛋白酶、红曲和面曲等物质引入,使青方腐乳后酵过程微生物分布与其他3 种腐乳存在较大差异,已有研究表明,丁酸梭菌生长会受到乙醇的抑制,而青方腐乳后酵过程不添加乙醇,这可能带来青方腐乳后酵过程丁酸梭菌快速增殖,丁酸梭菌代谢产生丁酸,使青方腐乳丁酸含量显著高于其他类型腐乳。
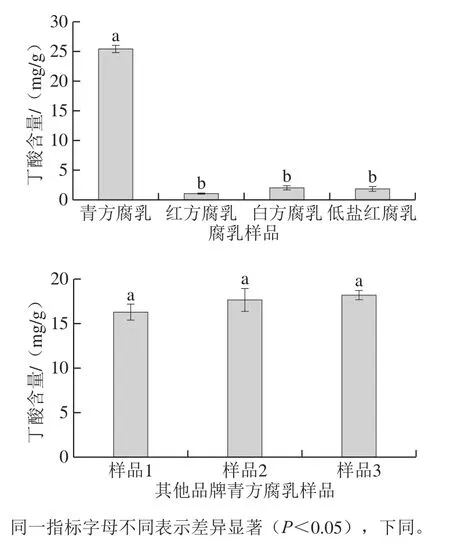
图1 不同类型腐乳丁酸含量比较Fig.1 Comparison of butyric acid contents among different types of sufu
进一步对其他3 种品牌青方腐乳丁酸含量进行测定,结果发现所测定的3 种品牌腐乳丁酸含量也较高,均超过15 mg/g,此外,还测定了20多种豆豉和豆酱样品的丁酸含量,发现它们不含或仅含少量丁酸(数据未给出)。这些结果表明,青方腐乳富含丁酸。丁酸由于在促进肠道微生态平衡、防治结肠炎和大肠癌等疾病方面有积极的作用而备受关注,一些以丁酸为前体的药物被研究和开发。自然存在的丁酸一般由微生物发酵产生,一些发酵食品,如清国酱[20]、纳豆[21]、干酪[22]等含有丁酸,其中,文献报道干酪丁酸含量为0.13~7.3 mg/g,与之相比,青方腐乳丁酸含量具有优势。但是,丁酸在高浓度时有不愉快气味,限制了其在食品中功能性的发挥,而丁酸是青方腐乳特征性风味之一,对青方腐乳“闻着臭,吃着香”的独特风味起贡献作用,青方腐乳中高浓度丁酸不会对其风味造成不良影响,可能为丁酸功能性发挥提供一个很好的载体。
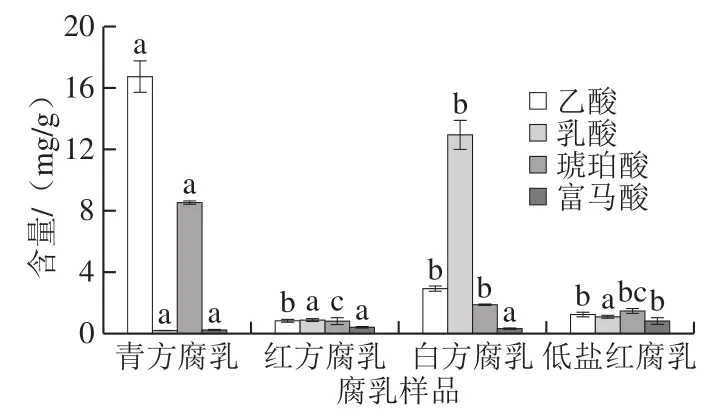
图2 不同类型腐乳其他短链脂肪酸含量比较Fig.2 Comparison of contents of other short-chain fatty acids among different types of sufu
对同一品牌的4 种腐乳样品其他短链脂肪酸含量进行测定,结果如图2所示。青方腐乳乙酸和琥珀酸(丁二酸)含量最高,与其他3 种腐乳有显著差异,但是青方腐乳乳酸含量最低,有文献报道,乳酸在丁酸菌的作用下可转化为丁酸[23],Bourriaud等[24]也发现乳酸在肠道内主要转化为丁酸,所以青方腐乳的高丁酸含量可能和丁酸菌有关。白方腐乳乳酸和富马酸(反丁烯二酸)含量最高,其乳酸含量达12.95 mg/g,约是青方腐乳的68.16 倍。Han Beizhong等[25]研究发现,白方腐乳中乳酸菌落数量较其他类型腐乳高,这可能和白方腐乳的高乳酸含量相关。从短链脂肪酸总量看,青方腐乳含量最高,白方腐乳次之,红方腐乳和低盐红腐乳含量较低,这可能与不同类型腐乳生产工艺差异导致其微生物组成不同有关。
2.2 青方腐乳生产过程中丁酸及其他短链脂肪酸含量变化
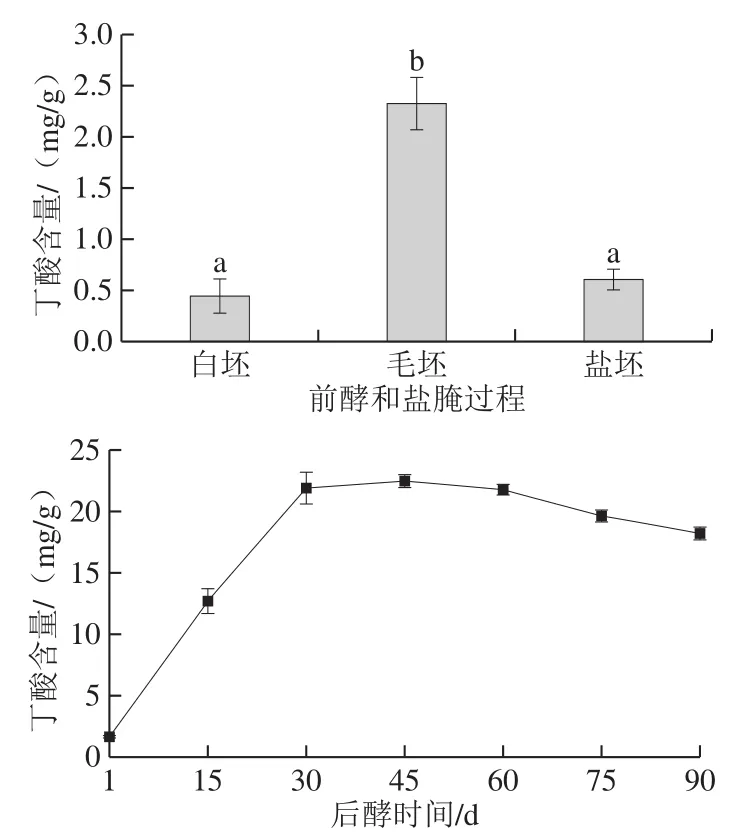
图3 青方腐乳生产过程中丁酸含量变化Fig.3 Changes in butyrate contents during production process of grey sufu
如图3所示,白坯丁酸含量较低,仅为0.45 mg/g,接种雅致放射毛霉发酵48 h后,毛坯中丁酸含量明显增加,约为白坯的5.21 倍,这与文献报道丁酸一般由微生物发酵产生一致[26]。盐腌过程导致丁酸含量减少,这可能与食盐进入坯体引起盐坯固形物含量增加以及盐坯水分流失相关。青方腐乳后发酵前期,特别是在后酵前30 d,丁酸含量上升迅速,随后基本稳定,在后酵第45天达到最大值,约为22.47 mg/g,继续后发酵过程中,丁酸含量轻微降低。这表明,青方腐乳丁酸主要在后发酵前期产生,前期研究发现其他类型腐乳丁酸含量甚微,结合这一结论推测,不同类型腐乳丁酸含量差异由后发酵中微生物差异引起。
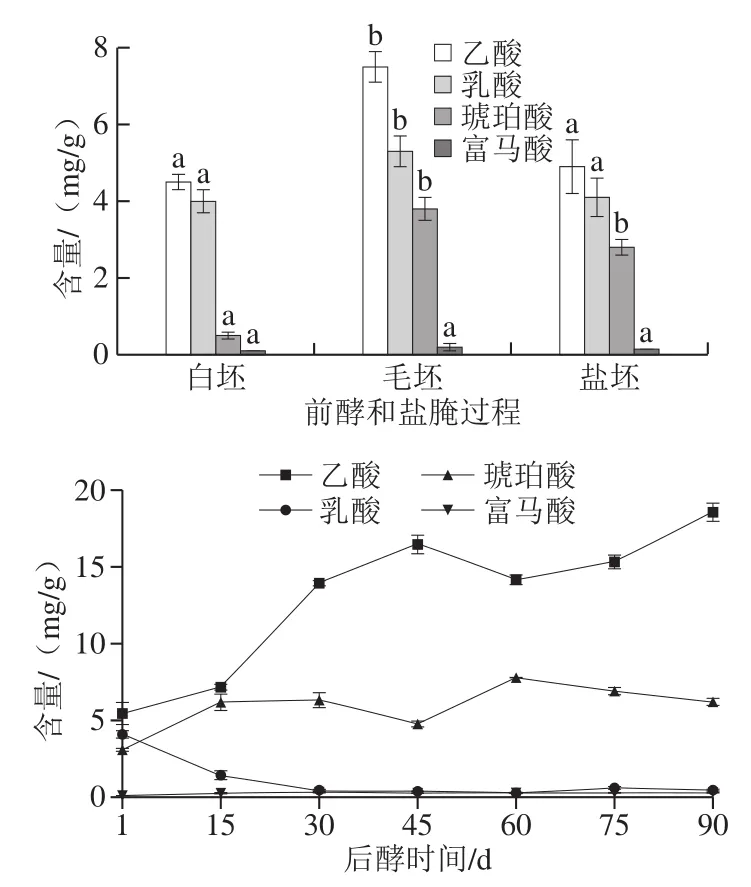
图4 青方腐乳生产过程中其他短链脂肪酸含量变化Fig.4 Changes in contents of other short-chain fatty acids during production process of grey sufu
如图4所示,在前酵和盐腌过程中,毛坯短链脂肪酸含量最高,盐坯次之,白坯最低,这与毛坯中微生物数量较多相关,因为通常认为短链脂肪酸由微生物代谢产生[27]。从单个短链脂肪酸含量看,毛坯中乙酸和乳酸含量最高,与白坯和盐坯有显著性差异,毛坯和盐坯中琥珀酸含量较高,与白坯有显著性差异,但是毛坯、盐坯和白坯中富马酸含量都较低。青方腐乳后发酵过程中,乙酸和琥珀酸含量虽然在发酵中期有轻微波动,但基本呈上升趋势,在后酵结束时,含量分别达18.56 mg/g和6.21 mg/g。乳酸含量在青方腐乳后酵过程中呈下降趋势,特别是后酵前30 d下降明显,导致青方腐乳后酵结束时,乳酸含量甚微,这可能与青方腐乳中乳酸在微生物作用下转化为丁酸相关。
2.3 丁酸梭菌BP01的部分发酵特性分析
发酵食品中的丁酸大多由细菌产生,能产丁酸的微生物主要包括梭菌属(Clostriduim)、丁酸弧菌属(Butyrivibrio)、丁酸杆菌属(Butyribacterium)等。前期研究发现青方腐乳丁酸含量显著高于其他类型腐乳,所以对青方腐乳中丁酸产生菌进行分离,得到1 株高产丁酸菌株,48 h培养液中丁酸浓度为6.48 mmol/L,对菌株命名为BP01,分子生物学鉴定结果为丁酸梭菌[16]。进一步对丁酸梭菌BP01的部分发酵特性进行研究,以期在青方腐乳发酵过程中应用丁酸梭菌BP01,从而为提高青方腐乳丁酸含量提供参考。
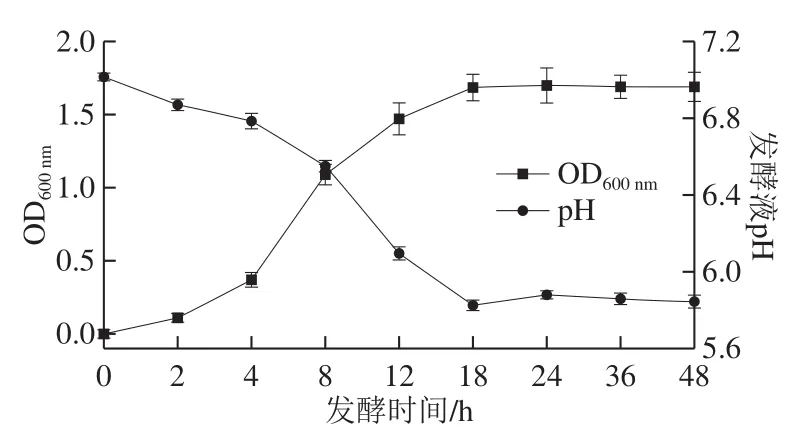
图5 BP01菌株生长曲线和pH值曲线Fig.5 Growth curve of strain BP01 and pH variation in its fermentation broth
如图5所示,菌株在RCM培养基中4 h左右进入对数生长期,菌落数指数上升,代谢产生酸性物质使培养基pH值快速下降。从培养液菌落数看,BP01在18 h进入对数生长稳定期,pH值稳定在5.8左右,而后在约24 h由于形成芽孢,pH值略有上升。
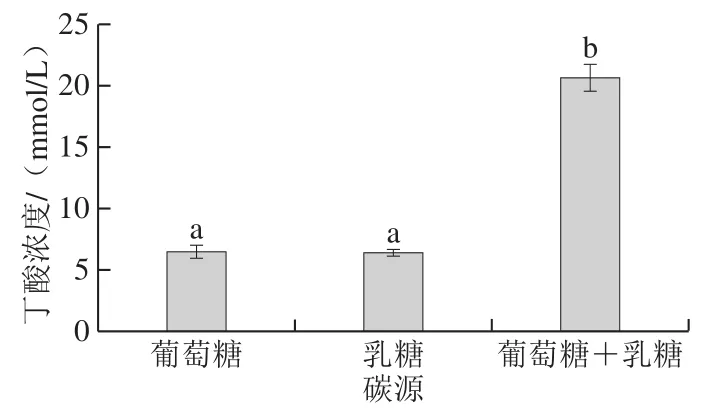
图6 碳源对BP01菌株产丁酸的影响Fig.6 Effect of carbon source on butyric acid-producing capacity of strain BP01
分别使用葡萄糖、乳酸、葡萄糖+乳酸作为碳源对BP01菌株进行厌氧培养,菌株均生长良好,对其代谢终产物中的丁酸含量测定,图6结果表明,BP01菌株可以利用葡萄糖和乳酸作为碳源生长代谢产生丁酸,虽然二者转化丁酸的效率不同,但是可能因为BP01菌株对两种碳源利用率有差异,所以葡萄糖和乳酸作为单一碳源的代谢终产物中丁酸累积量没有显著差异。葡萄糖和乳酸同时作为碳源时,BP01菌株代谢终产物中丁酸含量明显增加,是葡萄糖和乳酸单独作为碳源时的3 倍多,可能是由于丁酸梭菌BP01在葡萄糖作为碳源存在的情况下代谢乳酸产生丁酸的效率提高,而在乳酸存在条件下,丁酸梭菌对葡萄糖的利用率也可以得到提升,二者产生了协同效应,从而提高了BP01菌株代谢终产物中丁酸含量,这与胡小红等[28]研究有类似之处,胡小红等[28]从窖泥中分离鉴定丁酸梭菌BEY8,研究发现其能代谢乳酸产生丁酸,乳酸的转化效率可进行调控。这与本研究有类似之处。这为下一步实验提供思路,可以尝试BP01菌株和乳酸菌共培养,利用乳酸菌代谢产生的乳酸提高BP01菌株代谢终产物的丁酸含量,同时添加这两种肠道微生态健康的益生菌到腐乳中,制作低盐腐乳,增强其促进肠道健康的功能性。
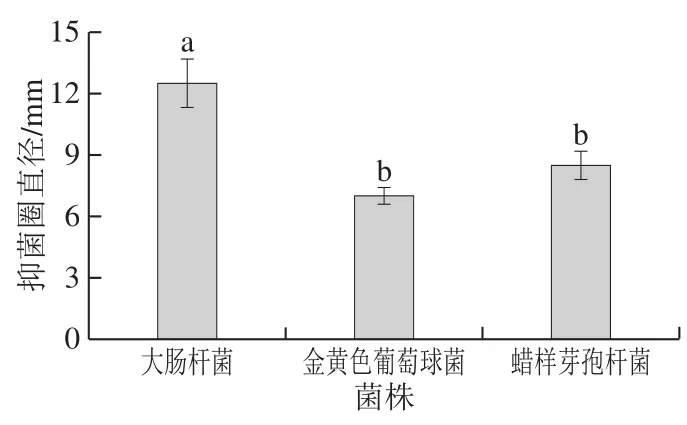
图7 BP01菌株的抑菌性Fig.7 Antibacterial activity of strain BP01
传统发酵豆制品中有时会检测到某些致病微生物,对产品安全性造成一定隐患,因此,选择能够抑制致病菌的有益菌应用于发酵过程中,对保证发酵豆制品的安全性有很大现实意义。BP01菌株对大肠杆菌、金黄色葡萄球菌以及蜡样芽孢杆菌的抑制能力通过测定抑菌圈直径表示,对照组是未接种BP01菌株的RCM培养液,其抑菌圈直径为0 mm,说明对照组RCM培养液对3 种致病菌无抑制作用,而由图7可知,BP01菌株对3 种致病菌具有抑制作用,但抑菌能力有所差异,抑制大肠杆菌能力最强,与其他两种菌有显著差异,抑菌圈直径达12.5 mm。BP01菌株对蜡样芽孢杆菌抑制能力略强于金黄色葡萄球菌,但二者无显著差异。文献报道,丁酸梭菌具有抑制致病菌的能力[29],与本研究一致。因此,作为一种益生菌,丁酸梭菌具有应用于发酵食品,提高发酵食品微生物安全性的潜力。
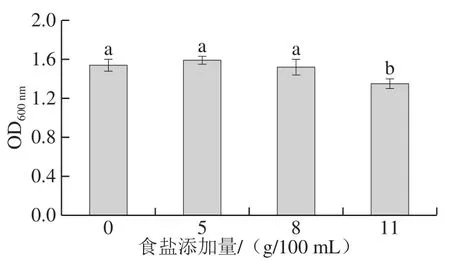
图8 BP01菌株对食盐的耐受性Fig.8 Salt tolerance of strain BP01
传统发酵豆制品生产过程中一般会添加一定量食盐,用于形成特定风味、控制发酵过程、抑制腐败微生物生长等,因此,考察菌株对食盐的耐受性对其在发酵豆制品中的潜在应用十分必要。根据腐乳食盐含量的现状,设置5、8 g/100 mL和11 g/100 mL 3 个食盐添加量,考察BP01菌株对食盐的耐受性,使用OD600nm作为衡量标准。如图8所示,添加5 g/100 mL和8 g/100 mL食盐时,BP01菌株生长几乎不受影响,其OD600nm对照(不添加食盐)无显著差异,当食盐添加量达11 g/100 mL时,BP01菌株的生长受到轻微抑制,其OD600nm相对于对照下降12.34%,但仍可以较好生长,这显示BP01菌株可以耐受一定量的食盐,具有应用于含盐食品的潜力。
发酵温度会对传统发酵豆制品品质及功能性产生影响[30-31],在生产实践中,一般会依据主要发酵菌种生长特性形成固定的发酵温度,因此,应对菌株的温度适应性进行研究,以考察其应用于特定发酵豆制品的潜力。根据腐乳发酵温度的现状,设置20、28、37 ℃和45 ℃研究BP01菌株的温度适应性。如图9所示,在28 ℃和37 ℃条件下培养,BP01菌株生长良好,OD600nm无显著性差异,20 ℃和45 ℃条件下,BP01菌株生长略显缓慢,其OD600nm与37 ℃培养相比,分别降低19.08%和10.53%,但整体上,BP01菌株仍能较好生长,显示其具有一定的温度适应性。
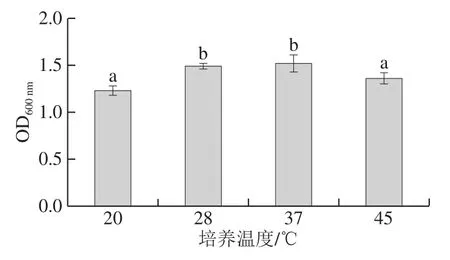
图9 BP01菌株对温度的适应性Fig.9 Temperature adaptability of strain BP01
3 结 论
本研究在前期确定丁酸是青方腐乳关键风味物质的基础上,分析青方腐乳丁酸及变化规律,进一步研究从青方腐乳中分离鉴定的产丁酸菌的部分发酵特性,得出如下结论:1)青方腐乳富含丁酸,其含量远高于红方、白方和低盐红腐乳,可作为丁酸潜在的消费载体。2)丁酸主要在青方腐乳后酵前30 d产生,与青方腐乳后酵过程中丁酸梭菌密切相关;青方腐乳乳酸含量较低,并且在后酵过程中呈下降趋势,可能在特定微生物作用下转化为丁酸。3)在前期实验从青方腐乳中分离鉴定丁酸产生菌的基础上,研究了高产丁酸的丁酸梭菌BP01部分发酵特性,结果表明其培养过程中较快进入对数生长期,在培养18 h后进入生长稳定期,终产物pH值在5.8左右,能利用乳酸作为碳源;BP01菌株抑制大肠杆菌能力最强,对金黄色葡萄球菌和蜡样芽孢杆菌也有抑制作用,能够耐受一定浓度的食盐,并表现出一定的温度适应性,有应用于腐乳发酵潜力。

