豆渣可溶酸性多糖的分离纯化及结构解析
王思琪,胡彦波,翟丽媛,石曾卉,赵 珺
(长春大学食品科学与工程学院,吉林 长春 130022)
多糖是一类具有抗氧化、降血糖[1]、降血脂[2]、增强免疫和延缓衰老[3]等功能的高分子化合物,是食品中的主要功能因子之一。水溶性大豆多糖(soluble soybean polysaccharides,SSPS)是一种从大豆种皮、子叶和豆渣中提取的可溶性多糖。研究表明:豆渣的膳食纤维部分主要含有30%的水溶性多糖,是具有潜在价值的巨大资源[4]。从大豆种皮中提取的酸性多糖主要由半乳糖醛酸聚糖(homogalacturonan,HG)和鼠李糖半乳糖醛酸聚糖-I(rhamnogalacturonan,RG-I)组成,其化学结构是以鼠李半乳糖醛酸和高聚半乳糖为主链、半乳聚糖和阿拉伯糖为侧链形成的近似球状体结构[5]。从大豆子叶中提取的酸性多糖主要由D-半乳糖、L-阿拉伯糖、D-半乳糖醛酸和L-鼠李糖组成。其化学结构是由→4)-α-D-GalpA-(1→4)-α-D-GalpA-单元和→4)-α-D-GalpA-(1→2)-α-L-Rhap-单元构成主链的基本骨架,侧链部分包含β-1,4-Galp和α-1,5-Araf[6]。目前,对于从豆渣中提取的酸性多糖的基本结构特征研究尚不深入,限制了其在食品中的应用。
SSPS是一种酸性多糖,与其他生物多糖相比,其黏度较低,可制成高浓度低黏的水溶液,溶液黏度几乎不受盐类影响,对温度的热稳定性也优于其他糖类[7-9]。SSPS具有高溶解性、抗氧化性、乳化性和稳定性好等优良特性,可有效改善食品的食用品质、加工特性和外观特征[10-12],是一种具有潜在价值的食品添加剂。因此本实验对豆渣可溶酸性多糖进行分离纯化,并对纯化后电荷和分子质量均一的部分进行结构解析。研究结果将为豆渣可溶酸性多糖产品的深入研究提供理论依据,使营养成分得以全面开发,同时解决废弃豆渣所造成的环境污染,为豆渣的开发利用提供新的思路。
1 材料与方法
1.1 材料与试剂
豆渣由榆树市榆乡豆制品有限公司提供;苯酚、硫酸(均为分析纯) 北京化工厂有限责任公司;DEAE纤维素 上海源叶生物科技有限公司;鼠李糖(rhamnose,Rha)、葡萄糖醛酸(glucuronic acid,GlcA)、甘露糖(mannose,Man)、半乳糖醛酸(galacturonic acid,GalA)、葡萄糖(glucose,Glc)、半乳糖 (galactose,Gal)、阿拉伯糖(arabinose,Ara)、木糖(xylose,Xyl)、岩藻糖(fucose,Fuc)标准品 国药集团化学试剂有限公司;乙腈、甲醇、氯化钠(均为色谱纯) 安徽天地高纯溶剂有限公司。
1.2 仪器与设备
UV-1901紫外-可见分光光度计 亿鑫仪器设备有限公司;Nicolet is5傅里叶变换红外光谱仪 美国赛默飞世尔科技公司;3K15台式高速离心机、BM312-B旋转蒸发器 上海亚荣生化仪器厂;LC-20AT高效液相色谱仪(配有CTO-20A泵和SPD-20AVD紫外光检测器) 日本岛津公司;AV 600 MHz核磁共振波谱(nuclear magnetic resonance spectroscopy,NMR)仪 德国Bruker公司。
1.3 方法
1.3.1 豆渣多糖的制备
称取豆渣4 kg,在料液比1∶25(g/mL)、提取时间4 h、加酶量2%、酶解温度50 ℃条件下提取豆渣。首先调节pH值为4,加入2%的纤维素酶酶解2 h,再加入2%的酸性蛋白酶酶解2 h。用旋转蒸发仪将多糖溶液浓缩至原体积的1/3,并利用70%乙醇溶液进行过夜醇沉后,4 000 r/min离心20 min弃去上清液得到沉淀,60 ℃水浴不停地搅拌烘干,除去乙醇后,加dH2O溶解,冷冻干燥得到豆渣粗多糖(SSPS)。
1.3.2 豆渣可溶酸性多糖的分离纯化
1.3.2.1 豆渣可溶酸性多糖的离子交换色谱
准确称取豆渣粗多糖(SSPS)粉末2 g,用100 mL的dH2O将其溶解,离心后取上清液缓慢加到DEAECellulose色谱柱中,待样品完全进入纤维素柱后,用dH2O压样2 次,保证样品完全进入纤维素柱,用dH2O洗去中性糖,再用0~0.5 mol/L NaCl溶液进行梯度洗脱,流速1.5 mL/min,4 min收集一管,用自动收集器收集洗脱液。利用苯酚-硫酸法[13]在波长490 nm处测定收集液的吸光度,绘制洗脱曲线图,确定豆渣可溶酸性糖梯度洗脱的盐离子浓度,根据洗脱曲线图收集电荷均一的对称峰,透析浓缩后进行冷冻干燥,获得电荷均一组分。
1.3.2.2 豆渣可溶酸性多糖的凝胶过滤色谱
称取豆渣酸性多糖SSPS-A1 100 mg,溶于2 mL的dH2O中,离心去除沉淀,然后将上清液上样于平衡好的Sepharose CL-6B凝胶色谱柱,洗脱液为0.15 mol/L NaCl溶液,流速0.15 mL/min,每管收集液体体积3 mL。利用苯酚-硫酸法[13]测定SSPS-A1洗脱液中的糖含量分布。根据SSPS-A1的糖含量分布曲线,收集合适的洗脱峰,透析浓缩冻干,获得分子质量均一组分。
1.3.3 豆渣可溶酸性多糖的糖含量、糖醛酸含量和蛋白含量的测定
1.3.3.1 糖含量的测定
采用苯酚-硫酸法[13]以葡萄糖为标准品;配制不同质量浓度的葡萄糖溶液,在波长490 nm处测定吸光度。以葡萄糖质量浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。
样品中总糖含量的测定:将样品配制成0.1 mg/mL的多糖溶液,取样600 μL,加400 μL的dH2O,其余步骤按照标准曲线的操作步骤进行,做3 组平行实验,在波长490 nm处测定吸光度。根据标准曲线计算样品中的糖含量。
1.3.3.2 糖醛酸含量的测定
采用间羟基联苯法[14]以半乳糖醛酸为标准品;配制不同质量浓度的半乳糖醛酸溶液,在波长525 nm处测定吸光度。以半乳糖醛酸质量浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。
样品中糖醛酸含量的测定:将样品配制成0.1 mg/mL多糖溶液,取样400 μL,其余步骤按照标准曲线的操作步骤进行,做3 组平行实验,在波长525 nm处测定吸光度。根据标准曲线计算样品中的糖醛酸含量。
1.3.3.3 蛋白含量的测定
采用考马斯亮蓝法[15]以牛血清蛋白为标准品;配制不同质量浓度的牛血清蛋白溶液,在波长595 nm处测定吸光度。以牛血清白蛋白质量浓度(μg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线。
样品中蛋白含量的测定:将样品配制成1 mg/mL多糖溶液,取样400 μL,其余步骤按照标准曲线的操作步骤进行,做3 组平行实验,在波长595 nm处测定吸光度。根据标准曲线计算样品中的蛋白含量。
1.3.4 豆渣可溶酸性多糖的单糖组成分析
称取1 mg多糖样品置于酸水解小瓶中,加入1 mL的2 mol/L盐酸-甲醇溶液,充N2密封后,置于80 ℃金属浴中水解10 h后用空气泵吹干,再加入1 mL的2 mol/L三氟乙酸溶液,于120 ℃金属浴中水解1 h,用空气泵吹干除去三氟乙酸[16]。称取100 μL 1 mg/mL的Man、GlcA、Rha、GalA、Glc、Gal、Xyl、Ara和Fuc标准品,得到标准品混合液,置于酸水解小瓶中备用。
向完全酸水解后得到的干燥样品和标样中加入500 μL的0.3 mol/L NaOH溶液,使样品充分溶解,再加入500 μL的1-苯基-3-甲基-5-吡唑啉酮-甲醇溶液,使其混合,取出200 μL混合液于1.5 mL EP管中。将样品和标样在70 ℃条件下水浴反应0.5 h,分别加入100 μL的0.3 mol/L HCl溶液,充分混匀后加入700 μL CH3Cl,充分振荡后,萃取得到剩余的1-苯基-3-甲基-5-吡唑啉酮-甲醇试剂,弃去CH3Cl层,保留水层,重复操作萃取3 次。0.22 μm滤膜过滤,然后进行高效液相色谱检测[17-18]。
高效液相色谱条件:DIKMA Inertsil ODS-3色谱柱(4.6 mm×150 mm);流动相为磷酸盐缓冲溶液(0.2 mol/L、pH 7.0)-乙腈(81∶19,V/V);流速1.0 mL/min;进样量20 μL;检测波长245 nm。
1.3.5 豆渣可溶酸性多糖的分子质量测定
称取2 mg多糖,溶解于400 μL 0.2 mol/L NaCl溶液中,利用LC-10ATvp高效液相色谱系统,RID-10A示差检测器及TSK-gel G-3000 PWXL色谱柱测定分离纯化后多糖的分子质量分布情况[19],TSK-gel G-3000 PWXL流速0.6 mL/min,流动相为0.2 mol/L NaCl溶液,柱温35 ℃。
1.3.6 豆渣可溶酸性多糖均一组分的红外光谱分析
取干燥的多糖粉末样品1 mg,与180 mg KBr一起研磨后制成透明压片,使用傅里叶变换红外光谱仪在4 000~500 cm-1的波长范围内进行红外光谱扫描分析[20]。
1.3.7 豆渣可溶酸性多糖均一组分的核磁分析
称取待测样品15 mg,充分溶解于0.5 mL D2O中。采用AV 600 MHz NMR波谱仪检测样品的13C NMR谱,检测频率为150 MHz[21]。
2 结果与分析
2.1 豆渣可溶酸性多糖的离子交换色谱
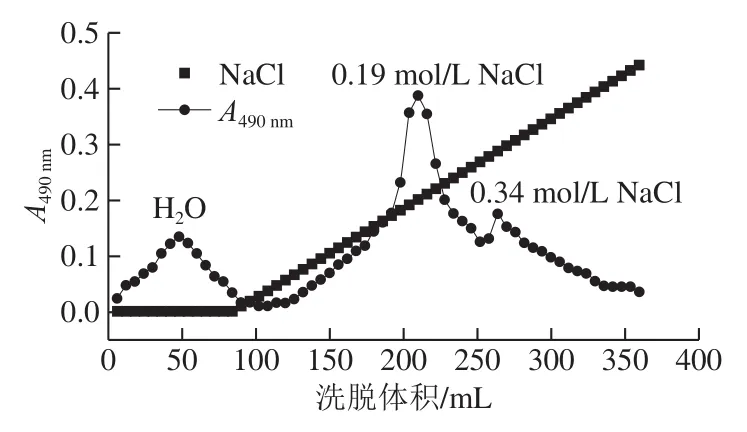
图1 豆渣可溶酸性多糖的梯度洗脱图Fig.1 Gradient elution curves of acidic polysaccharides from soybean dregs
通过DEAE-Cellulose对豆渣可溶酸性多糖经0~0.5 mol/L NaCl线性梯度进行洗脱,结果如图1所示。在DEAE-Cellulose离子交换色谱的吸附能力范围内,不带电荷的中性多糖组分首先被dH2O洗脱下来,带电荷的酸性多糖组分随着NaCl浓度的增加而逐渐被洗脱下来,并在0.19 mol/L和0.34 mol/L的NaCl溶液处有2 个较为明显的洗脱峰,分别命名为SSPS-A1和SSPS-A2,得率分别为45.5%和10.3%。收集样品,浓缩透析,冻干。
2.2 豆渣可溶酸性多糖的化学组成和单糖组成分析
如表1所示,SSSP-A1和SSPS-A2的总糖质量分数分别为64.5%和52.6%。糖醛酸质量分数分别为31.1%和24.6%,而蛋白质量分数仅为1.3%和1.2%。对比大豆可溶性多糖提取的相关文献[10]可知,本次提取的豆渣可溶酸性多糖的蛋白质含量极低,因此本实验不需要对这2 个组分进行除蛋白处理。同时2 个组分的总糖含量、糖醛酸含量和蛋白含量无显著差异。进一步对二者的单糖组成进行分析,结果表明组成SSPS-A1和SSPS-A2的单糖存在一定差异。SSPS-A1主要由GalA、Gal和Ara组成,推测SSPS-A1可能由半乳糖醛酸聚糖(HG型)果胶(主要含有GalA)和阿拉伯糖半乳聚糖(AG型)果胶(主要含有Gal和Ara)组成。SSPS-A2主要由GalA、Rha、Gal和Ara组成,推测其可能由HG型果胶和RG-I型果胶(主要含有GalA、Rha、Gal和Ara,其中GalA∶Rha=1∶1)组成。研究表明,大豆中的可溶酸性多糖主要由HG和少量RG-I组成[22]。由于豆渣可溶酸性多糖的GalA含量明显低于大豆可溶酸性糖[23],说明酸性多糖可能在大豆产品制备过程中损失,造成酸性多糖产率低。综合上述结果可知SSPS-A1和SSPS-A2的结构可能存在一定差异。
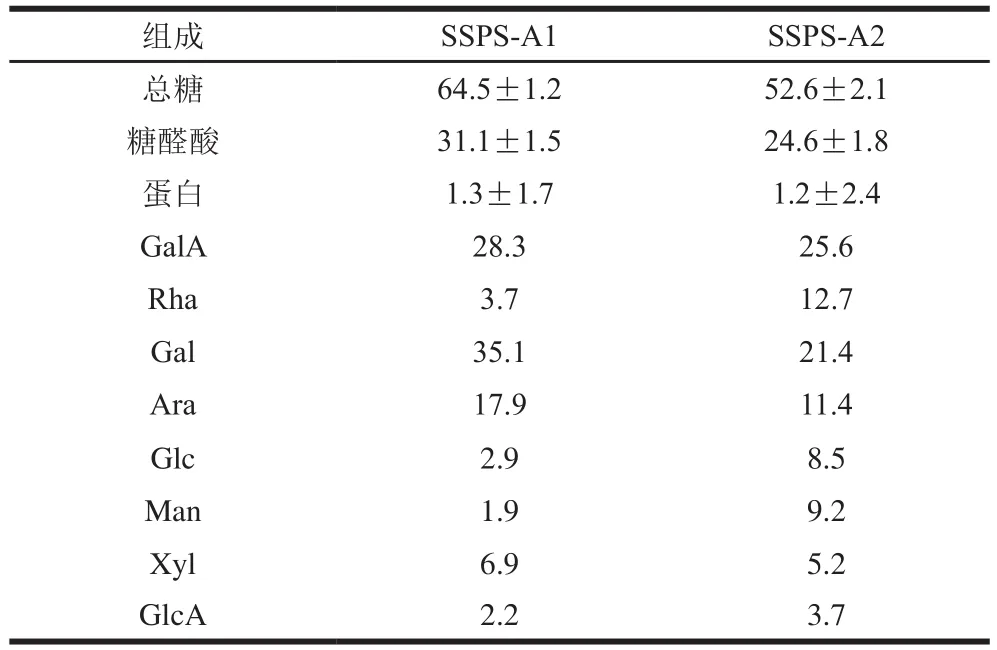
表1 豆渣可溶酸性多糖的化学组成和单糖组成分析Table 1 Chemical composition and monosaccharide composition of soluble acid polysaccharides from soybean dregs%
2.3 豆渣可溶酸性多糖SSPS-A1的凝胶过滤色谱
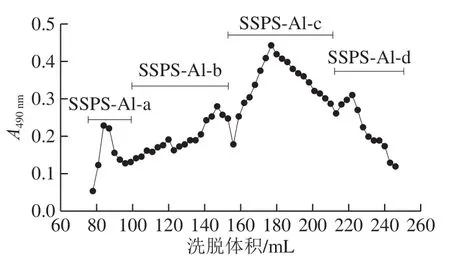
图 2SSPS-A1在Sepharose CL-6B的洗脱结果Fig.2 Elution curve of SSPS-A1 on Sepharose CL-6B column
利用Sepharose CL-6B对SSPS-A1进行分离纯化,结果如图2所示。SSPS-A1在Sepharose CL-6B上主要出现4 个洗脱峰,收集合适的洗脱峰。得到4 个组分SSPSA1-a(得率为8.0%)、SSPS-A1-b(得率为9.0%)、SSPS-A1-c(得率为20.8%)、SSPS-A1-d(得率为8.8%),其中SSPS-A1-c的得率最高。
2.4 豆渣可溶酸性多糖SSPS-A1不同组分的单糖组成分析
进一步通过高效液相色谱测定4 个分子质量组分的单糖组成,结果如表2所示。SSPS-A1-a的主要单糖组分间物质的量比为GalA∶Gal∶Ara=10.8∶38.0∶12.1。SSPS-A1-b的主要单糖组分间物质的量比为GalA∶Gal∶Ara=18.4∶27.7∶21.7。SSPS-A1-c的主要单糖组分间物质的量比为GalA∶Gal∶Ara=17.3∶44.9∶19.1。SSPS-A1-d的主要单糖组分间物质的量比为GalA∶Gal∶Ara=23.9∶26.2∶7.4。从单糖组成结果可知,SSPS-A1四个多糖组分的单糖组成存在一定差异,SSPSA1-a中的Glc略高于其他3 个组分,SSPS-A1-b和SSPSA1-c的组成较为相似,SSPS-A1-d中Ara的含量低于其他3 个组分。
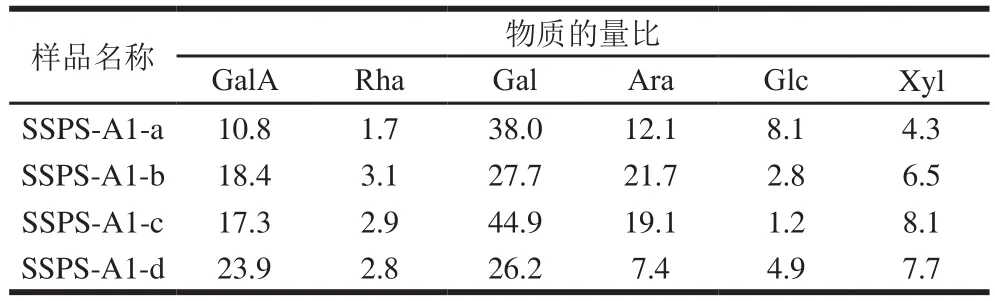
表2 SSPS-A1四个组分的单糖组成Table 2 Monosaccharide compositions of four fractions of SSPS-A1
2.5 豆渣可溶酸性多糖SSPS-A1不同组分的分子质量测定
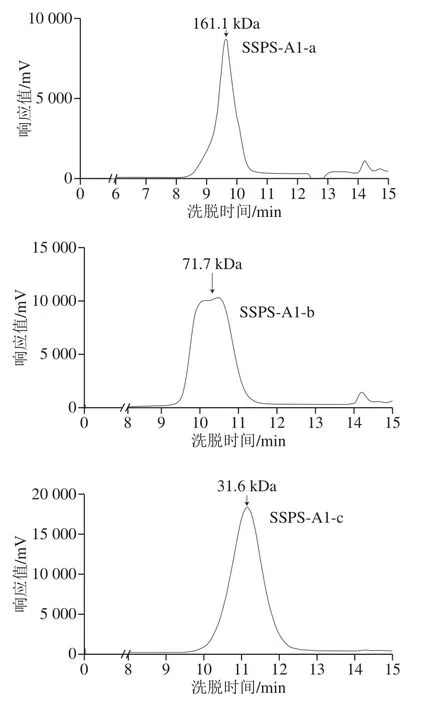
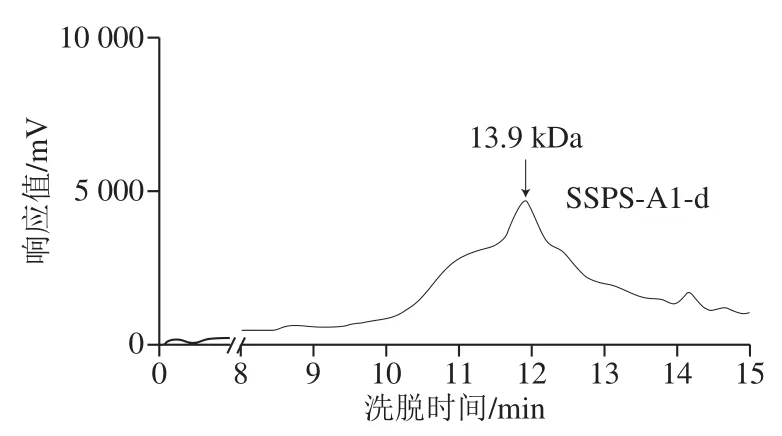
图 3SSPS-A1四个组分的高效凝胶渗透色谱洗脱图Fig.3 HPGPC profiles of four fractions of SSPS-A1
分子质量是多糖结构解析中重要的参数[24],影响多糖的理化和生物活性等性质[25]。通过对SSPS-A1经凝胶柱色谱分离纯化后的多糖利用高效凝胶渗透色谱进行分子质量的测定,使用不同分子质量的葡聚糖作为标准品,得到线性回归方程为lgmw=0.191 5x+0.952 3,R2=0.998 1,将各个组分的保留时间代入线性回归方程,可以计算出样品多糖的分子质量,结果如图3所示。SSPS-A1-a的分子质量为161.1 kDa、SSPS-A1-b的分子质量为71.7 kDa、SSPS-A1-c的分子质量为31.6 kDa、SSPS-A1-d的分子质量为13.9 kDa。SSPS-A1-c的峰相对狭窄,且相对对称,说明SSPS-A1-c的分子质量分布相对均一,为SSPS-A1的均一组分。因此,后续将对电荷和分子质量均一的SSPS-A1-c进行结构分析。
2.6 豆渣可溶酸性多糖均一组分的红外光谱分析
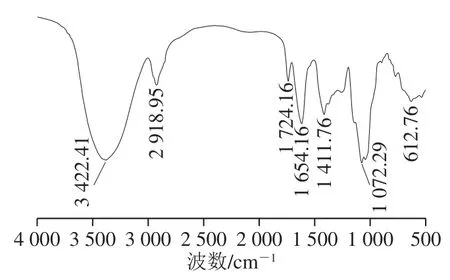
图 4SSPS-A1-c的红外光谱图Fig.4 Infrared spectrum of SSPS-A1-c
如图4所示,参照文献[26-29]对比可知,在3 422 cm-1附近的吸收峰为多糖O—H伸缩振动特征峰;在2 918 cm-1附近的吸收峰为多糖类物质C—H伸缩振动产生,这是糖类物质的2 个特征吸收峰;在1 724 cm-1附近存在明显的O—CH3的特征吸收峰,说明SSPS-A1-c存在一定程度的甲酯化或乙酰化修饰。在1 654 cm-1附近的吸收峰显示为糖醛酸的自由羧基中羟基的弯曲振动峰;说明该物质可能含有糖醛酸;在1 411 cm-1附近显示为C—H变形振动吸收峰;在1 072 cm-1附近的特征吸收峰表明SSPS-A1-c组分中存在吡喃糖环;实验结果与单糖组成分析吻合,进一步说明了SSPS-A1-c是含有较多GalpA的酸性多糖。综合红外光谱结果可知,SSPS-A1-c具有O—H、C—H和C=O等酸性多糖的特征吸收峰,同时SSPS-A1-c还存在一定程度甲酯化或乙酰化修饰。
2.7 豆渣可溶酸性多糖中均一组分的NMR
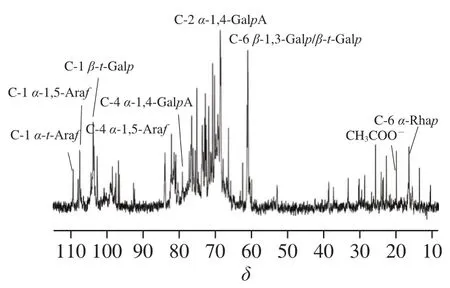
图 5SSPS-A1-c的13C NMR图谱Fig.5 13C NMR spectrum of SSPS-A1-c
如图5所示,t-α-Araf、α-1,5-Araf和t-β-Araf异头碳信号峰分别出现在δ109.22、δ107.01和δ103.94,为C-1位吸收峰;δ62.94为β-1,3-Galp或t-β-Galp中的C-6位吸收峰[28-29],说明SSPS-A1-c由主要含有β-Galp和α-Araf的AG型果胶组成[30-32];此外,从图5可以看到,α-1,4-GalpA的C-4位和C-2位吸收峰(δ79.14、δ68.79),在δ20.05附近还可以观察到乙酰基的吸收峰,说明SSPS-A1-c中含有部分乙酰化的HG型果胶。综合上述核磁结果可推测SSPS-A1-c主要由AG型果胶和HG型果胶结构域组成。
3 结 论
本实验利用DEAE-Cellulose离子交换柱色谱和Sepharose CL-6B凝胶柱色谱对豆渣可溶性多糖进行分离纯化,获得了一种电荷和分子质量均一的组分SSPSA1-c。进一步对其进行结构分析,结果表明:SSPS-A1-c分子质量为31.6 kDa,主要由半乳糖醛酸(GalA)、半乳糖(Gal)和阿拉伯糖(Ara)组成,其物质的量比为GalA∶Gal∶Ara=17.3∶44.9∶19.1,同时含有少量的鼠李糖(Rha)、葡萄糖(Glc)和木糖(Xyl)。红外光谱分析表明SSPS-A1-c具有O—H、C—H和C=O等酸性多糖的特征吸收峰,同时SSPS-A1-c还存在一定程度的甲酯化或乙酰化修饰;核磁共振图谱表明,SSPS-A1-c主要由AG型果胶和部分乙酰化的HG型果胶组成,其结果与单糖组成和红外色谱分析结果一致。研究结果将为豆渣可溶酸性多糖的应用提供理论依据,对豆渣的综合开发利用具有重要意义。

