食品中甲醛的稳定碳同位素特征分析及其在甲醛源解析中的应用
韩 莉 余婷婷 刘 迪 杨 青 高 芳 王会霞
(1.湖北省食品质量安全监督检验研究院,湖北 武汉 430075; 2.湖北省食品质量安全检测工程技术研究中心,湖北 武汉 430075)
甲醛(Formaldehyde,FA)被广泛用于医疗、卫生和农业等多个行业。甲醛暴露引发的人体健康风险持续被国际关注[1]。美国环境保护署规定每天摄入的量不超过0.2 mg/kg 体重[2]。2008年,中国卫生部印发的《食品中可能违法添加的非食用物质和易滥用的食品添加剂品种名单(第一批)》(食品整治办[2008]3号)的通知中,明令禁止在食品中以任何形式添加甲醛,其限量规定为“不得检出”。目前,由甲醛引起的食品安全事件仍屡见不鲜,在新近公布的食药安全犯罪典型案例中,就有2起案例是非法使用工业用甲醛[3]。然而,监管实践以及研究[4-6]发现许多食品存在一定量的内源性甲醛;水发水产品中甲醛平均值为50.35 mg/kg,海水鱼类平均值为8.85 mg/kg,虾蟹类、贝类、淡水鱼中甲醛含量依次减少[7]。香菇引发的甲醛问题也引起了人们的广泛关注,香菇甲醛是自身酶促反应的代谢产物[8]。日本农产品中干香菇和鲜香菇的甲醛含量分别为244,54 mg/kg,这些甲醛都是香菇生长、保鲜和干燥过程中自然产生。果蔬中的甲醛本底可达0.79~2.52 mg/kg[9]。小麦粉中甲醛的本底均值为3.85 mg/kg[10]。李薇霞等[6,11]研究发现,奶糖中主要物质奶粉中酪蛋白和乳糖的美拉德反应是奶糖中甲醛生成的主要原因。目前食品中甲醛的检测方法如分光光度法[12-13]、气相色谱法[14-15]、液相色谱法[16-18]和荧光法[19]等,主要以定量分析为主,难以识别食品中甲醛的来源。
相比“分子”尺度上的含量分析方法,单体稳定同位素分析技术(Compound-specific Stable Isotope Analysis,CSIA)在“原子”尺度上探寻物质的来源和相关的迁移、转化规律,具有更为独特的优点。利用不同来源物质中同位素丰度存在差异的原理,可甄别环境与食品中污染物来源。Marisa等[20]指出通过检测葡萄酒中Pb的同位素比率可判断铅的污染源是自然污染还是土壤污染;通过测定食品中的13C值可以识别食品中多环芳烃和多氯联苯的来源[21-22]。
由于甲醛分子具有强极性,在色谱柱上难以保留,测试灵敏度太低,大多数甲醛相关的检测分析都是建立在甲醛衍生化后对甲醛衍生物的分析上[23-25]。碳同位素组成检测过程中,对于检测灵敏度不够的有机物质,也可以对待测物进行衍生反应,衍生物的同位素组成可经质量作用定律从理论上计算出待测物的碳同位素组成[26-27]。余应新[28]利用GC/C/IRMS技术,采用2,4-二硝基苯肼柱衍生化并对衍生物的稳定碳同位素进行测定,间接得到了大气甲醛的稳定同位素组成及特征,且衍生化过程不存在同位素分馏。文章拟验证衍生化—气相色谱—燃烧—同位素比质谱法测定食品中甲醛的稳定碳同位素组成的可行性,并用此方法分析水产品、果蔬、蔬菜制品3类典型食品中甲醛的稳定同位素组成及分布特征,通过模拟试验分析内外源甲醛的贡献率,验证甲醛来源定量解析模型的可行性,为建立完善的食品安全溯源制度体系、食品中有毒有害物质的防控及食品安全监管提供依据。
1 材料与方法
1.1 材料与试剂
正己烷、二氯甲烷、乙酸乙酯、甲醛水溶液、2,4-二硝基苯肼(DNPH)、盐酸、氯化钠:分析纯,国药集团化学试剂有限公司;
超纯水为实验室自制一级水;
甲醛2,4-二硝基苯腙(FA-DNPH)标准品:纯度为99.8%,美国CATO公司;
甲醛水溶液标准品:质量浓度为10 mg/L,中国First Standard公司;
同位素标准参考物质[乙醇溶液(δ13C=-26.72‰,BCR-660),咖啡因(δ13C=-19.357‰,IAEA-600)]:国际原子能机构。
1.2 仪器与设备
气体稳定同位素比值质谱仪:DeltaV型,美国赛默飞世尔科技公司;
气相色谱仪:Trace GC Ultra型,美国赛默飞世尔科技公司;
元素分析仪:Flash 2000HT型,美国赛默飞世尔科技公司;
高效液相色谱仪:e2695型,美国Waters公司;
冷冻离心机:Allegra 64R型,美国贝克曼公司;
恒温水浴摇床:WNE29型,德国memmert公司;
分析天平:ME204/02型,梅特勒—托利多仪器有限公司;
超声仪:S180H型,德国Elma公司;
氮吹仪:N-EVAP112型,美国Organomation Associates Inc公司。
1.3 方法
1.3.1 样品前处理
(1) 样品制备:水产品、蔬菜制品、果蔬样品切碎后研磨成泥或粉末,鱿鱼样品分开内脏和其余肌肉部分,水产品和果蔬-20 ℃密封保存,蔬菜制品干燥密封常温保存。衍生试剂2,4-二硝基苯肼用色谱纯的乙腈重结晶两次后用高效液相色谱检验其纯度。将过量的纯化后的DNPH溶于24 mL盐酸,并定容至100 mL,配制成饱和的DNPH衍生溶液。
(2) 甲醛源解析模拟试验:选取龙头鱼中含量较高的样品进行外源性加标模拟试验并测定其甲醛含量及δ13C值。本底测试:龙头鱼中4个平行批次;外源性甲醛加标测试:龙头鱼中3个水平的甲醛标准溶液加标,每个水平2平行;甲醛标准溶液测试:空白无基质样品中4个水平的甲醛标准溶液加标,每个水平2平行。甲醛标准品配制成质量浓度为1.155 6 mg/mL的标准储备液,龙头鱼中添加3个不同浓度水平(添加体积为30,150,200 μL)的标准储备溶液。
(3) 衍生产物甲醛2,4-二硝基苯腙含量和δ13C值测定:准确称取1~2 g样品于50 mL离心管中,加入10 mL 水,超声提取30 min,4 ℃、9 000 r/min离心10 min,使样品及油脂和水充分分离,将上清液转移至另一干净离心管,加入1 mL DNPH衍生溶液(若样品中FA含量过高,可增加衍生溶液的添加量至反应完全),迅速盖上盖子,于60 ℃摇床衍生反应1 h,取出后迅速用流水冷却,过0.22 μm滤膜,测定衍生物含量。向衍生后溶液中加入15 mL正己烷,翻转摇匀充分萃取,4 ℃、4 000 r/min 离心3 min,取上层正己烷于50 mL离心管中,向残留水溶液中再加入15 mL正己烷,重复萃取2~3次,合并正己烷层,将萃取液置于氮吹仪吹干,用甲醇定容至1 mL,通过GC/C/IRMS测定甲醛2,4-二硝基苯腙的稳定碳同位素值,以δ13CPDB值为-26.72‰的乙醇溶液矫正的CO2为内标,得到相对于箭石化石标准(PDB)的同位素组成。
(4) 衍生剂2,4-二硝基苯肼的δ13C值测定:称取处理后的2,4-二硝基苯肼粉末0.1~2.0 mg,用锡杯包裹住粉末,置于自动进样盘,通过元素分析—同位素比值质谱法(EA-IRMS)测定2,4-二硝基苯肼的稳定碳同位素值。以δ13CPDB值为-27.771‰的咖啡因矫正的CO2为内标,得到相对于PDB的同位素组成。
(5) 甲醛(FA)的δ13C值测定:5 mL样品顶空瓶中吸取1 mL FA水溶液(37%),加入2 g氯化钠,65 ℃反应箱平衡90 min,用5 mL气密性气体进样针抽取2 mL FA顶空气体进样,通过GC/C/IRMS测定FA水溶液中FA的δ13C值,以δ13CPDB值为-26.72‰的乙醇溶液矫正的CO2为内标,得到相对于PDB的同位素组成。
1.3.2 计算方法
(1) 甲醛的δ13C值:参照余应新等[28-29]的方法,按式(1)计算FA的稳定碳同位素比值。
fFAδ13CFA+fDNPHδ13CDNPH=δ13CFA-DNPH,
(1)
式中:
fFA、fDNPH——FA、DNPH在衍生物中的碳原子占比(fFA+fDNPH=1)。
(2) 外源性甲醛添加贡献率:按式(2)计算人为添加甲醛的贡献率,结合式(3)、式(4)得到人为添加贡献率Xanthropogenic和δ13C值的关系式。
(2)
(3)
(4)
式中:
Xanthropogenic——人为添加甲醛对样品甲醛的贡献率;



1.4 数据处理
甲醛的稳定碳同位素组成数据由Isodat Acquisition采集软件采集,Isodat Workspace定量分析软件分析数据。甲醛的含量由Empower软件采集并分析。数据汇总后通过Microsoft Office Excel进行相关计算处理。
2 结果与分析
2.1 液相衍生化过程同位素效应试验结果
由表1可知,理论值和测定值最大偏差为0.344‰,可以认为甲醛的衍生化反应符合质量平衡方程。根据Rieley[30]提出的同位素效应理论,一个化学反应中同位素是否发生分馏,取决于决定反应速率的那一级反应是否存在与碳原子相连的化学键的断裂和生成。DNPH在反应过程中没有碳原子参与的化学键断裂与生成,因此甲醛的衍生化反应没有发生碳同位素分馏。

表1 液相衍生化过程结果表Table 1 Results of liquid phase derivatization process ‰
2.2 水产品中甲醛含量及其碳同位素组成
由表2可知,鱿鱼样品中甲醛含量为0.341~24.185 mg/kg,δ13C值为-48.167‰~-24.514‰,龙头鱼中甲醛含量为54.555~121.416 mg/kg,δ13C值为-45.430‰~-27.468‰;日常监督抽检的淡水鱼中甲醛均为未检出;龙头鱼中的甲醛含量远高于鱿鱼,研究[31]表明,氧化三甲胺酶(TMAOase)存在于鱿鱼、鳕鱼、甲壳类动物等水产品的内脏组织和肌肉中,这种酶的作用底物是氧化三甲胺(TMAO),可催化使其分解产生二甲胺和甲醛(见图1)。鱿鱼和龙头鱼中的氧化三甲胺酶对甲醛的生成起主要作用,氧化三甲胺可在酶的作用下分解成甲醛和二甲胺,因此海水鱼中氧化三甲胺及酶的存在是其体内甲醛本底产生的主要原因,不同海水鱼中酶的浓度、生存环境差异使得不同种类和地域的鱼体内产生的甲醛含量不一,甲醛中稳定碳同位素组成也呈种类差异和地域差异;淡水鱼中可能缺乏氧化三甲胺酶,不具备甲醛的生成条件,所以一般很少在淡水鱼中检出甲醛。
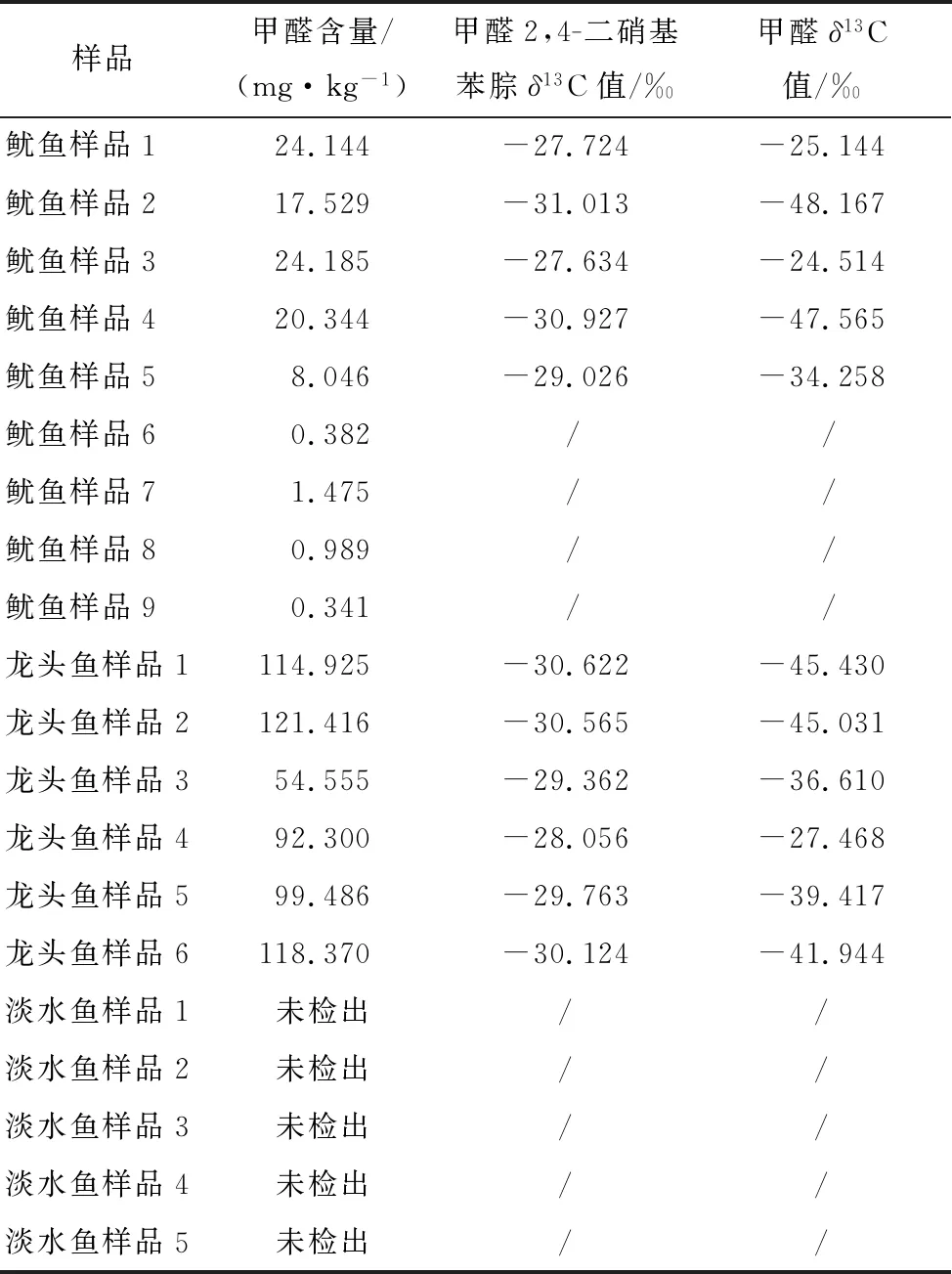
表2 水产品中甲醛含量及δ 13C值†Table 2 Formaldehyde mass fraction and δ 13C value in aquatic products

图1 内源性甲醛生成途径Figure 1 Formation pathway diagram of endogenous formaldehyde
由图2可知,一般鱿鱼样品的内脏部分甲醛含量高于肌肉部分,氧化三甲胺在酶的作用下转化为甲醛过程可能主要在鱿鱼的内脏部分产生,继而代谢至肌肉部分,1号鱿鱼样品的肌肉部分甲醛含量高于内脏部分,可能是肌肉部分的鱿鱼除了来自于内脏自身代谢,还有一部分来自于外源性甲醛带入。
由图3可知,龙头鱼中肌肉部分的甲醛含量高于内脏部分。在对龙头鱼进行切分制样过程中发现,龙头鱼的进食方式是直接大量吞食小鱼,内脏中有大量未经消化完全的小鱼残渣,而内脏部分的制样是采取全部内脏混匀均质制样,这些小鱼占内脏的质量比重较高,使得内脏部分甲醛含量偏低。

各样品种甲醛含量测量值的RSD均<10%图2 鱿鱼中甲醛含量示意图Figure 2 Schematic diagram of formaldehyde mass fraction in squid

各样品中甲醛含量测量值的RSD均<10%图3 龙头鱼中甲醛含量示意图Figure 3 Schematic diagram of formaldehyde mass fraction in dragon fish
为探究水产品贮藏过程中甲醛含量及稳定碳同位素比值的变化,30 d后再次对甲醛含量较高的鱿鱼样品1~5号和龙头鱼样品1~6号进行甲醛含量和δ13C值测定,结果如图4所示。由图4可知,鱿鱼和龙头鱼的甲醛含量在30 d后均大量提高,其含量最高分别增加了35.956,224.416 mg/kg,且甲醛的δ13C 值也随之逐渐偏负,说明贮藏过程中,鱿鱼和龙头鱼体内的氧化三甲胺在酶的作用下反应活跃,甲醛不断产生,酶促反应中,氧化三甲胺转化而来的甲醛中碳原子偏轻,导致鱿鱼、龙头鱼中甲醛的稳定碳同位素比值逐渐偏负。
2.3 蔬菜制品中甲醛含量及其碳同位素组成
选取日常监督抽检中常有的蔬菜制品类别如干香菇、黄花菜、茶树菇、木耳、银耳进行甲醛含量测定,不同种类蔬菜制品中甲醛含量如图5所示。由图5可知,干香菇中甲醛含量普遍较高,最高可达212.741 mg/kg;黄花菜中甲醛未检出;茶树菇、木耳、银耳中甲醛均有检出,但含量较低,不超过3 mg/kg。香菇在生长和贮藏过程中,香菇体内的γ-谷氨酰转肽酶和半胱氨酸亚砜裂解酶可将香菇酸(γ-谷氨酰半胱氨酸亚砜)转化成甲醛,因此香菇本体会产生大量的内源性甲醛,并且随着贮藏时间的加长其含量不断增加(见表3),香菇中甲醛的δ13C值在90 d后逐渐偏正,可能在γ-谷氨酰转肽酶和半胱氨酸亚砜裂解酶作用下,香菇酸中更多13C原子转化为甲醛。

表3 贮藏期香菇干制品甲醛含量变化Table 3 Changes of formaldehyde mass fraction in dried lentinus edodes products during storage

1~5.鱿鱼样品 6~11.龙头鱼样品各样品种甲醛含量测量值RSD均<10%,δ 13C值测量值SD均<0.5‰图4 贮藏过程中甲醛含量及碳同位素比值变化示意图Figure 4 Schematic diagram of the change of formaldehyde mass fraction and carbon isotope ratio during storage

各样品种甲醛含量测量值RSD均<10%,δ 13C值测量值SD均<0.5‰图5 蔬菜制品中甲醛含量示意图Figure 5 Schematic diagram of formaldehyde mass fraction in vegetable products
2.4 果蔬中甲醛含量及其碳同位素组成
对关注度较高的一些果蔬进行分析,结果如图6所示。由图6可知,果蔬中检出的甲醛含量较低,苹果中含量最高为2.478 mg/kg,鲜香菇中甲醛含量较高,高达38.036 mg/kg,但低于干香菇,因为干香菇中水分少,一般贮藏时间长,甲醛残留量较高。
2.5 食品中甲醛源解析模拟试验及定量源解析模型分析
2.5.1 食品中甲醛来源分析模拟批试验及结果 选取龙头鱼中含量较高的样品进行外源性加标模拟试验并测定其甲醛含量及δ13C值,模拟试验结果如表4所示。由表4 可知,龙头鱼中添加3个不同浓度水平的标准储备溶液,加标回收率均>90%,无基质空白中添加4个不同浓度水平的标准储备溶液,加标回收率均>90%,不同浓度的空白加标样品中甲醛δ13C值标准偏差<0.5‰,甲醛含量对稳定碳同位素测试的影响较小。外源性甲醛标准品的δ13C值比龙头鱼偏正,向龙头鱼中添加外源甲醛会使龙头鱼样品中甲醛的δ13C值偏正,且添加量越大,δ13C值偏正越多。

各样品甲醛含量测量值RSD均<10%图6 果蔬中甲醛含量示意图Figure 6 Schematic diagram of formaldehyde mass fraction in fruits and vegetables

表4 龙头鱼中外源性甲醛加标模拟试验结果Table 4 Simulation test results of exogenous formaldehyde in dragon fish
2.5.2 甲醛来源定量解析模型适用性分析 分别在龙头鱼样品中加入3个浓度水平的外源性甲醛,其外源性甲醛贡献率的理论值、测定值和由式(4)计算得到的计算值如图7所示。由图7可知,通过测定浓度得到的外源甲醛贡献率测定值和理论值差异较小,由定量解析模型分析计算得到的人为添加外源甲醛贡献率计算值比理论贡献率偏大,甲醛添加量较低时,计算值与理论值偏差较大;甲醛添加量较高时,计算值与理论值相对标准偏差<15%。总体而言,通过甲醛来源定量分析模型来分析单一的外源性甲醛添加贡献是可行的,但是如果实际样品中外源性甲醛来源有多种,单纯的定量分析模型难以对不同来源的甲醛进行准确的定量计算,还需综合分析各来源甲醛的稳定碳同位素特征。

图7 外源性甲醛贡献率示意图Figure 7 Schematic diagram of exogenous formaldehyde contribution rate
3 结论
衍生化—气相色谱—燃烧—同位素比质谱法间接测定食品中甲醛的方法是可行的。水产品中甲醛含量为龙头鱼>鱿鱼>淡水鱼,淡水鱼中甲醛未检出,其含量差异可能与水产品中氧化三甲胺酶存在与否和浓度高低有关,龙头鱼和鱿鱼中甲醛的δ13C值均在贮藏30 d后越来越负。蔬菜制品中干香菇中甲醛含量较高,其δ13C值随贮藏时间的延长逐渐偏正,与水产品相反。这与香菇和水产品中不同的反应基质和酶有关,香菇中的酶促反应可能更倾向于将偏正的13C原子转化为甲醛。新鲜果蔬食品中甲醛含量较低,鲜香菇的甲醛含量较高,但远低于干香菇,鲜、干香菇的含量差异可能与水分含量、贮藏条件和时间有关。甲醛标准溶液中甲醛的δ13C值比龙头鱼偏正,因此向龙头鱼中添加甲醛标准溶液会使其δ13C值偏正,不同加标水平下测得的甲醛δ13C值及其贡献率符合甲醛来源定量分析模型,该模型可用于单一来源外源添加甲醛的食品中贡献率的分析计算。若外源性甲醛途径较多,则需结合多种来源甲醛的稳定碳同位素特征进行综合分析。后期需要建立食品中不同来源甲醛稳定碳同位素组成特征数据库,为食品中甲醛来源甄别解析提供科学依据。

