博来霉素诱导肺纤维化小鼠中差异表达的lncRNA筛选及生物信息学分析*
黄明华,程玲芳,胡婷婷,苏 建,叶玲玲,曾林祥
(南昌大学第二附属医院呼吸与危重症医学科,江西南昌330000)
肺纤维化是一种慢性进行性致死性疾病,是多种肺疾病的终末期改变,特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是其中一种常见的临床类型[1]。目前认为肺纤维化是肺泡正常细胞受理化因素损伤后,上皮细胞或内皮细胞向间质转化形成(肌)成纤维细胞,肌成纤维细胞分泌纤连蛋白或胶原蛋白等细胞外基质对肺间质进行修补形成的,以肌成纤维细胞异常增殖和细胞外基质大量沉积为特征[2-4],但其发病机制尚未明确,目前缺乏有效的治疗策略。目前多国批准吡非尼酮与尼达尼布用于IPF患者的抗纤维化治疗。在博来霉素(bleomycin,BLM)诱导的肺纤维化小鼠模型中,吡非尼酮在预防给药模型中效果更优,而尼达尼布在早期、晚期和全程治疗模型中效果更优[5]。但是,临床研究提示,二者虽可改善患者的肺功能,并不能显著提高生存率[6-7]。
近年来高通量基因测序及转录组分析技术快速发展,研究显示人类基因组转录区中,高达98%是无蛋白质编码功能的,称为非编码RNA(noncoding RNA,ncRNA),仅约基因组总数2%的基因能够编码蛋白质。研究显示非编码RNA参与调控多种生物 学 过 程[8-11]。长 链 非 编 码RNA(long noncoding RNA,lncRNA)是一类转录本长度超过200 nt,缺乏明显开放阅读框的RNA分子。lncRNA的转录具有时间特异性与组织特异性,其转录本作为信号分子,进一步调控其他基因的表达;lncRNA可作为竞争性内源性RNA(competitng endogenous RNA,ceRNA)吸附某些特定的微小RNA(microRNA,miRNA),从而调控相关miRNA靶基因的表达[9,12]。
本研究拟建立BLM诱导的肺纤维化小鼠模型,利用基因芯片技术对小鼠肺组织的基因表达谱进行分析,筛选小鼠肺纤维化组织中差异表达明显的lncRNA。再综合利用生物信息学工具对其进行靶基因预测,并行GO富集和KEGG信号通路分析,识别出肺纤维化小鼠中差异表达的lncRNA及其靶基因,并分析其可能调控的信号通路。
材料和方法
1 实验动物
SPF级6~8周龄C57BL/6雄性小鼠12只,体重约20~22g,购买自湖南斯莱克景达实验动物有限公司,动物合格证号为SCXK(湘)2019-0004。
2 主要实验试剂
BLM购于海正辉瑞制药有限公司;HE染色试剂盒和戊巴比妥钠购于上海碧云天生物技术有限公司;Trizol试剂购于Thermo;RNA纯化试剂盒购于QIAGEN;其他生化试剂均为国产分析纯。
3 主要实验仪器
烤片机(德国美康);热循环仪(莱普特科学仪器有限公司);安捷伦芯片扫描仪、分子杂交盒、分子杂交箱和杂交箱旋转器(Agilent)。
4 方法
4.1 实验分组与肺纤维化模型建立将实验小鼠随机分为两组:实验(BLM)组和对照(normal control,NC)组(n=6)。肺纤维化小鼠模型的构建依据课题组先前经验[13],确定经气管内滴注BLM的剂量为3 mg/kg。充分麻醉后,向实验组小鼠气管内一次性滴入BLM(3 mg/kg)构建肺纤维化模型,向对照组小鼠气管内滴入等量的生理盐水,记为第0天,常规自由饮食。于第21天腹腔注射1.5%戊巴比妥钠过量麻醉处死小鼠,并分别收集两组小鼠各叶肺组织。取部分肺组织于4%多聚甲醛固定24 h后,制作石蜡切片,用于HE染色和Masson染色;剩余肺组织经液氮速冻后,保存于-80℃冰箱。
4.2 HE染色和Masson染色
4.2.1 HE染色(1)石蜡切片脱蜡至水,依次将切片放入二甲苯Ⅰ中20 min→二甲苯Ⅱ中20 min→无水乙醇Ⅰ中5min→无水乙醇Ⅱ中5 min-75%乙醇中5 min,自来水冲洗;(2)苏木素染色3~5 min,盐酸水溶液分化,氨水水溶液返蓝,流水冲洗;(3)切片依次入85%和95%的梯度乙醇脱水,入伊红染液中染色5 min;(4)切片依次放入无水乙醇I中5 min→无水乙醇Ⅱ中5 min→无水乙醇Ⅲ中5 min→二甲苯Ⅰ中5 min→二甲苯Ⅱ中5 min透明,中性树胶封片。
4.2.2 Masson染色(1)石蜡切片脱蜡至水,依次将切片放入二甲苯Ⅰ中20 min-二甲苯Ⅱ中20 min-无水乙醇Ⅰ中5 min-无水乙醇Ⅱ中5 min-75%乙醇中5 min,自来水冲洗;(2)切片放入重铬酸钾浸泡过夜,自来水冲洗;(3)铁苏木素A液与B液等比混合成铁苏木素染液,切片入铁苏木素3 min,自来水冲洗,盐酸酒精溶液分化,自来水冲洗;(4)切片放入丽春红酸性品红浸染5~10 min,自来水漂洗;(5)磷钼酸水溶液浸染1~3 min;磷钼酸之后不用水洗,直接入苯胺蓝染液染3~6 min;(6)切片用1%冰醋酸分化,两缸无水乙醇脱水;(7)切片放入第3缸无水乙醇中浸泡5 min,二甲苯中浸泡5 min透明,中性树胶封片。
4.3 RNA抽提与质检使用Trizol试剂提取肺组织标本总RNA并按照试剂盒进行纯化。经分光光度计NanoDrop 2000及Agilent Bioanalyzer 2100对其进行质检。
4.4 微阵列杂交采用Agilent 4×180 K表达谱芯片挑选质检合格的BLM组(n=2)及对照组(n=2)标本RNA共2对进行杂交和扫描。
4.5 生物信息学分析采用R软件的数据集limma对初始数据进行归一化处理后,利用差异倍数(fold change>2.0)来筛选肺纤维化相关的差异表达基因。对差异表达的lncRNA进行靶基因顺式作用(cis-)和反式作用(trans-)预测,并对靶基因进行GO富集和KEGG信号通路分析。
结 果
1 肺纤维化小鼠模型的建立
HE染色观察肺组织的纤维化程度,结果显示,对照组中肺泡结构完整无破坏,肺泡壁无增厚,肺泡腔内未见炎症细胞浸润,见图1A;BLM组中肺组织正常的肺泡结构被破坏,肺泡间隔显著增厚,成纤维细胞增生,肺泡腔缩小,可见炎症细胞浸润,见图1B。Masson染色检测肺组织胶原沉积情况,相对于正常组,BLM组可见诸多蓝染的胶原,表明经BLM处理后小鼠肺组织内出现大量胶原蛋白沉积,见图1C、1D。说明BLM诱导肺纤维化建模成功。
2 在BLM诱导的肺纤维化小鼠中差异表达的lncRNA筛选
通过芯片微阵列分析,识别在对照组与BLM组小鼠肺组织中差异表达的lncRNA,见图2。以差异倍数>2.0为筛选条件,共得到1 384个有差异表达的lncRNA,其中表达上调的lncRNA有645个,表达下调的lncRNA有739个;其中表达上调10倍以上的lncRNA有8个,表达下调5倍以上的lncRNA有15个,表1展示了部分差异表达显著的lncRNA。
3 差异表达显著的lncRNA顺式(cis-)作用和反式(trans-)作用的靶基因预测
通过对差异表达明显的lncRNA进行靶基因预测,结果表明17个lncRNAs具有靶基因,其中5个通过顺式(cis-)作用对靶基因进行调控,靶基因分别是Chl1、Col24a1、Cdc25、Fam53c、Il-7和Nrep;2个是通过反式(trans-)作用来对靶基因进行调控,靶基因分别是Kdm5c和Rhbdd2;另10个可同时通过顺式和反式两种作用方式来对靶基因进行调控,靶基因分别为Chl1、Tnfrsf10b、Gjc3、Maoa、Vmn1r58、Syt12、Lix1、Gpr157和Mbd4等,见表2。
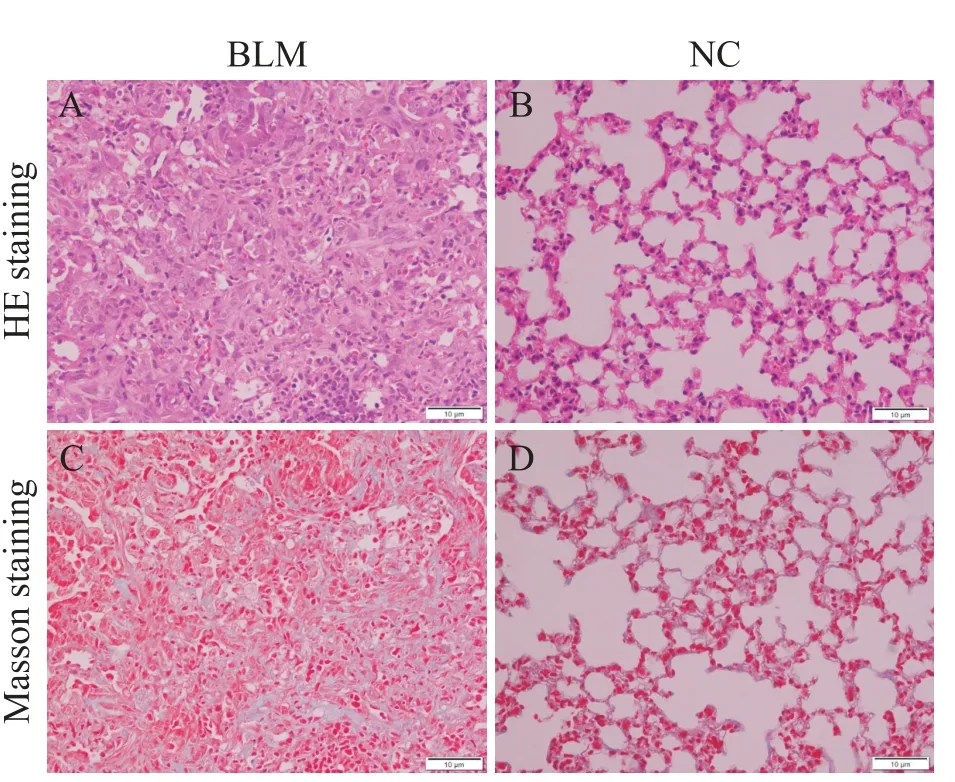
Figure 1.A mouse model of bleomycin(BLM)-induced pulmonary fibrosis was established.A and B:HE staining showed clear alveolar space structure in the normal control group,no thickening of alveolar walls,and no obvious inflammatory cell infiltration.Compared with the normal control group,the lung tissue alveolar structure of BLM-induced pulmonary fibrosis mice was destroyed,the alveolar cavity was narrowed,the tissue interval was thickened,and the fibroblast foci were formed,accompanied by inflammatory cell infiltration.C and D:Masson staining showed that the lung tissue of the normal control group had clear alveolar structure,normal tissue spacing,and no obvious collagen deposition.In BLM group,the alveolar structures were damaged,tissue spacers were thickened,and a large number of blue stained collagen depositions were significantly increased.图1 肺纤维化小鼠模型的建立
4 GO富集与KEGG信号通路分析
通过对差异表达显著的lncRNA的靶基因从细胞成分,生物过程和分子功能3个方面进行GO富集,见图3A,结果显示cis靶基因GO富集中主要有Ⅰ型干扰素结合受体,STAT蛋白丝氨酸磷酸化和肌浆网钙离子转运等;trans靶基因富集条目中,主要有细胞组分端粒酶全酶复合体,RNA监控机制和坏死性凋亡小体等。利用KEGG数据库对差异表达基因可能参与的信号通路进行分析,共得到78条信号转导通路,主要包括钙信号通路、PI3K-AKT信号通路、Ras信号通路、Wnt信号通路、mTOR信号通路、JAKSTAT信号通路、TGF-β信号通路、P53信号通路、Notch信号通路、Toll样受体信号通路和肾素-血管紧张素-醛固酮系统等,见图3B。
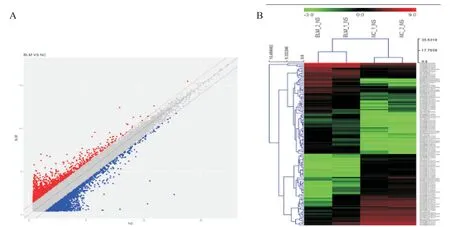
Figure 2.Analysis of differentially expressed lncRNAs in chip results.A:scatter plot analysis of lncRNA data in BLM group and NC group identified in chip;B:cluster analysis heat map showed differentially expressed lncRNAs in mouse model of pulmonary fibrosis.图2 基因芯片结果中差异表达lncRNA的分析
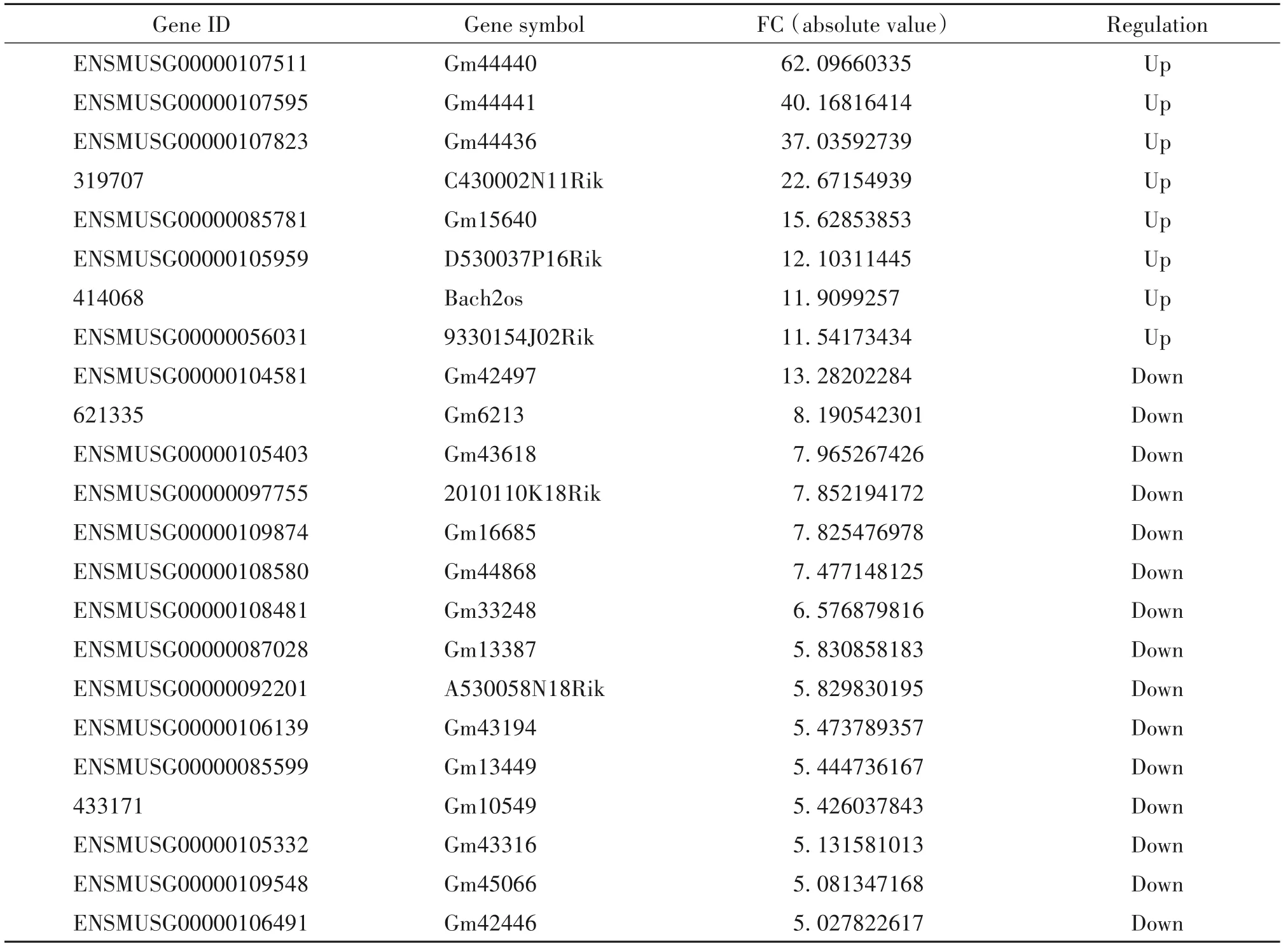
表1 肺纤维化小鼠肺组织中部分显著差异表达的lncRNATable 1.Part of differentially expressed lncRNAs in lung tissue of pulmonary fibrosis mice
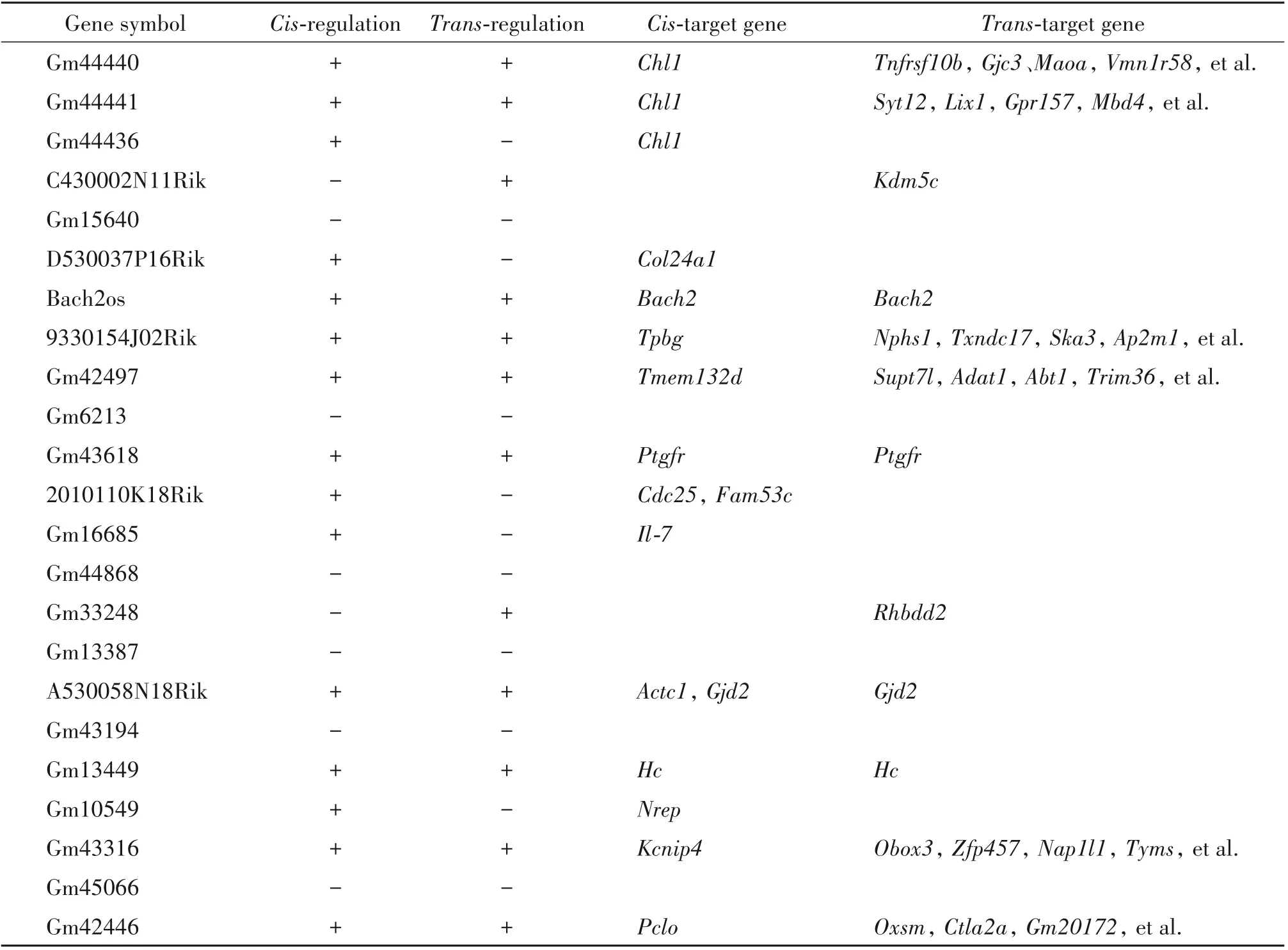
表2 差异表达lncRNA的靶基因预测Table 2.Target gene prediction of differentially expressed lncRNAs
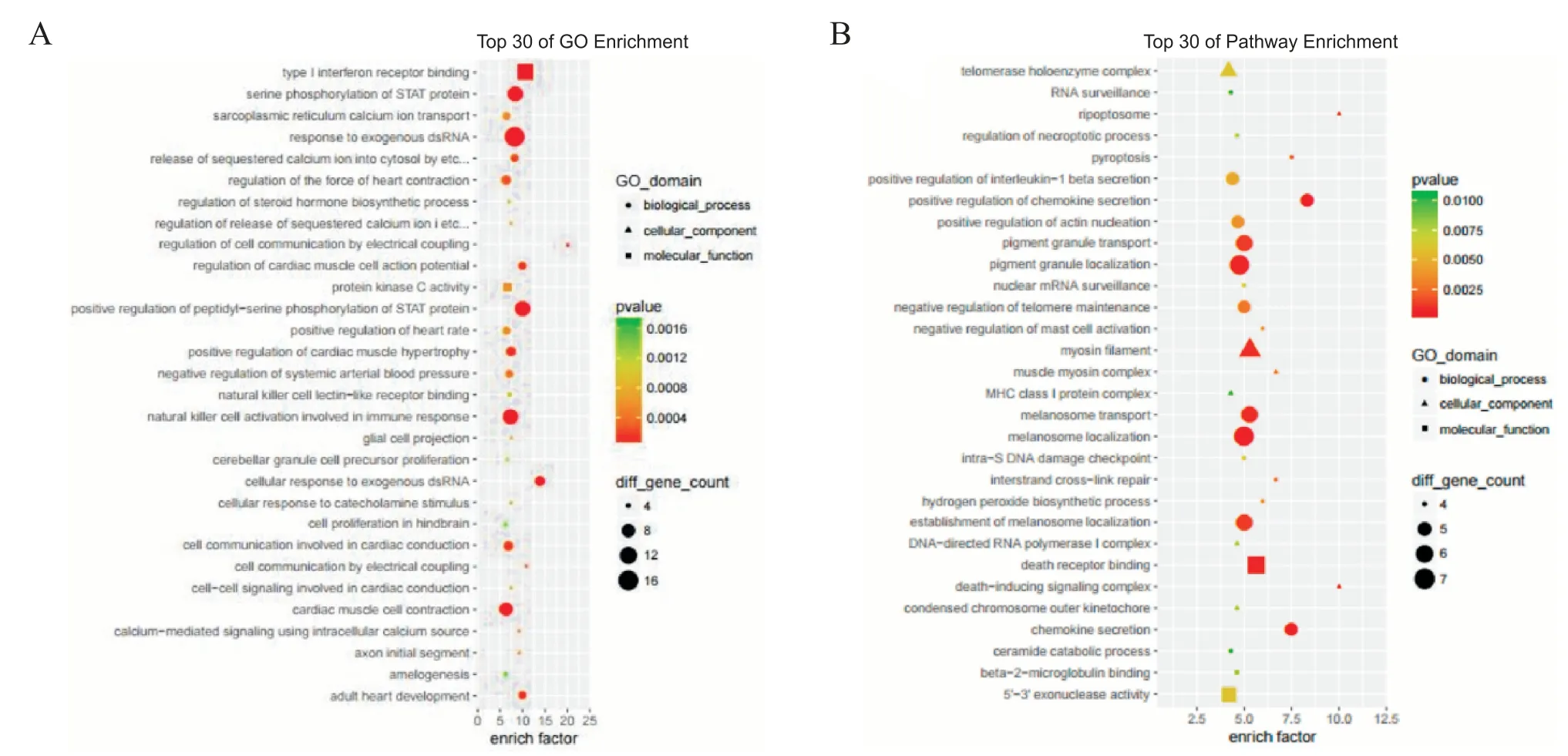
Figure 3.GO enrichment and KEGG signaling pathway analysis of target genes predicted by differentially expressed lncRNAs.A:GO enrichment analysis on target genes predicted by differentially expressed lncRNAs from three aspects of cell components,biological processes and molecular functions;B:KEGGsignaling pathway analysis of target genes predicted by differentially expressed lncRNAs.图3 GO富集和KEGG信号通路分析
讨 论
BLM是一种抗肿瘤药物,因其可致肺纤维化的不良反应而被应用于肺纤维化及IPF相关动物模型的建立。BLM是目前研究慢性进展性肺疾病最广泛使用的模型药物之一,包括批准用于减缓某些IPF亚群进展的吡非尼酮和尼达尼布的临床前开发均使用了BLM诱导的肺纤维化模型。虽然BLM诱导小鼠肺纤维化模型不能完全模拟临床IPF患者的病理进程[14],但BLM动物模型仍然是研究肺纤维化疾病发病机理和测试新型药物或化合物的常用的实验工具之一。
近年来,非编码RNA在肺纤维化的病理生理过程中发挥重要作用。随着miRNA在疾病中的广泛研究,lncRNA在疾病中的作用也引起了研究者的广泛关注。多项研究提示lncRNA在心肌纤维化、肝纤维化和肾纤维化等多种纤维化疾病中发挥作用[15-18],而lncRNA在肺纤维化中的研究目前尚少。
在本研究中,我们通过基因芯片技术分析BLM诱导的小鼠肺纤维化模型中lncRNAs的表达,筛选出差异表达的lncRNAs共1 384个,其中表达上调2倍及以上的lncRNAs有645个,表达下调2倍及以上的lncRNAs有739个;表达上调10倍以上的lncRNAs有8个,表达下调5倍以上的lncRNAs有15个。有研究[19]通过微阵列分析了二氧化硅诱导的肺纤维化大鼠肺组织中有682个差异表达的lncRNAs,其中300个表达上调,382个表达下调。由于使用不同的诱导试剂及实验对象,结果具有一定的差异。IPF这个疾病本身具有明显的异质性,其致病机制可能涉及多基因多途径共同作用,且在不同个体可能起主导作用的基因或途径不尽相同。LncRNA可通过与染色质结合连接DNA和蛋白质,并作为修饰蛋白质复合物的支架,通过调控染色质的循环,将启动子与增强子或增强子样的非编码基因连接起来,并通过将它们导向特定的位点,赋予组蛋白修饰复合物特异性[20]。目前较多的研究主要是lncRNA作为ceRNA吸附某些特定的miRNA,从而调控相关miRNA靶基因的表达。lncRNA NONMMUT065582被指定为肺纤维化相关RNA(plumonary fibrosis-accociated RNA,PFAR),在患有肺纤维化的小鼠的肺组织及纤维化肺成纤维细胞中被上调,lncRNA PFAR通过靶向miR-138来调节YAP1-Twist轴从而促进肺成纤维细胞活化和纤维化[21]。研究显示lncRNA ZEB1-AS1在BLM诱导的大鼠和TGF-β1诱导的RLE-6TN细胞中上调,通过竞争性结合miR-141-3p,lncRNA ZEB1-AS1通过zeb1介导的上皮间质转化促进肺纤维化[22]。目前鉴定出的lncRNAs除少数外,大部分没有正式的命名和确定的功能研究,值得进一步探究。在我们的芯片结果中,lncRNA Gm16685在小鼠肺纤维化组织中表达下调,靶基因预测显示白细胞介素7(interleukin-7,IL-7)是差异基因Gm16685的靶基因,Gm16685通过cis-调控来调节IL-7的表达水平。IL-7最初由骨髓基质细胞分离出来,诸多研究表明它能抑制肿瘤、骨髓纤维化和肺纤维化等的发生发展。有研究提示IL-7能抑制肺纤维化中成纤维细胞TGF-β的产生和信号转导[23]。此外,有研究观察到IL-7在使用多粘菌素B治疗IPF急性加重后,表达显著增加[24],表明IL-7在肺纤维化中可能起重要作用,而在肺纤维化小鼠中lncRNA Gm16685对IL-7的具体的作用机制,还有待进一步的研究。此外,本研究对差异表达的lncRNAs进行靶基因预测,并进行GO功能注释分析,结果显示这些肺纤维化小鼠肺组织中差异表达的lncRNAs可通过顺式(cis-)和/或反式(trans-)调控来调节其靶蛋白编码基因的表达,从而参与调控分子功能及生物过程等。lncRNA可通过多种方式发挥生物学作用。对差异表达的lncRNAs进行KEGG信号通路分析,提示lncRNAs的靶基因可参与肺纤维化中多条信号通路。近年来,各种信号通路在肺纤维化中的作用逐渐成为国内外学者关注的重点[25-27]。有研究报道mTOR通路激活参与肺纤维化过程,上调的lncRNA AP003419.16通过调控RPS6KB2,从而激活了mTOR信号通路促进了IPF的发生[28]。信号通路在肺纤维化疾病中作用机制多样复杂,且多个通路及其中的转导分子相互交叉成调控网络,共同调控肺纤维化相关基因的表达。
综上所述,我们通过芯片微阵列技术分析BLM诱导小鼠肺纤维化模型与正常小鼠肺组织中差异表达的lncRNA,并且通过生物信息学分析差异lncRNA的靶基因及对靶基因进行GO富集与KEGG信号通路分析,识别出与小鼠肺纤维化密切相关的lncRNA,为肺纤维化研究提供了参考资料。
- 中国病理生理杂志的其它文章
- ERK信号通路介导的EP300过表达在苯肾上腺素诱导小鼠心肌细胞肥大中的作用*
- 益肾通络方对大鼠勃起功能障碍及NO-cGMP通路的影响*
- 静脉注射SCAD重组腺病毒减轻自发性高血压大鼠心肌肥厚和纤维化*
- Thioredoxin-interacting protein contributesto cardiac fibrosisby elevating oxidative stress in cardiac fibroblasts*
- 延髓头端腹内侧部NADPH氧化酶2激活导致活性氧簇释放在皮肤/肌肉切开和牵拉引起的慢性术后疼痛中的作用*
- 干扰海马spastin表达通过抑制突触传递介导小鼠认知功能障碍*

