PPARγ在结核分枝杆菌感染小鼠脂质代谢中的作用*
赵晓杰,韩晓群,邓 琴,杨 婧,周智兴,刘冬梅,王海利
(宜春学院1化学与生物工程学院,2医学院医学免疫与微生物学教研室,江西宜春336000)
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,MTB)引起的、严重危害人类健康的呼吸道传染病。目前尽管在监测和治疗肺结核方面做出了持续和广泛的努力,但全球每年仍有约20亿人感染MTB,100多万人死于结核病及其并发症[1]。因而,探索针对细菌和宿主的治疗方法以阻止MTB感染和进展为活动性结核病迫在眉睫。
MTB在宿主体内可通过调节多种基因表达,进而调节机体的脂质代谢和炎症反应,从而为其适应细胞内的生活方式提供条件[2],其中过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptorγ,PPARγ)便是在脂质代谢调节中发挥重要作用的胞内诱导基因之一。PPARγ是一种配体激活的转录因子,与视黄醇X受体(retinoid X receptor,RXR)形成异二聚体,通过与靶基因启动子区的特异性PPAR反应元件(PPAR-response elements,PPRE)结合,调控多种基因表达[3],使其成为一种稳定的葡萄糖稳态和脂质代谢的调节剂,参与了肿瘤的发生发展[4]、细胞分化[5]、脂质代谢[6]和炎症反应[7-8]等多种病理生理过程[9]。
研究证实,MTB感染巨噬细胞中PPARγ的表达在脂质聚集中发挥重要作用[10],而脂质聚集有助于细胞内MTB的存活和/或复制[11],但其作用是否通过PPARγ依赖途径及其机制尚未阐明。另外,PPARγ的抑制在体内MTB感染过程中能否增强机体对胞内病原体的清除作用尚无体内研究予以证实。因此,本研究通过探讨PPARγ对MTB感染小鼠机体脂质代谢及肺组织损伤的影响及机制,为揭示MTB的致病机理提供重要线索,为结核病的防治提供新的理论依据。
材料和方法
1 实验材料
1.1 实验用菌株与实验动物MTB标准株H37Rv由中国药品生物制品检定所提供。细菌在含有马铃薯、蛋黄、孔雀绿的罗氏培养基中培养至对数期,无菌滤过,调整单细胞悬液菌浓度为5×109CFU/L,分装冻存于-80℃低温冰箱备用。
6~8周龄SPF级C57BL/6雄性小鼠60只,体重18~20 g,购自三峡大学动物实验中心。动物在感染前1周进入生物安全Ⅲ级实验室。
1.2 主要试剂Trizol试剂购自北京艾德莱生物科技有限公司;SYBR Green Master Mix购自南京诺唯赞生物科技股份有限公司;高效RNA-cDNA试剂盒购自Applied Biosystems;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)ELISA检测试剂盒购自南京建成生物工程研究所;油红O购自Sigma;抗CD36抗体购自Abcam。
2 方法
2.1 实验分组及处理方法实验分4组:(1)对照(control)组:尾静脉注射PBS;(2)MTB组:尾静脉注射MTB菌液,感染剂量为5×105CFU;(3)MTB+罗格列酮(rosiglitazone,ROZ)组:注射MTB前3 d,给予ROZ灌胃,剂量为4 mg·kg-1·d-1,注射MTB后1 h再给予当天的罗格列酮灌胃,以后按照计划剂量(4 mg·kg-1·d-1)给予灌胃;(4)MTB+GW9662组:注射MTB后1 h,给予腹腔内注射GW9662,剂量为4 mg/kg,以后按照计划剂量(4 mg·kg-1·d-1)给予GW9662腹腔注射。按照以上分组方法处理小鼠6周后,禁食12 h,断头采血,离心分离血浆,置于-80℃冰箱保存。取小鼠部分肺组织置于-80℃冰箱保存备测PPARγ表达,剩余肺组织进行油红染色、荷菌量检测及病理分析。
2.2 肺组织荷菌量检测严格无菌条件下取各组小鼠肺组织充分漂洗,加入生理盐水1mL,用组织匀浆器研磨制备组织悬液,取0.1mL以生理盐水作10倍倍比稀释,取各稀释度的组织稀释液100μL接种于罗氏斜面培养基,37℃培养4周后进行菌落计数。取每个斜面上的菌落数在5~50 CFU范围内的稀释度进行组织荷菌量计算。
2.3 HE染色观察肺组织的病理变化取各组小鼠部分肺组织,用4%多聚甲醛固定液固定24h,经过梯度乙醇脱水后进行石蜡包埋、切片及脱蜡、HE染色,光学显微镜下观察肺组织病理变化。
2.4 RT-qPCR检测肺组织PPARγ的mRNA表达取-80℃冰箱中保存的新鲜冰冻肺组织制成组织匀浆,按照文献报道的方法[12],采用RT-qPCR检测肺组织PPARγ的mRNA表达。引物序列如表1所示。以β-actin为内参照,相对表达量采用2-ΔΔCt法进行计算。mRNA水平用β-actin表达的相对量进行标准化,结果用2-ΔΔCt方法分析。
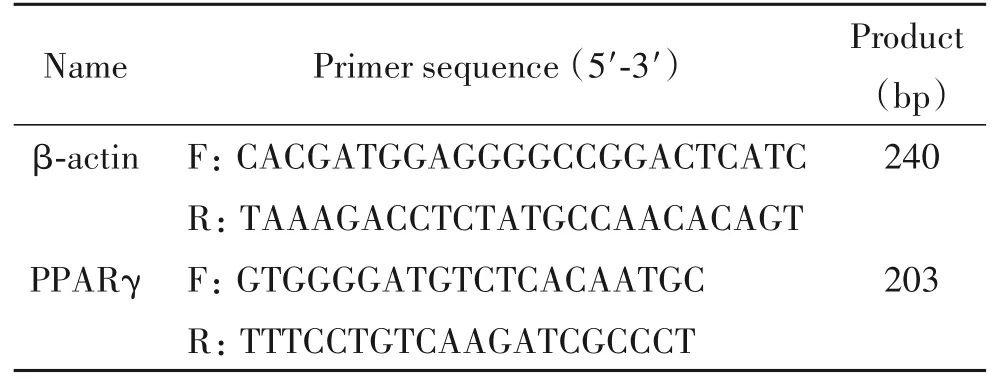
表1 RT-qPCR引物序列Table 1.Primer sequences for RT-qPCR
2.5 Western blot检测肺组织PPARγ的蛋白表达取肺组织100 mg,用RIPA裂解液提取肺组织中的蛋白。按常规操作进行PPARγ的Western blot检测,蛋白条带通过化学发光剂显影,用BandScan分析胶片灰度值,目标蛋白表达量通过β-actin进行校正。
2.6 油红O染色观察肺组织内脂质蓄积冰冻切片用甲醛-钙固定10 min,蒸馏水洗,继之以60%异丙醇浸洗,油红O染液染10 min,60%异丙醇分色至背景无色,再次蒸馏水洗。Mayer苏木素复染数分钟,PBS浸洗(蓝化)3 min。蒸馏水洗后水溶性封片剂封片,显微镜下观察。
2.7 ELISA检测血浆脂质水平使用TC、TG、LDLC和HDL-C试剂盒,采用ELISA在全自动酶标仪(Thermo Scientific)上进行检测。
2.8 免疫组化检测肺组织CD36的表达组织块经乙醇脱水后经二甲苯透明、浸蜡、包埋、切片、烤片和脱蜡后,加适量的0.01 mol/L枸橼酸缓冲液(pH 6.0)置于微波炉中进行抗原修复。3%的过氧化氢滴加于切片组织上以阻断内源性过氧化物酶。加Ⅰ抗后于4℃湿盒中孵育过夜(15 h)。加酶标Ⅱ抗,37℃孵育30 min。每一步操作之间均以0.01 mol/L PBS液冲洗3 min。DAB显色,苏木素复染2 min,脱水透明后封片,显微镜下观察。
3 统计学处理
数据使用SPSS 19.0统计软件进行分析。计量资料采用均数±标准差(mean±SD)表示。多组独立、正态、方差齐资料组间比较采用单因素方差分析,多重比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 MTB感染后小鼠肺组织PPARγ表达的变化
如图1所示,对照组、MTB组、MTB+ROZ组及MTB+GW9662组之间PPARγ表达的差异均有统计学意义(P<0.05)。与对照组相比,MTB组、MTB+ROZ组及MTB+GW9662组小鼠肺组织PPARγ的mRNA和蛋白表达水平均显著升高(P<0.05);MTB+ROZ组小鼠肺组织PPARγ表达显著高于MTB组,MTB+GW9662组小鼠肺组织PPARγ表达则较MTB组显著降低(P<0.05)。
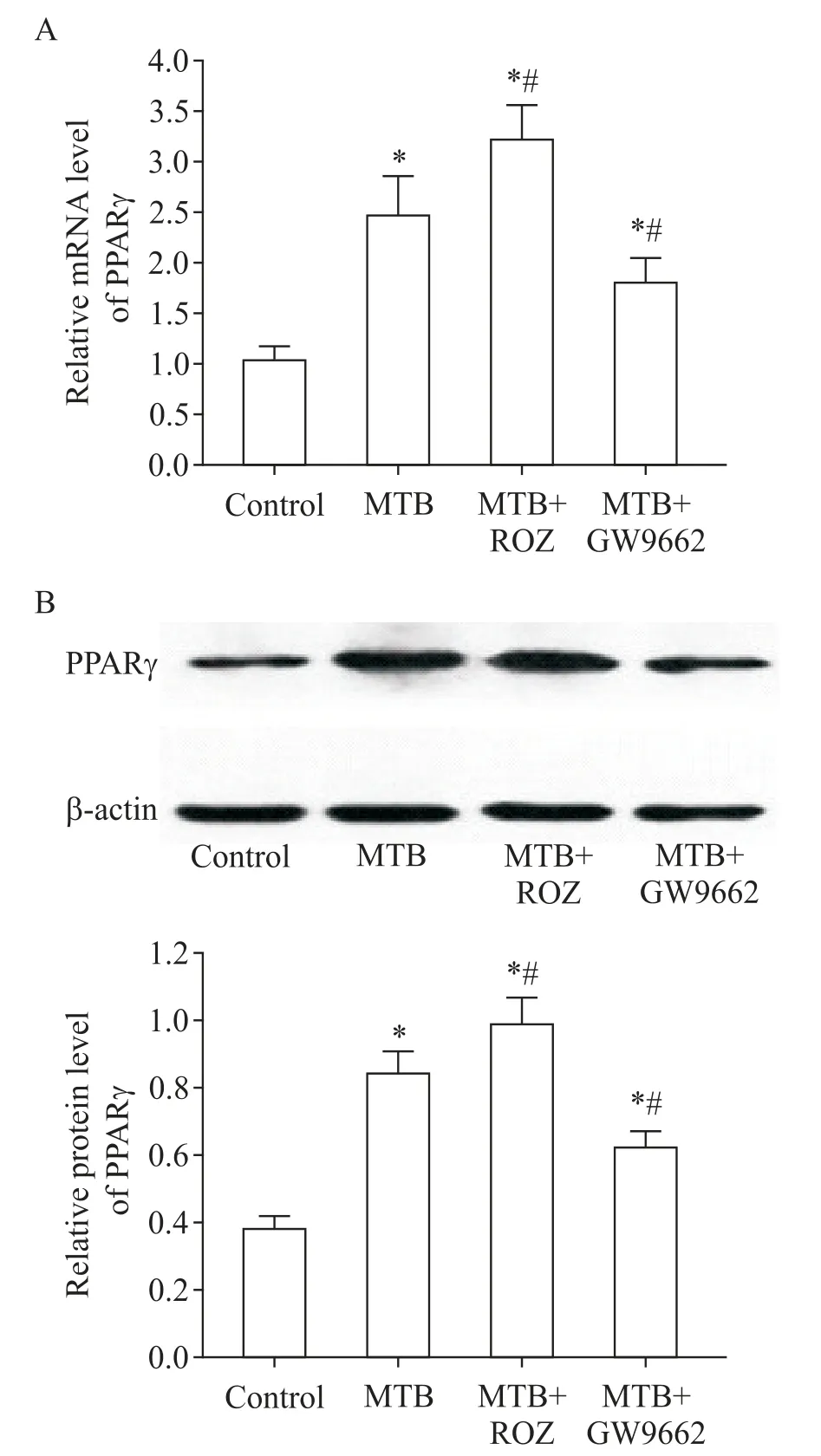
Figure 1.Expression of PPARγat mRNA and protein levels in the lung tissue of mice in each group.A:the mRNA expression of PPARγin the lung tissue of mice in each group;B:the protein expression of PPARγin the lung tissue of mice in each group.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs MTBgroup.图1 各组小鼠肺组织PPARγ的mRNA和蛋白表达
2 各组小鼠肺组织脂质水平
油红O染色结果显示,MTB组小鼠肺组织可见少量橙红色脂滴;MTB+ROZ组小鼠肺组织内橙红色脂滴弥漫分布,较单纯MTB组明显增多;而MTB+GW9662组小鼠肺组织内脂滴数量较MTB组明显减少,见图2。
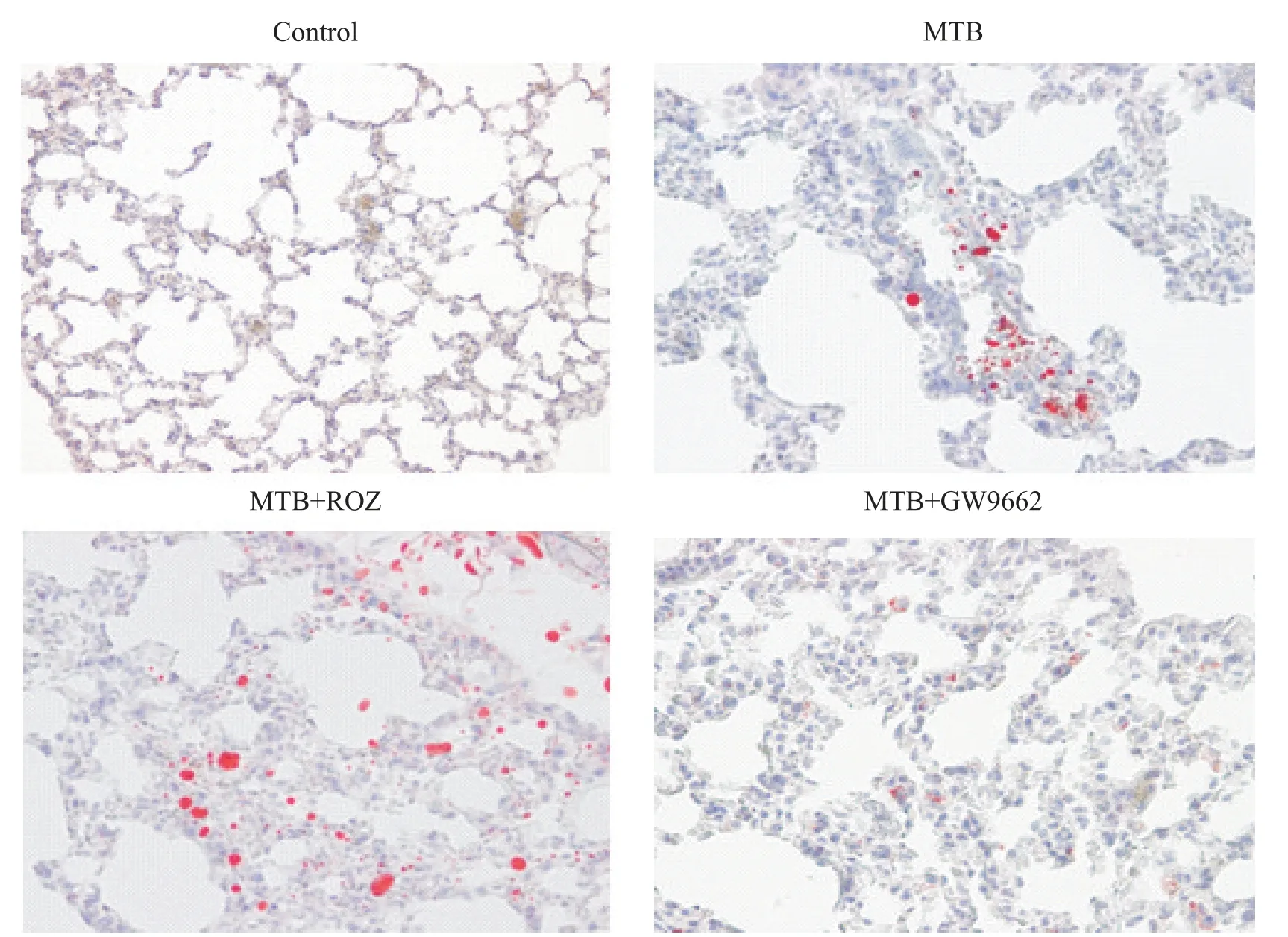
Figure 2.Lipid level in the lung tissue of mice in each group(Oil red Ostaining,×400).图2 各组小鼠肺组织脂质水平
3 各组小鼠肺组织荷菌量的比较
如图3所示,MTB组、MTB+ROZ组及MTB+GW9662组之间肺组织荷菌量的差异均有统计学意义(F=13.247,P<0.05)。与MTB组比较,MTB+ROZ组小鼠肺组织荷菌量明显升高(6.20±0.58vs6.92±0.21,P<0.05);MTB+GW9662组小鼠肺组织荷菌量明显降低(6.20±0.58vs5.50±0.49,P<0.05)。
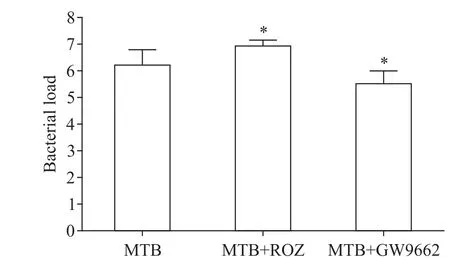
Figure 3.Bacterial load in lung tissue of mice in each group.Mean±SD.n=3.*P<0.05 vs MTB group.图3 各组小鼠肺组织荷菌量
4 肺组织PPARγ表达与荷菌量相关性分析
相关性分析结果显示各组小鼠肺组织PPARγ表达与荷菌量对数值呈正相关(r=0.812,P<0.01),见图4。
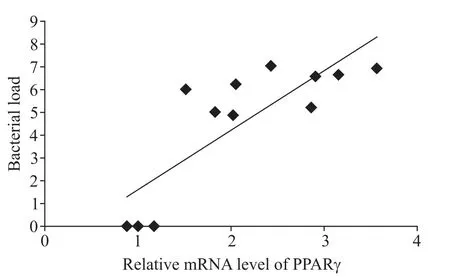
Figure 4.The correlation between PPARγexpression and bacterial load.Mean±SD.n=3.图4 小鼠肺组织PPARγ表达与荷菌量相关性
5 各组小鼠肺组织CD36表达
免疫组化染色结果显示,CD36镜下观察为棕褐色沉淀。CD36在MTB组呈中等表达,在MTB+ROZ组呈高表达,而在对照组和MTB+GW9662组不表达和呈低表达,见图5。这表明PPARγ活化能够增加CD36的表达,而拮抗PPARγ活性则抑制CD36的表达。
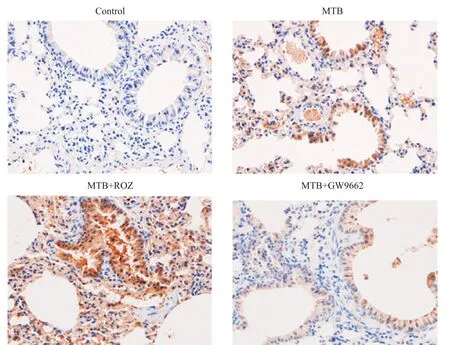
Figure 5.Expression of CD36 in lung tissue of mice in each group(×400).图5 各组小鼠肺组织CD36表达
6 各组小鼠血浆脂质浓度
如图6所示,对照组、MTB组、MTB+ROZ组及MTB+GW9662组之间TC、TG、LDL-C及HDL-C的差异均有统计学意义(P<0.05)。MTB组小鼠血浆脂质水平均明显低于对照组(P<0.05);与单纯MTB感染组相比,感染的同时给予PPARγ激动剂罗格列酮和PPARγ拮抗剂GW9662,血浆脂质水平分别表现为明显下降(P<0.05)和升高(P<0.05)。
7 各组小鼠肺组织病理变化
MTB组及MTB+ROZ组小鼠肺组织镜下均可见肺泡壁增厚、肺组织坏死和出血、炎症细胞浸润,后者可见肺泡腔内出现粉红色渗出液,提示病变更为严重;MTB+GW9662组小鼠肺组织镜下虽然亦可见组织坏死及出血,但病变较轻,见图7。
讨 论
MTB侵入人体后,肺泡巨噬细胞是抵御细菌感染的第一道防线[13]。PPARγ在肺泡巨噬细胞的高表达,在结核病的发病机制中起着关键作用。本课题组前期研究显示,结核病患者外周血单核细胞PPARγ表达高于健康对照组[14]。从本研究结果来看,MTB感染小鼠后,对肺组织造成了一定的结核性损伤,PPARγ的mRNA和蛋白表达均较对照组明显升高。本研究亦对肝脏和脾脏进行了组织病理学检测,仅显示轻度炎症反应,肝、脾组织PPARγ的mRNA和蛋白表达与对照组相比无显著差异(结果未在文中列出)。进一步证实PPARγ与结核病发病存在一定的关系。
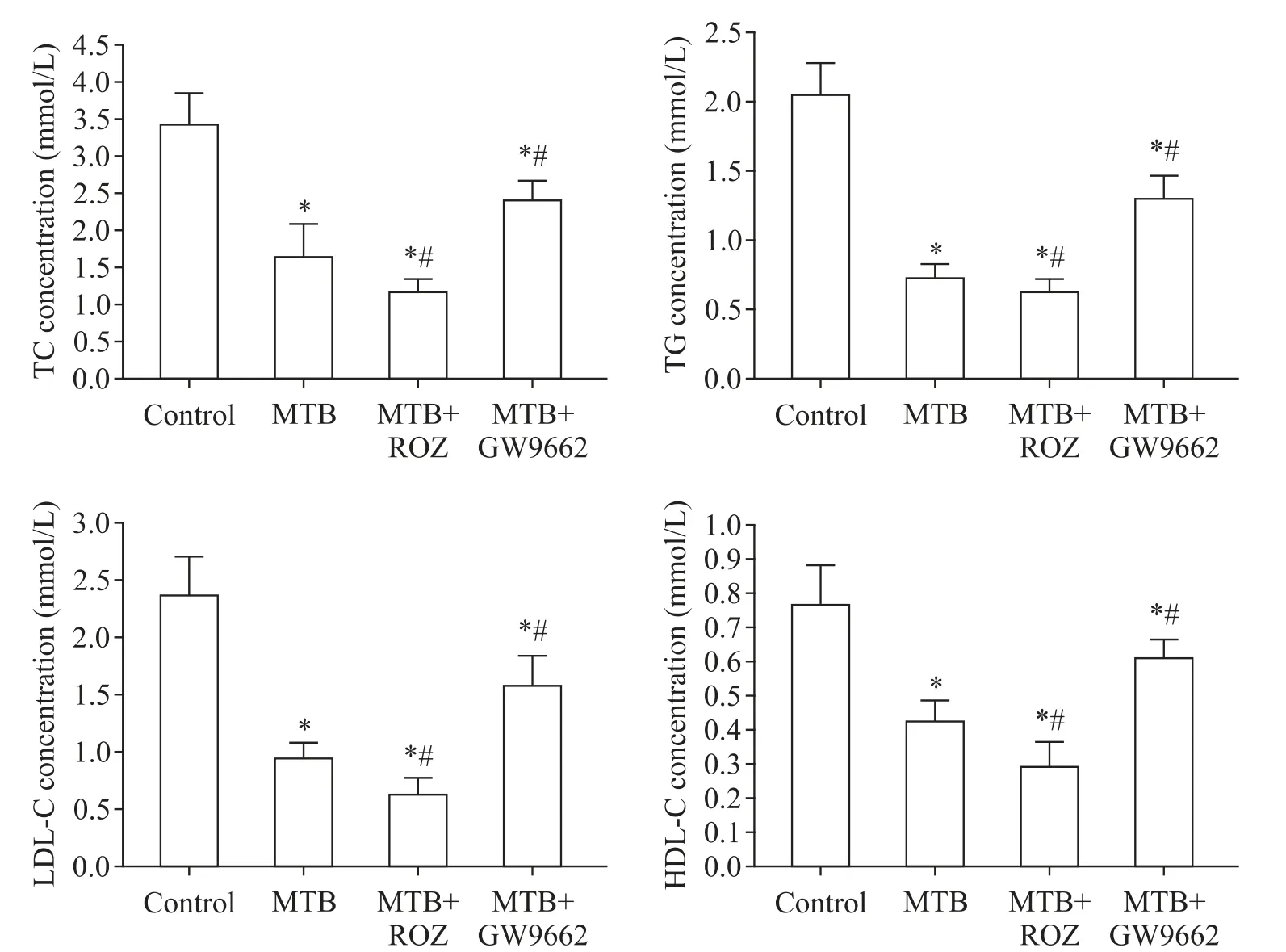
Figure 6.Lipid concentration in plasma of mice in each group.Mean±SD.n=6.*P<0.05 vs control group;#P<0.05 vs MTBgroup.图6 各组小鼠血浆脂质浓度
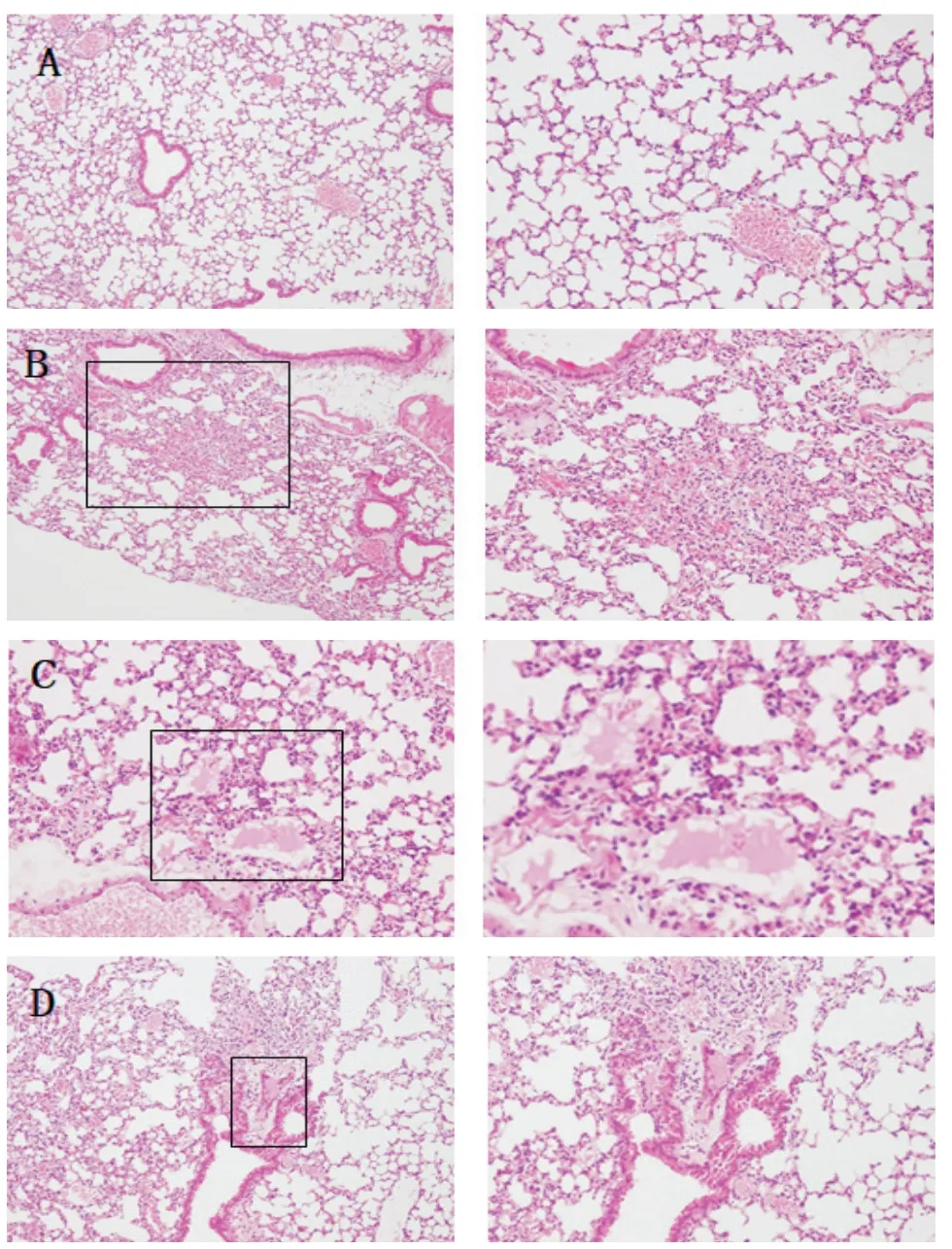
Figure 7.Pathological changes of the lung tissue of mice in each group(left:×40;right:×200).A:control group;B:MTB group;C:MTB+ROZ group;D:MTB+GW9662 group.图7 各组小鼠肺组织病理变化
MTB感染期间,慢性炎症的一个重要特征是由MTB所诱导的泡沫巨噬细胞的积累,这是破坏巨噬细胞中脂质稳态的因素之一,而这些脂质的聚集会影响宿主对感染或细菌清除的反应,并且为细菌的生长提供营养,从而促进细菌生长[15]。结核病患者的干酪性结核肉芽肿中表现出过多的宿主脂质代谢基因表达上调[16],导致组织中脂质蓄积。本课题组前期研究结果证实了结核病患者PPARγ表达的增加与其血浆脂质水平的变化具有一定的关系[14]。本研究结果显示,MTB感染小鼠肺组织中可见红色脂滴形成。有研究报道,MTB感染后通过多种机制诱导肺泡巨噬细胞泡沫化,继之抑制巨噬细胞膜的修复功能,最终导致其破裂坏死,释放胞内脂质成分而形成干酪样坏死[17],因而推测肺泡巨噬细胞可能是MTB感染肺组织脂质的重要来源。MTB+ROZ组肺组织内橙红色脂滴弥漫分布,较单纯MTB组明显增多,MTB+GW9662组肺组织内脂滴数量明显减少。可见,PPARγ的活化能够加剧MTB所诱导的脂质聚集,而PPARγ拮抗剂GW9662则对MTB所致的脂质聚集具有逆转作用,表明PPARγ在结核病相关脂质代谢中发挥了重要的作用。
Knight等[18]认为,MTB特异性地激发脂滴的形成,是一种致病策略,目的是建立宿主脂质库,作为碳源来促进自身在细胞内的生长。MTB优先利用脂质促进多种代谢功能,包括能量合成,毒力因子表达,细胞壁和外膜构建,为自身在宿主体内生长提供有益条件[11]。本研究对小鼠肺组织荷菌量检测结果显示,与单纯感染MTB相比较,同时给予PPARγ激动剂,小鼠肺组织荷菌量明显升高,PPARγ拮抗剂则可降低肺组织荷菌量。相关性分析结果显示,各组小鼠肺组织PPARγ表达与荷菌量呈正相关,也从另一个角度说明了,PPARγ的抑制所致的脂滴耗竭能够增强机体对胞内MTB的清除。
CD36作为一种识别氧化脂质或氧化凋亡蛋白的B型清道夫受体[19],介导脂肪酸转运、吞噬作用和炎症对各种病原体(包括MTB)的反应。MTB感染能够促进巨噬细胞CD36的表达。研究发现,PPARγ介导的脂质积聚与麻风病皮损内巨噬细胞中CD36表达增加呈正相关[20]。氧化型低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)可以通过激活PPARγ诱导CD36表达[21]。本研究结果显示,小鼠肺组织CD36在单纯MTB感染组呈中等表达,而在感染的同时给予PPARγ激动剂罗格列酮,CD36则呈高表达,PPARγ拮抗剂GW9662则降低了CD36表达,证实了CD36表达确实与PPARγ活化有关。正常情况下,体内肺泡巨噬细胞可通过CD36摄取LDL之间的协作来维持胞内脂质的平衡[16]。正是MTB感染上调了PPARγ的表达,导致下游信号CD36对脂质的过度摄取,引起外源性脂质的流入增加,因而导致MTB感染小鼠肺组织脂质水平的变化。可见,MTB感染过程中,PPARγ可通过调节参与脂质吸收的CD36表达,促进细胞内脂质的积累[22],但并不排除PPARγ介导的脂质积聚还与其他清道夫受体,如巨噬细胞清道夫受体(macrophage scavenger receptor,MSR)、具有胶原结构的巨噬细胞受体(macrophage receptor with collagenousstructure,MARCO)等表达有关。
近年来有研究发现,结核分枝杆菌依赖机体的脂类来决定其存活或增殖,因此其感染后诱导的机体脂代谢下调是该病原菌致病的主要特点。血液中脂质水平的降低被认为会加速肺部疾病的发展,而且是传染病的主要危险因素[23-25]。本研究检测血浆TC、TG、LDL-C和HDL-C浓度,结果显示PPARγ表达增加或其活化反而降低血脂水平,与PPARγ活化致肺组织脂质增加相反。有理论认为MTB感染产生过氧化作用,可能导致血脂浓度降低和组织炎症[23]。此外,CD36能够参与和增加对外源性脂质的摄取[26],推测血脂降低与PPARγ诱导的CD36表达亦存在一定的关系。
宿主脂质在MTB细胞壁和胞内内含物中积累是MTB维持毒力所必需的[27]。本实验通过对肺组织病理学观察显示,MTB感染过程中,PPARγ活化会导致肺组织出现更严重的病理损伤,而这种损伤伴随着组织中脂滴的积聚,细菌数量的增加以及系统性血清脂质的损耗。因而脂质代谢异常对MTB感染和疾病进展具有一定的促进作用。
总之,本研究探讨了PPARγ通过CD36途径在MTB感染小鼠脂质代谢中的作用,阐明了MTB诱导的PPARγ表达所导致的脂质聚集能够影响宿主对细菌的清除[28],有助于MTB在体内的存活和复制,这对MTB来说是一种逃逸宿主免疫反应的机制。从而提示PPARγ和CD36作为脂质代谢的关键调节因子,有望成为遏制结核病进展的候选靶标。
- 中国病理生理杂志的其它文章
- ERK信号通路介导的EP300过表达在苯肾上腺素诱导小鼠心肌细胞肥大中的作用*
- 益肾通络方对大鼠勃起功能障碍及NO-cGMP通路的影响*
- 静脉注射SCAD重组腺病毒减轻自发性高血压大鼠心肌肥厚和纤维化*
- Thioredoxin-interacting protein contributesto cardiac fibrosisby elevating oxidative stress in cardiac fibroblasts*
- 延髓头端腹内侧部NADPH氧化酶2激活导致活性氧簇释放在皮肤/肌肉切开和牵拉引起的慢性术后疼痛中的作用*
- 干扰海马spastin表达通过抑制突触传递介导小鼠认知功能障碍*

