重症颅脑损伤患者血清微小RNA-126、血管细胞黏附分子-1与迟发性颅内血肿的关系
王 霞 刘 琴 周泽华 刘国平 孟光荣 孟小鹏
颅脑损伤(Craniocerebral Injury,CI)是神经外科常见的一种创伤性疾病,重症CI患者易发生迟发性颅内血肿(Delayed Traumatic Intracranial Hematoma,DTIH),对重症CI患者的生命安全及生存质量构成极度威胁[1]。目前CI并发DTIH发生机制尚无定论,因此,寻找CI并发DTIH的相关因素,对CI并发DTIH具有一定临床指导意义。有研究发现CI发生后,患者外周血中微小RNA(MicroRNA,miRNA)存在异常表达,且CI患者脑组织常伴有缺血缺氧或脑血管自身调节功能障碍,易引发DTIH[2,3]。微小RNA-126(MicroRNA-126,miR-126)在脊髓损伤后表达下调,可影响血管生成和炎症反应过程,进而在脊髓损伤中发挥重要作用[4]。血管细胞黏附分子-1(Vascular Cell Adhesion Molecule-1,VCAM-1)与脑损伤继发性脑损害的炎症反应有关,其在重度CI患者呈高表达,经重组人促红细胞生成素治疗后,VCAM-1表达水平降低,VCAM-1有望成为重度CI患者康复指标[5]。但miR-126和VCAM-1在重症CI并发DTIH患者血清中的表达情况鲜有报道。基于此,本研究初步探究miR-126、VCAM-1在CI患者、CI并发DTIH患者血清中的表达水平,分析两者与CI患者并发DTIH的关系,以期为临床早期防治CI并发DTIH提供依据。
1 资料与方法
1.1 研究对象和分组
选择2015-03-2019-02本院收诊的重症CI患者289例,所有患者诊断均符合《现代颅脑损伤学》重症CI的相关标准[7]。参考文献[8]进行DTIH判定。依据是否发生DTIH,将患者分为DTIH组(102例)和非DTIH组(187例);DTIH组中男62例,女40例;年龄31-62岁,平均年龄(46.64±10.81)岁。非DTIH组中男95例,女92例;年龄30-61岁,平均年龄(45.96±10.72)岁。选取本院同时间段内135例体检健康者为对照组,其中男69例,女66例;年龄30-63岁,平均年龄(46.25±10.77)岁。三组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2 病例纳入和排除标准
纳入标准:(1)经头颅螺旋CT确诊为重症CI者或重症CI并发DTIH;(2)所有患者入院进行格拉斯哥昏迷评分(Glasgow Coma Scale,GCS),GCS范围为3-8分;(3)患者受伤至入院时间<24h;(4)所有受试者家属自愿参与该项研究,且中途未退出。排除标准:(1)合并严重四肢、胸、腹损伤者;(2)合并近期手术、急/慢性感染、凝血功能障碍或免疫系统疾病者;(3)合并脏器功能衰竭、恶性肿瘤者;(4)近期接受心肺复苏、抗凝治疗者。
所有受试者家属签署知情同意书,且本研究获得本院伦理委员会批准,研究所用方法符合《赫尔辛基宣言》。
1.3 主要试剂与方法
TRIzol试剂(货号:GMS12279)购买于上海杰美基因医药科技有限公司,Transcriptor One-Step RT-PCR Kit(货号:04655877001)购买于上海易汇生物科技有限公司,TaqMan Human MicroRNA Assay(货号:4398965)购买于上海恪敏生物科技有限公司,Taqman Universal master mix(货号:4347166)购买于上海宾智生物科技有限公司。引物购买于上海基康生物技术有限公司,各引物序列见表1。紫外分光光度计(型号:DU-800)购买于上海智岩科学仪器有限公司,实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)仪(型号:SimpliAmp)购买于赛默飞世尔科技。

表1 引物序列
1.4 观察指标和方法
1.4.1一般临床资料收集:收集患者性别、年龄,入院时收缩压、舒张压、血浆凝血酶原时间、GCS评分等临床基本资料。
1.4.2qRT-PCR法检测血清中miR-126、VCAM-1、VEGF、TNF-α表达水平:收集所有研究对象入院空腹外周血6-7ml,室温自然凝集30min,4℃、3 500g/min离心12min,收集上层血清,分装于无RNA酶冻存管中,保存于-80℃冰箱中,待样本集齐后集中检测。检测前取出冻存于-80℃冰箱中的血清样本,冰上解冻,无菌环境下,根据TRIzol试剂说明书抽提所有血清样本总RNA,测定RNA纯度及浓度,并验证RNA完整性。参照逆转录试剂盒说明书,应用Transcriptor One-Step RT-PCR Kit合成cDNA。按照TaqMan Human MicroRNA Assay、Taqman Universal master mix说明书流程将所得cDNA进行扩增、PCR检测血清miR-126、VCAM-1、血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)、肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)相对表达水平。miR-126以U6为内参,VCAM-1、VEGF、TNF-α以GAPDH为内参,采用2-ΔΔCt法计算miR-126、VCAM-1、VEGF、TNF-α相对表达量。
1.5 统计学处理

2 结 果
2.1 各组基本临床指标比较
对照组、非DTIH组和DTIH组三组间收缩压、舒张压差异无统计学差异(P>0.05),血浆凝血酶原时间差异有统计学意义(P<0.05);与非DTIH组相比,DTIH组患者血浆凝血酶原时间明显延长(P<0.01),GCS评分明显升高(P<0.01)。详见表2。

表2 各组基本资料比较
2.2 各组血清miR-126、VCAM-1、VEGF、TNF-α表达水平比较
各组血清miR-126、VCAM-1、VEGF、TNF-α表达水平差异有统计学意义(P均<0.01)。与对照组相比,非DTIH组、DTIH组血清miR-126表达水平明显降低,VCAM-1、VEGF、TNF-α表达水平均明显升高(t均>4.793,P均<0.01);与非DTIH组相比,DTIH组血清miR-126表达水平明显降低,VCAM-1、VEGF、TNF-α表达水平均明显升高(t均>11.528,P均<0.01)。详见表3。

表3 各组血清miR-126、VCAM-1、VEGF、TNF-α表达水平比较
2.3 重症CI并发DTIH患者血清miR-126、VCAM-1、VEGF、TNF-α水平的相关性
Pearson法分析显示,重症CI并发DTIH患者血清miR-126表达水平与VEGF、TNF-α、VCAM-1均呈负相关(r=-0.489、-0.375、-0.575,P均<0.01),VCAM-1与VEGF、TNF-α均呈正相关(r=0.360、0.418,P均<0.01)。
2.4 Logistic回归分析重症CI并发DTIH的影响因素
以重症CI并发DTIH为因变量,以血浆凝血酶原时间、GCS评分、miR-126、VCAM-1、VEGF、TNF-α为自变量,进行Logistic回归分析,结果显示血浆凝血酶原时间、VCAM-1、VEGF、TNF-α为重症CI并发DTIH的独立危险因素(P<0.01),miR-126为重症CI并发DTIH的独立保护因素(P<0.01)。详见表4。
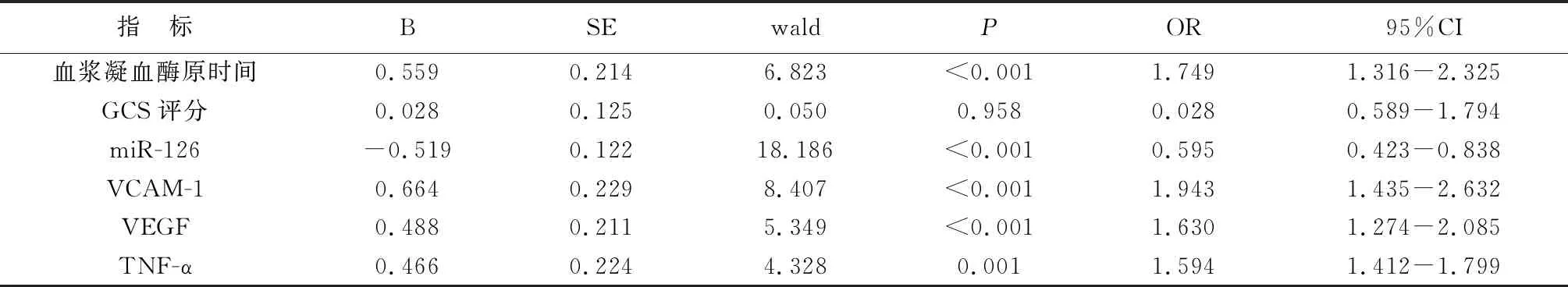
表4 重症CI并发DTIH的Logistic回归分析
3 讨 论
CI可引发脑组织水肿、脑梗死、DTIH等继发性CI,具有较高致残率和致死率,严重威胁患者生活质量及生命[8]。因此,寻找有效评估CI并发DTIH指标,对CI患者进行实时监控,及时防治DTIH,可有效提高CI患者生存率。
miRNA可在机体代谢、个体发育、信号转导、炎症反应、血管生成等生理病理过程中起重要生物调节作用[9]。miRNA在脑梗死、脑水肿、CI、DTIH等疾病中表达异常,可作为缺血缺氧脑损伤相关疾病的诊治靶标[10]。miR-191在急性缺血脑卒中表达异常,其可通过靶向血管内皮锌指蛋白1抑制血管生成,进而在缺血性脑损伤中发挥重要调节作用,miR-191可作为诊治急性缺血脑卒中的生物靶标[11]。Di等[12]研究显示,miR-425-5p在CI患者中异常表达,其可用于CI病情判断及预后评估。以上研究证实,miRNA表达失调与脑损伤类疾病发生发展密切相关。miR-126与血管生成、血管炎症有关,在脑出血患者血清中呈低水平,且其成员miR-126-3p可缓解脑出血后引起的血脑屏障破坏、神经元损伤及脑水肿,miR-126及miR-126-3p在脑损伤疾病发展过程中起重要作用[13]。miR-126可促进血管重塑,减少纤维化,缺血性脑卒中患者miR-126表达下调,其miR-126与脑卒中发病关系密切[14]。本研究中DTIH组患者血清miR-126表达水平明显低于非DTIH组和对照组,提示低miR-126水平可能参与并影响重症CI并发DTIH的进程。推测miR-126表达下降可能会加重患者血管纤维化和炎症反应,从而增加重症CI并发DTIH的发病率,影响预后。VCAM-1是血清黏附分子,可介导血管内皮细胞黏附,影响血管壁完整性及组织缺氧引发的炎症反应,VCAM-1在老年急性脑梗死患者中表达失调,与急性脑梗死发病有关[15]。局灶性脑缺血损伤患者VCAM-1表达水平升高,经西洋参茎叶总皂苷治疗后,其表达水平降低,炎症和脑水肿减轻,提示VCAM-1可能在局灶性脑缺血损伤发展过程中发挥重要作用[16]。以上研究表明,VCAM-1可能与缺血性脑病炎症反应过程有关。本研究中DTIH组患者血清VCAM-1水平均明显高于非DTIH组和对照组,提示高表达VCAM-1在重症CI并发DTIH疾病发生发展中起一定作用,推测高表达VCAM-1可能会加剧患者炎症反应,进而影响重症CI并发DTIH的发展。
VEGF是具有促进内皮细胞增殖、增加血管通透性、诱导血管生成等生物学功能的多功能细胞因子,对颅内血管内膜损伤异常敏感,VEGF在发生创伤性脑损伤后异常表达,与脑损伤发展过程密切相关[17]。TNF-α是机体免疫应答及炎症反应的重要调节因子,其在急性CI中表达升高,CI发生后TNF-α可能激活水通道蛋白4,引起严重脑水肿,使脑组织严重缺血缺氧,TNF-α有助于评估CI严重程度[18]。本研究显示,DTIH组患者血清VEGF、TNF-α表达水平明显高于非DTIH组和对照组,提示VEGF、TNF-α可能与重症CI并发DTIH发展过程相关。其原因可能是VEGF具有改变血管通透性、影响内皮细胞增长及血管新生的作用,而TNF-α可调节免疫应答及炎症反应,二者共同影响DTIH的发生和发展。
本研究中重症CI并发DTIH患者血清miR-126表达水平与VEGF、TNF-α、VCAM-1均呈负相关,VCAM-1与VEGF、TNF-α均呈正相关,提示miR-126、VEGF、TNF-α与VCAM-1相互作用,从而共同影响重症CI并发DTIH进展。进一步研究发现血浆凝血酶原时间、VCAM-1、VEGF、TNF-α是重症CI并发DTIH的独立危险因素,miR-126是重症CI并发DTIH的独立保护因素,提示血浆凝血酶原时间延长,VCAM-1、VEGF、TNF-α水平升高,miR-126水平降低,均可能增加重症CI并发DTIH的几率,实时监测重症CI患者血浆凝血酶原时间、miR-126、VEGF、TNF-α及VCAM-1水平,有助于早期评估重症CI并发DTIH的几率并及时控制疾病发展。
综上所述,重症CI并发DTIH患者血清miR-126低表达,VCAM-1高表达,miR-126、VCAM-1均可能是影响重症CI并发DTIH的影响因素,两者参与并影响重症CI并发DTIH进程。但本研究样本量较少,实验结果可能会出现偏倚,后续将扩大样本量进一步研究。
◀

