生物传感器在食源性致病菌大肠杆菌O157∶H7检测中的应用进展
白小莲, 爱军
内蒙古师范大学化学与环境科学学院,内蒙古自治区绿色催化重点实验室,呼和浩特 010022
近年来,预防食源性致病菌污染的安全问题已成为当今世界性的公共卫生热点。可引发食源性疾病的微生物种类繁多,其中,沙门氏菌、肠出血性大肠杆菌O157∶H7、金黄色葡葡萄球菌、单增李斯特菌、副溶血性弧菌是引发食物中毒的主要致病菌,严重威胁着人类的健康[1]。其中,肠出血性大肠杆菌O157∶H7是引发人类出血性结肠炎、溶血性尿毒症、血栓性血小板减少性紫癜等疾病的一种致病因素[2]。受动物粪便污染的食物和水是大肠杆菌O157∶H7的主要来源,大肠杆菌O157∶H7的低剂量和高毒力往往使感染严重,危及生命,特别是对幼儿、老年人和免疫系统减弱的人[3]。自美国1982年首次爆发流行以来,世界上许多国家均相继发生了大肠杆菌O157∶H7的感染流行,其中发病较多的国家主要有美国、加拿大和日本等[4-7];我国自1986年首次报告大肠杆菌O157∶H7的感染病例以来,已先后有十几个省市发现大肠杆菌O157∶H7感染的散发病例,存在潜在的流行威胁[8-9]。大肠杆菌O157∶H7感染具有高流行性、高发病率与病死率,因而受到国内外研究人员和世界各国卫生组织的广泛关注。
开展致病菌的检测是保障食品安全和公共卫生的重要手段。由此可见,只有对大肠杆菌O157∶H7进行及时的检测和预防才能够有效的避免大肠杆菌O157∶H7的感染,进而有效保障人们的健康。大肠杆菌O157∶H7中O是指O抗原,也就是体系细胞抗原,指包埋在细菌细胞壁中的脂多糖类;H是指H抗原,也称之为鞭毛抗原,属于蛋白质类,因其结构具有免疫能力。除常见的两类抗原之外,还有K抗原、指荚膜抗原,大部分是多糖;还有M抗原,类似于粘蛋白、多糖类。主要通过这4类不同抗原类型来进行血清学上的分类来分析大肠杆菌[10]。大肠杆菌O157∶H7检测方法相对丰富,主要方法包括传统分离鉴定法、分子生物学法和免疫学法等,但是它们在使用上仍然存在耗时长、特异选择性薄弱、灵敏度低等不确定性因素。随着生物技术的发展,生物传感器逐渐进入研究人员的视野。生物传感器是一种对生物物质敏感并将其浓度转换为电信号进行检测的仪器,是由固定化的生物敏感材料作为识别元件(包括酶、抗体、抗原、微生物、细胞、组织、核酸等生物活性物质)、适当的理化换能器(如氧电极、光敏管、场效应管和压电晶体等)及信号放大装置构成的分析工具或系统,具有接受器与转换器的功能[11]。生物传感器在致病菌检测技术领域因具有效率高、特异性强等优点而取得了长远的发展。基于此,本文对大肠杆菌O157∶H7的检测方法及其演变进行了梳理和比较分析,并着重综述了生物传感器在大肠杆菌O157∶H7检测中的应用进展,以期为大肠杆菌O157∶H7快速、准确和可商业化的检测方法的研发提供参考。
1 大肠杆菌O157∶H7的检测方法及其演变
对于大肠杆菌O157∶H7的检测技术,从最传统的发酵法和滤膜法到当下结合各类生物技术的检测方法离不开研究人员的不断改进[12],在此总结了大肠杆菌O157∶H7检测技术的发展历程(图1)。

图1 大肠杆菌O157∶H7检测技术发展
传统的检测方法所面临的问题有耗时长、灵敏度低以及特异性、选择性薄弱等不充分的因素,近年来,在传统检测方法的基础上研究出了更为准确、快速的免疫学检测技术,包括酶联免疫分析法、免疫磁珠分离体检测技术、双功能抗体检测技术、胶体金检测技术等[13],PCR技术也在大肠杆菌的检测领域受到青睐和认可,从常规PCR优化逐步地发展到荧光定量PCR、多重PCR、基因重组系列PCR等[14]。但是,目前的主流检测依旧是传统的培养分离鉴定的方法。表1对近年来常用方法的原理、优缺点等进行了比较分析。
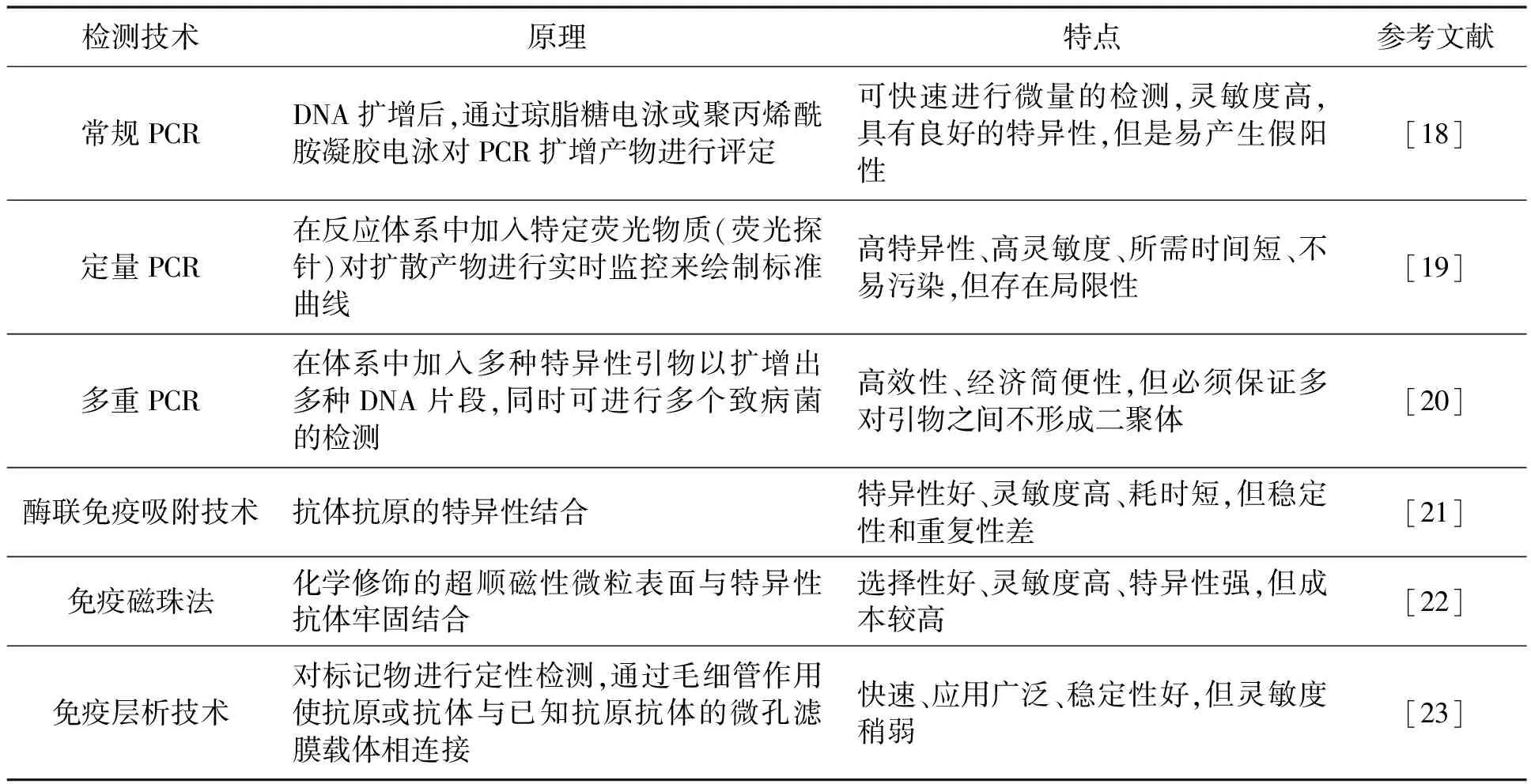
表1 大肠杆菌O157∶H7常用检测分法分析
生物传感器在致病菌检测技术领域因具有高效、特异、结构小巧、经济实用等诸多优点取得了长远的发展。基于免疫识别的生物传感器可快速检测大肠杆菌O157∶H7,主要包括两类检测方法:一类是免标记生物传感器直接检测,另一类是带标记生物传感器间接检测[15]。此外,近年来,核酸适配也被广泛用于生物传感器探针分子检测[16-17]。因优势突出,生物传感器在大肠杆菌O157∶H7检测中发挥着日益重要的作用。
2 生物传感器在检测大肠杆菌O157∶H7中的应用进展
近年来,生物传感器技术依托于自身经济实用、结构小巧、特异性强及高效便捷等优势在致病菌菌株检测方面取得了巨大的进步[24-26],已经成为一种备受大众认可的通用分析工具。生物传感器技术原理在于制备或选择出可与待测物特异性结合的适配体作为识别原件,然后选择一类纳米粒子作为信号转导元件相结合,形成适配体生物传感器[27]。通常习惯以转换平台为基础进行分类,将其分成表面增强拉曼、荧光、比色、光学、电化学、试纸条六大类(图2)[28]。总体来看,生物传感器技术在大肠杆菌O157∶H7检测中的应用经历了由点至面的过程,从小范围应用向大范围应用不断扩展。随着生物传感器技术的不断更新,其在大肠杆菌O157∶H7检测方面发挥了日益重要的作用。

图2 病原体检测常用传感器示意图[28]
2.1 表面增强拉曼散射传感器
表面增强拉曼散射(surface enhanced Raman scattering, SERS)主要是通过与粗糙金属表面的相互作用,使信号分子放大分析容性以及SERS检测所具有的独特的物理、化学和光学性质,可通过修改结构组成、表面和颗粒大小提高表面增强拉曼散射强度。如利用适体和纳米粒子结合表面增强拉曼散射来识别大肠杆菌O157∶H7。最开始运用的传统连接法有物理吸附,虽然简单有效但是吸附适体不稳定,容易发生非特异性位移导致假阳性结果[29-30]。另一种方法是共价结合,将带有硫醇、氨基和其他基团的适体共价连接到纳米粒子的表面,不过该方法费用高,而且一旦遇到更具竞争性的试剂结合基团就可能被去除[31-32]。后来,随着需求的推动和技术的发展,开始尝试用嵌入连接法改善上述问题,有效弥补了传统连接法的不足。
在SERS传感器中,金纳米骨增强超灵敏表面增强拉曼散射适配传感器出现的时间较早。研究表明,将适配体Apt-1和雷达归航信标嵌入金纳米棒(gold nanorods,GNRs)表面,最后形成一种具有识别能力、信号稳定的再生长金纳米骨NBs(GNRsApt-1+RhB)(Apt-1和Apt-2序列见表2)[29]。该传感器是通过假设由适配传感器和信号分子组成的核酸分子可以被开发成具有可控性的表面形态,而提高信号强度和稳定性。

表2 Apt-1和Apt-2序列和作用
利用开发的金纳米骨SERS传感器来检测大肠杆菌O157∶H7的主要过程为(图3):先在磁性纳米粒子上加入适配体Apt-2形成捕获探针,而后加入需检测的大肠杆菌O157∶H7,再加入上述所得信号探针,其信号探针内适配体Apt-1的作用是为了保证高稳定性、高识别性以及增强拉曼散射信号强度。在有磁场的情况下,用SERS观察1 350 cm-1处的表面增强拉曼散射信号强度。1 350 cm-1处的拉曼信号强度和大肠杆菌浓度的对数存在线性关系(y=180.30x-61.49,R2=0.998 2),大肠杆菌浓度范围为10~10 000 cfu·mL-1,检出限(limit of detection,LOD)为3 cfu·mL-1。在完成实际样品的回收试验后,用实际饮用水和莴苣样品评价了开发的适体传感器的准确性和实际应用情况。其相对标准偏差(relative standard deviation,RSD)不超过5.2,样品回收率为96.95%~105.88%,适体传感器的LOD、信号稳定性、检测时间和回收率证实了其优良的定量检测性能[33]。提示开发的适体传感器SERS平台在食品安全、环境监测和危害分析应用方面有着广阔的前景。

图3 金纳米骨适体传感器检测大肠杆菌O157∶H7的示意图[33]
2.2 荧光传感器
荧光传感器可以把生物检测以电化学信号变化来显示出来,并实现对生物、化学信息的定量分析。以碳纳米复合材料为基础的新型荧光传感器能够有效检测牛奶中大肠杆菌O157∶H7。通过氧化还原反应形成基于羰基铁粉(carbonyl iron powder,CIP)和多壁碳纳米管(multi-walled carbon nanotubes,MWCNT)的磁韧带。在酸性溶液中,CIP与H+反应生成正电荷Fe2+,在反相电荷的吸引下,带负电荷的MWCNT会与CIP颗粒结合,形成磁性纳米复合物,吸附在纳米粒子表面。由于π叠加作用,6-羧基荧光素(6-carboxy fluorescein group, FAM)标记的适配体会随机包裹在CIP@MWCNT的侧壁上,而FAM分子接近CIP@MWCNT,有效地在大肠杆菌O157∶H7猝灭了染料的荧光,适配体离开CIP@MWCNT的侧壁。因为适配体对大肠杆菌O157∶H7的亲和力和特异性高于CIP@MWCNT,所以荧光被关闭时,适配体仍然吸附在CIP@MWCNT上[34]。图4体现了基于CIP@MWCNT的Advanced Packaging Tool(服务器系统)传感器上大肠杆菌O157∶H7的分析过程[35]。
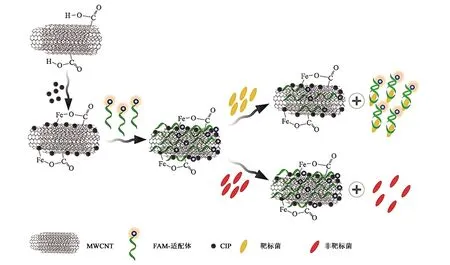
图4 基于CIP@MWCNT的检测大肠杆菌O157∶H7的传感器示意图[35]
反应式:
CIP-Fe + H+→ CIP-Fe2+
MWCNT-COOH → MWCNT-COO-+ H+
CIP-Fe2++ MWCNT-COO-→ MWCNT-COOFe-CIP
开发的基于CIP@MWCNT的荧光检测传感器可成功地应用于污染样品基质中大肠杆菌O157∶H7的诊断。在制备的适体传感器下大肠杆菌O157∶H7的浓度可达到7.15×103cfu·mL-1。此外,根据性能分析,这种新型磁性纳米复合材料修饰的适体传感器具有可靠和稳定的靶向能力[34]。基于CIP@MWCNT的适体传感器在实际样品中能快速、灵敏地检测大肠杆菌O157∶H7,具有广阔的应用前景。在未来,预计这种开发的适体传感器将用于监测真实样品中多种类型的食源性病原体。
2.3 比色传感器
比色传感器具备直观读出结果、使用方便、操作简单等优点,在检测大肠杆菌O157∶H7领域中备受关注[36]。其主要原理是将目标信号转化为颜色变化的过程,显色底物和催化酶的选择是比色法的关键。
在Wen等[37]成功组装了适体传感器后,比色传感器检测大肠杆菌的性能得到了质的提升。大肠杆菌O157∶H7与适体在囊泡界面的分子识别,导致聚二乙炔(polydiacetylene,PDA)的蓝-红转变,这种转变肉眼很容易看到,检测原理见图5。在研究中,用共聚焦激光扫描显微镜和透射电镜证实了截短适体与大肠杆菌O157∶H7的特异性相互作用。电容器可在2 h内检测到104~108cfu·mL-1的细胞浓度,大肠杆菌O157∶H7的相应检出率为98.5%[37]。

图5 比色传感器检测大肠杆菌O157∶H7的原理[37]
2.4 化学发光传感器
化学发光为物质在进行某些化学反应时伴随产生的光辐射现象。目前常见的化学发光适配体传感器(chemiluminescence aptasensor)是在体系中引入相关元件进行发光反应,或是在核酸适配体上标记化学发光因子[38]。此类传感器具有重复利用率高、灵敏度强等特点,正因如此,检测大肠杆菌时往往会用到化学发光传感器。
为了提升化学传感器在检测大肠杆菌当中的性能与作用,Khang等[39]实现了技术上的突破,极大的提高了样品中大肠杆菌O157∶H7的检测效果,缩短了定量样品中大肠杆菌O157∶H7所用的时间。大肠杆菌O157∶H7适体结合的FAM具有良好的特异性,当混合物在37 ℃下培养1 h时,能捕获样品中的大肠杆菌O157∶H7。根据游离适体与GO/铁纳米复合物π-π堆积相互作用的原理,用GO/铁纳米复合物去除培养后残留在样品中的游离大肠杆菌O157∶H7适体。当样品中加入鸟嘌呤化学发光试剂时,样品中与适体FAM结合的大肠杆菌O157∶H7会发出强光。随着大肠杆菌O157∶H7浓度的增加,鸟嘌呤化学发光反应的发光强度成比例增加。总体来看,此大肠杆菌O157∶H7生物传感器的LOD低至4.5 cfu·mL-1,具有良好的准确度、精密度和重现性,有望在食品安全和公共卫生领域得到应用。
2.5 电化学传感器
电化学适体传感器制备时,会将电化学活性信号传导元件和核酸适配体结合固定在电极表面,所测试靶标存在时,会与核酸适配体特异性结合,导致电极表面变化,通过检测变化的电化学信号实现对大肠杆菌的定性或定量检测。
在电化学适体传感器方面,Wang等[40]开发出了一种基于磁性纳米粒子同轴毛细管、脲酶催化和多氯联苯(polychlorinated biphenyls,PCBs)电极的电化学传感器,用于快速、灵敏地检测大肠杆菌O157∶H7。利用免疫磁性纳米粒子(magnetic nanoparticles, MNPs)的同轴毛细管实现目标细菌的特异性分离,脲酶与尿素放大阻抗信号,PCB金电极测量阻抗变化。将链霉亲和素修饰的MNPs与生物素化的多克隆抗体(polyclonal antibodies,PAbs)偶联形成免疫MNPs,并用高梯度磁场将其捕获在同轴毛细管中,将细菌从大量样品中分离出来。然后,用抗大肠杆菌和脲酶的适体修饰GNPs,将其注入毛细管与细菌反应,形成MNP-PAb-细菌适体-GNP-脲酶复合物[34]。最后,利用化合物上的脲酶催化尿素水解为毛细管中的铵离子和碳酸盐离子,导致过氧化氢的阻抗降低,用镀金PCB电极测量。过氧化氢的阻抗变化与细菌的浓度呈良好的线性关系。该传感器能在3 h内检测低至10 cfu·mL-1的大肠杆菌,在牛奶中大肠杆菌的平均回收率为99%。由此可见,该传感器具有检测时间短、灵敏度高、成本低等优点,有不错的应用前景。
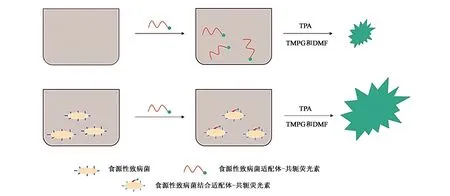
图6 发光传感器检测大肠杆菌O157∶H7的原理[39]
图7 电化学传感器快速检测大肠杆菌的原理[40]
2.6 侧流传感器
侧向流生物传感器是将侧向流动型试纸与核酸适配体相结合的技术,靶标菌与适配体结合形成复合物后进行扩增,扩增产物加入侧向流试纸后会进行可视化信号输出[23]。该技术整合了Linux From Scratch和适配体在分子检测领域的优势,方便携带、操作简单,也可直观的快速检测,但无法进行准确的定量分析[28]。在横向血流免疫分析法(lateral flow immunoassay,LFIA)中使用的常用测试条由样品、共轭垫和吸收垫以及膜组成。金纳米粒子(AuNPs;标记剂)和抗体(识别元件)是试纸法中最重要的成分,如图8所示。三明治格式是LFIA中使用最多的系统,在夹心LFIA中,一种抗体固定在膜上,另一种识别不同表位的抗体用AuNPs标记。在2种抗体之间捕获分析物[41]。去年Wang等[42]报道了一种基于纳米酶细菌抗体的快速检测多读出和无标签的LFIA。这种无标签的LFIA可以在西瓜汁、牛奶和卷心菜沙拉中的102 cfu·mL-1的低检测极限下表现出优异的检测性能,检测范围为102~108 cfu·mL-1。

图8 侧流适体传感器检测大肠杆菌的原理[41]
3 展望
随着卫生事业、医学事业、科学事业的发展以及人民生活水平的提升,食源性致病菌污染问题备受重视。要想切实保障人民的健康,就必须对大肠杆菌O157∶H7进行及时检测和有效预防。兼具接受器与转换器双重功能的生物传感器对于监测大肠杆菌O157∶H7有重要意义。
大肠杆菌O157∶H7的检测方法随着时间的推移在不断完善,监测朝着科技化、精准化、快速化的方向逐渐演变;生物传感器在大肠杆菌检测中的应用经历了范围由小至大、深度由浅入深、效果由一般到逐渐理想化的转变。简而言之,生物传感器技术在检测大肠杆菌当中的应用经历了由点至面的过程,从小范围应用向大范围应用不断扩展,在生物传感器技术不断发展的过程中,其在检测大肠杆菌方面发挥了日益重要的作用。
就目前来看,生物传感器在大肠杆菌检测中的应用会继续朝着科技化方向发展,或许生物传感器会同当下流行的人工智能技术、信息技术良好结合,从而提高检测的精准度、加快检测的速度、进一步提高升检测的准确度。进而开发的方法可以应用于检测其他食源性病原体,如沙门氏菌、李氏菌和弧菌等。期望将来能够开发一种先进的生物传感器,能够同时监测存在于样本中的多种食源性病原体。

