连翘酯苷A通过TLR4/NF-κB抑制PC12细胞低氧/再复氧诱导的炎症反应
马忠英,张 迪,孙 金,牛 静,任 茜,武倩雯,王婧雯
脑缺血引起的神经元坏死和活性氧释放触发炎症级联反应,同时,血脑屏障受损,过量的免疫细胞进入脑组织,与脑内固有免疫相互作用,放大炎症反应,加重脑损伤。炎症反应贯穿脑损伤的发生发展过程,调节炎症反应,将有可能减轻脑损伤程度。连翘具有清热、抗炎等功效,连翘酯苷A(forsythoside A,FA)是其主要成分之一。FA可抑制低糖低血清、谷氨酸和Aβ25-35诱导的神经细胞损伤,此外, FA表现出很好的抗炎效果。PC12细胞是大鼠肾上腺髓质嗜铬细胞,具有典型的神经细胞特征,广泛应用于神经疾病模型研究。该研究拟在前期基础上,进一步研究FA对氧糖剥夺/再灌注(oxygen and glucose deprivation/reperfusion,OGD/R)引起的PC12细胞损伤的作用,并阐明作用机制。
1 材料与方法
1.1 材料
1.1.1
药品和试剂FA(纯度>98%)购自北京索莱宝科技有限公司;细胞培养用胎牛血清(Fetal bovine serum,FBS)、DMEM培养基和胰蛋白酶购自美国GIBICO公司;白细胞介素(interleukin,IL)-1β、肿瘤坏死因子-α(tumor necrosis factor - alpha,TNF-α)和IL-6购自上海碧云天生物有限公司;Toll样受体4 (toll-like receptor-4,TLR4)、I-κB、P-I-κB、核转录因子kappa B (nuclear factor kappa B,NF-kB)、PCNA和GAPDH抗体购自美国Cell signaling 公司;TLR4慢病毒激活颗粒、NF-κB慢病毒激活颗粒和转染试剂均购自美国Santa Cruz公司;其余试剂均是分析纯。
1.1.2 仪器
低温离心机、CO培养箱、低氧小管和全波长酶标仪均购自美国Thermo公司;凝胶电泳系统和化学发光系统购自美国Bio-Rad公司。1.1.3 细胞
大鼠肾上腺嗜铬细胞瘤细胞PC12细胞购自中国科学院上海生命科学研究院细胞资源中心。1.2 细胞培养
细胞采用含10% FBS的DMEM培养基在37 ℃的CO培养箱中培养,每2 d换液1次。细胞融合至90%左右时,用0.25%胰蛋白酶消化细胞,800 r/min离心5 min收集细胞,加入新鲜培养基按1 ∶3进行传代培养。待细胞生长至对数期,收集细胞,根据实验目的接种于96孔板或者6孔板中,进行药物处理和造模。实验分组(n
=6):正常(正常条件培养)、模型(OGD/R)和给药组(1.25、2.5和5 μmol/L,细胞预处理24 h后,进行OGD/R)。FA的给药剂量根据前期MTT实验结果筛选而来。1.3 OGD/R模型
给药组采用FA预处理24 h,然后将含药培养基换成无血清培养液,将培养板放置于含95% N的缺氧小室中,继续培养3 h,低氧结束后,将无血清培养液换成含药培养基,培养6 h,完成再复氧。模型组再灌注时给予正常培养基进行再灌注,正常组采用正常培养基在正常条件下培养。收集各组细胞,根据不同实验目的进行处理。1.4 炎症因子测定
收集细胞培养基上清液,在1 500 r/min,4 ℃条件下离心5 min,按照试剂盒说明书绘制标准曲线,然后测定培养基中IL-1β、TNF-α和IL-6的含量,每个样本设定5个复孔,450 nm测定各孔吸光度值。通过标准曲线计算样品中炎症因子的浓度。1.5 细胞转染
转染试剂采用Lipofectamine 3000进行。选择合适密度细胞接种于6孔板中,培养24 h;用Opti-MEM培养基稀释Lipofectamine 3000,充分混合并标记为1号管;用Opti-MEM培养基稀释质粒制成预混液,充分混合并标记为2号管;1号和2号管混合,充分混匀,室温孵育15 min,制成质粒-脂质体复合物。将复合物滴加入需转染细胞组,继续培养48 h,检测转染效率,进行后续处理。1.6 Western blot
检测 细胞经过不同处理后,收集各组细胞,细胞裂解液在4 ℃裂解20 min,10 000 r/min离心15 min,收集上清液,分装,在-20 ℃冷冻保存。用BCA蛋白含量测定试剂盒测定每组的蛋白质含量。10% SDS-PAGE分离蛋白,湿法转膜至PVDF膜,5%脱脂奶粉封闭60 min后,孵育一抗(TLR4、I-κB、P-I-κB、NF-κB p65、PCNA和GAPDH抗体,1 ∶1 000稀释),4 ℃过夜。洗净一抗后,孵育羊抗兔二抗,60 min,37 ℃。最后,TBST洗净残余二抗后,ECL发光液进行显色,扫描灰度值,计算与正常组的比值。内参蛋白为GAPDH。1.7 统计学处理
数据统计采用Graphpad Prism 9.0进行分析,用表示,各组间的比较采用单因素方差分析检验,以P
<0.05为差异有统计学意义。2 结果
2.1 FA抑制炎症因子水平
如图1所示,正常组与模型组上清液中IL-1β含量比较差异有统计学意义(F
=46.13,P
<0.01)。正常组上清液中TNF-α含量与模型组上清液中IL-1β含量比较差异有统计学意义(F
=70.51,P
<0.01)。正常组上清液中IL-6含量与模型组上清液中IL-1β含量比较差异有统计学意义(F
=10.68,P
<0.01)。这些结果表明OGD/R使PC12细胞产生炎症反应。与模型组比较,FA使细胞上清液中IL-1β、TNF-α和IL-6的含量降低,差异有统计学意义(P
<0.01),并且呈剂量依赖关系,表明FA可抑制OGD/R引起的炎症反应。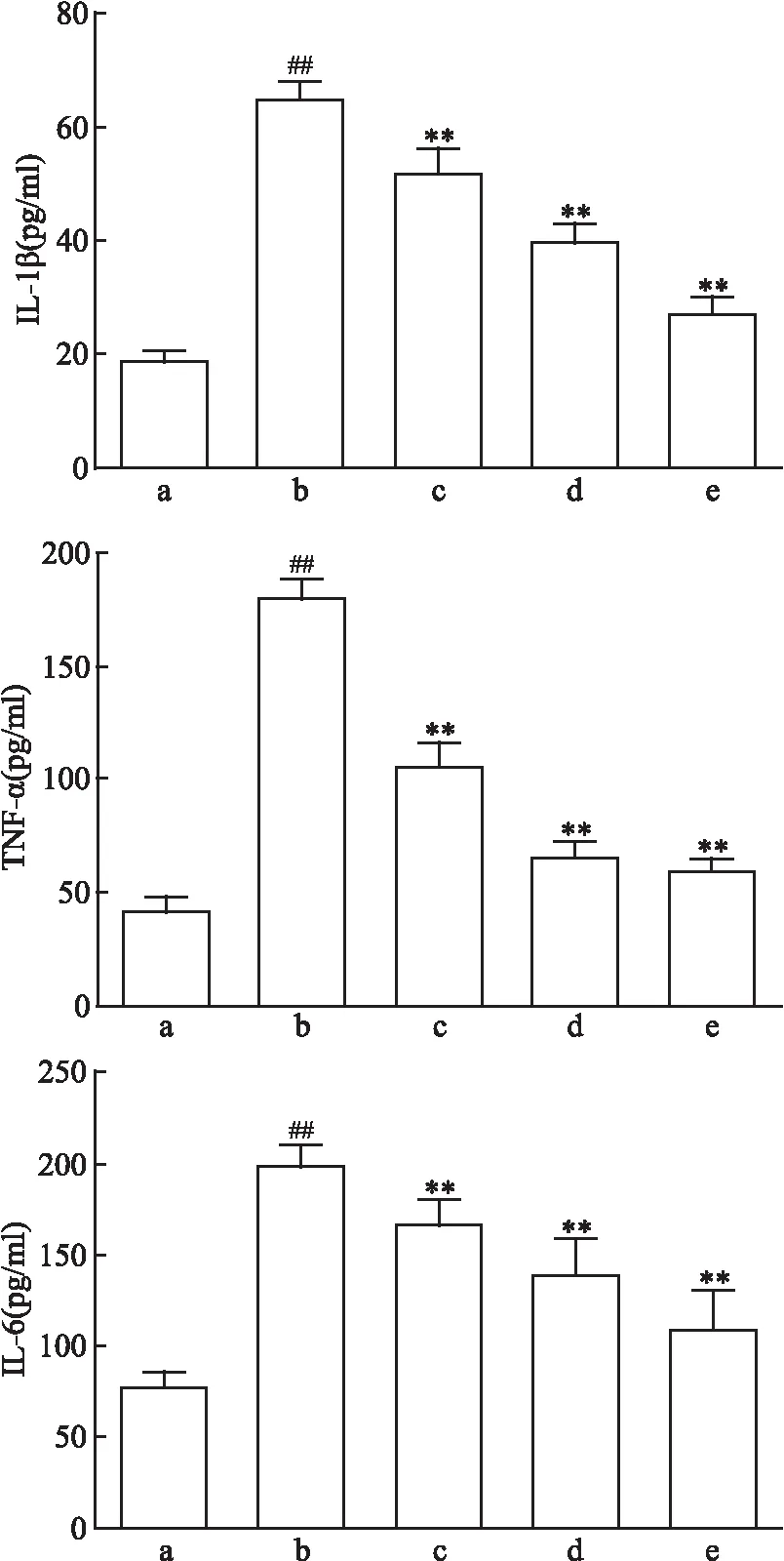
图1 FA对炎症因子水平的影响
2.2 FA对NF-κB核转移的影响
如图2所示,模型组细胞内P-I-κB和NF-κB p65细胞质中表达量均增加,并且与正常组比较差异有统计学意义(F
=58.24,F
=47.67,P
<0.01)。同时,图2B结果显示,模型组细胞的细胞核内NF-κB p65的表达量增加(F
=49.27,P
<0.01),表明OGD/R不仅促进NF-κB p65蛋白表达,还可促进其转移入核。而FA处理组细胞质内P-I-κB和NF-κB p65表达量降低(P
<0.01),同时细胞核内NF-κB p65表达量也减少,并差异有统计学意义(P
<0.01),表明FA可抑制NF-κB p65从细胞质向细胞核转移。2.3 FA通过抑制NF-κB调控炎症反应
为验证FA的抗炎作用是否通过调控NF-κB,采用质粒转染过表达NF-κB。如图3A所示,过表达NF-κB使细胞质和细胞核中NF-κB p65表达量均增加,表明质粒转染成功。如图3B所示,过表达NF-κB后,FA对细胞核中NF-κB p65表达的抑制作用减弱,与FA处理组差异有统计学意义(F
=143.6,P
<0.01)。同时,FA对IL-6的抑制作用被减弱(F
=70.88,P
<0.01),表明FA通过NF-κB发挥抗炎作用。2.4 FA对TLR4蛋白表达的影响
如图4所示,模型组细胞内TLR4蛋白表达量增加,且与正常组比较差异有统计学意义(F
=59.01,P
<0.01),表明OGD/R可以激活细胞内TLR4通路。而FA处理组,TLR4蛋白表达量被抑制,且与模型组比较差异有统计学意义(P
<0.01),表明FA可抑制TLR4的蛋白激活。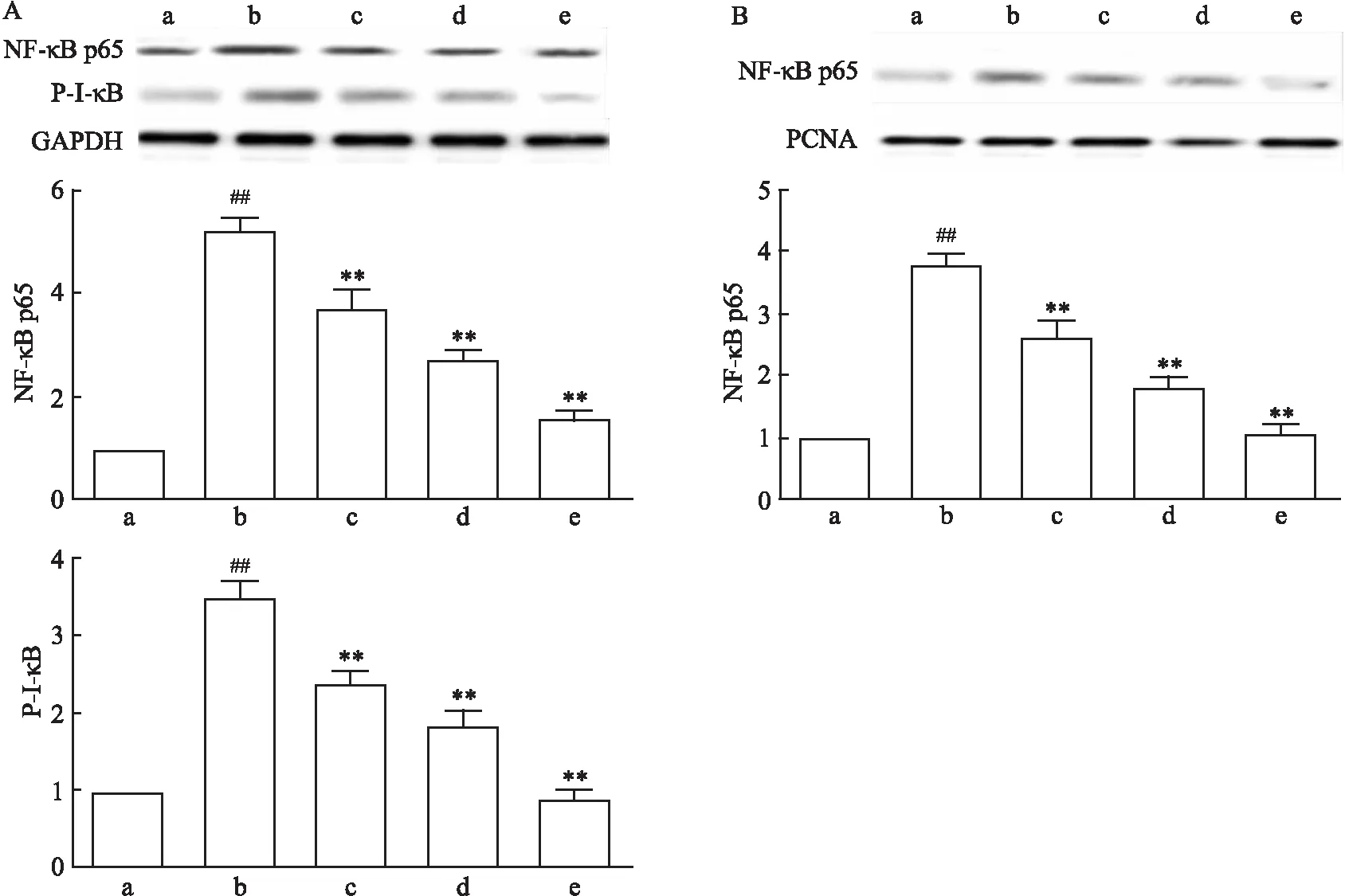
图2 FA对NF-κB表达的影响
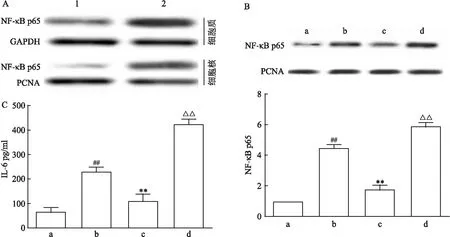
图3 FA通过抑制NF-κB抑制炎症反应
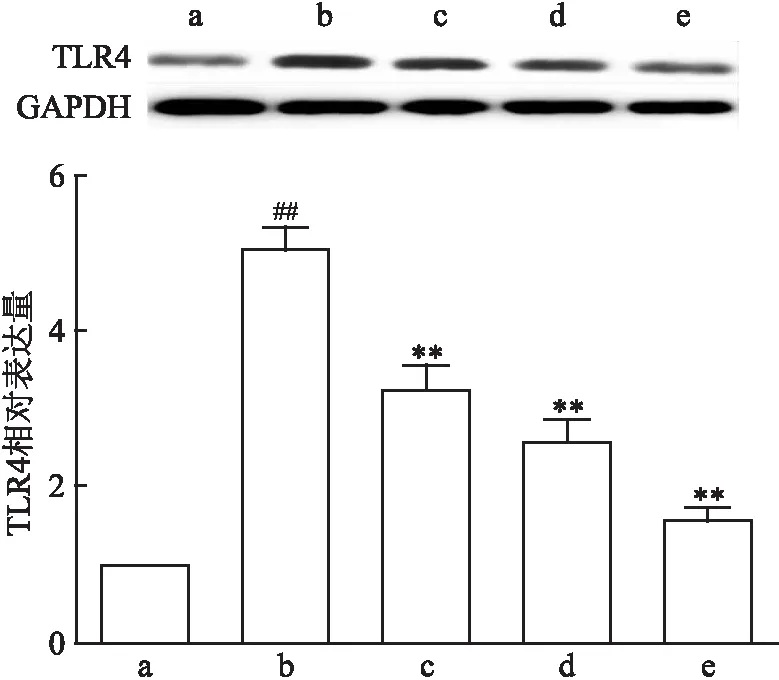
图4 FA对TLR4蛋白表达的影响
2.5 FA通过TLR4调控NF-κB活性
为验证FA是否通过TLR4发挥抗炎作用,采用质粒过表达TLR4。如图5A所示,过表达使TLR4蛋白表达量增加,表明细胞转染成功,同时,课题组还观察到FA可使TLR4表达减少,进一步说明FA对TLR4具有抑制作用。图5B结果显示,与scrb+FA组比较,过表达TLR4组细胞核内NF-κB p65蛋白表达升高(F
=206.5,P
<0.01),表明过表达TLR4使FA对NF-κB的抑制作用减弱。同时,ELISA结果显示(图5C),过表达TLR4使细胞内IL-6含量升高(F
=57.32,P
<0.01),与FA+scrb组比较差异有统计学意义,表明过表达TLR4FA对炎症的抑制作用减弱。3 讨论
炎症反应在脑缺血和再灌注引起的脑损伤过程中具有十分重要的作用,并且影响患者的临床预后。炎症反应还可与其他脑损伤机制(氧化应激、线粒体应激等)交互影响,共同促进脑组织损伤。因此,抑制炎症反应是治疗脑卒中,改善患者预后的重要途径。前期研究表明,FA具有一定的抗炎效果,但是否能够通过抑制炎症反应发挥脑保护作用还未见报道。本研究通过体外OGD/R模型,研究了FA的抗炎作用,并初步阐明了可能的作用机制。
OGD/R可升高细胞培养基上清液中炎症因子(IL-1β、TNF-α和IL-6)的含量,表明OGD/R引起PC12细胞发生炎症反应。而FA处理组细胞内炎症因子水平被抑制,且与模型组比较差异有统计学意义,表明FA可抑制细胞内的炎症反应。这些结果表明,FA在PC12细胞模型上具有抗炎效果。
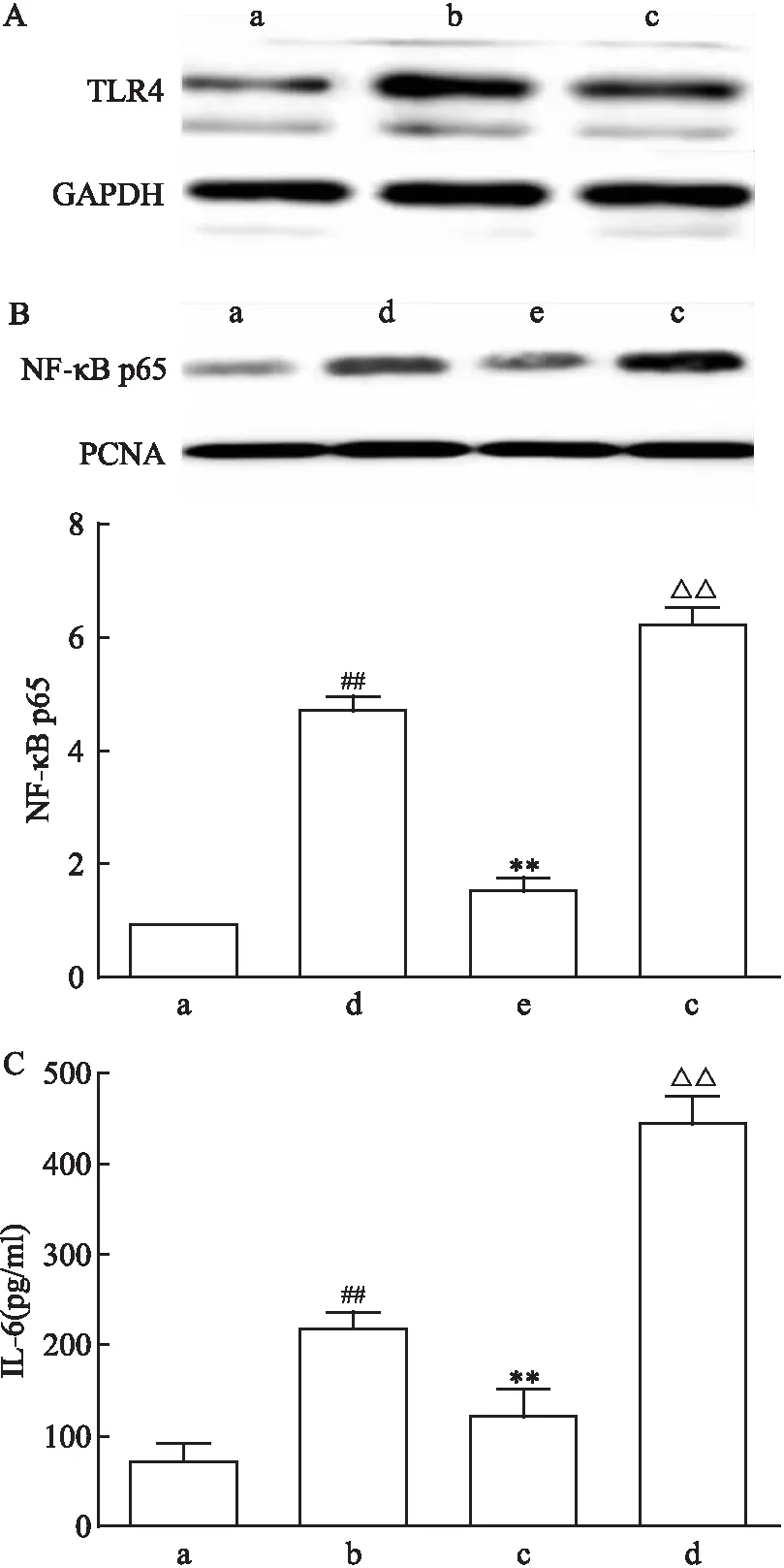
图5 FA通过TLR4调节NF-κB表达
为阐明FA的抗炎作用机制,本研究测定了TLR4/NF-κB信号通路。TLR4是在人类中发现的第一个TLR,在炎症免疫过程中发挥重要作用。机体内的炎症因子可识别TLR4并与其结合,诱导下游通路激活,进一步促进炎症反应,这种诱导放大效应可加重炎症反应和组织损伤。TLR4通过髓样分化因子88促使NF-κB和I-κB解离,NF-κB p65从细胞质转移至细胞核,与其核转录因子结合后,诱导炎症因子(TNF-α和IL-6等)释放,诱导产生和加重炎症反应。因此,有效抑制TLR4/NF-κB通路可阻断炎症反应的级联关系,减轻炎症反应和组织损伤。
本研究结果显示,OGD/R不仅升高细胞质NF-κB p65的表达水平,同时细胞核中NF-κB p65表达水平也增加,表明FA激活NF-κB p65通路。为进一步验证FA对NF-κB的调控作用,采用慢病毒颗粒过表达NF-κB,结果显示过表达NF-κB使FA对细胞核内NF-κB p65蛋白表达的抑制作用减弱,同时失去对IL-6的抑制作用,表明FA通过抑制NF-κB抑制炎症反应。为进一步明确FA对TLR4的调控作用,测定了TLR4的蛋白表达情况。结果表明,FA可抑制TLR4表达,同时采用慢病毒质粒进一步证实FA通过TLR4调控NF-κB发挥抗炎作用。
综上所述,FA能够抑制OGD/R诱导的PC12细胞炎症反应,其作用机制可能是通过抑制TLR4/NF-κB信号通路减少炎症因子释放,从而减轻细胞炎症损伤。本研究为进一步开发利用FA提供理论基础,将加速该药的推广应用。

