α-硫酸钙/纳米纤维素修复兔股骨缺损的实验研究△
刘金龙,孙晓彤,张玉娟,杜 庆,孙刚和,刘相成*
(1.中国人民解放军陆军第八十集团军医院骨科,山东潍坊261042;2.潍坊医学院麻醉学院,山东潍坊261053)
α-硫酸钙 (α-calcium sulphate hemihydrate,α-CSH)作为一种优良的骨缺损修复材料,已经有100多年的应用历史[1],针对其临床应用中代谢速度快、强度不足等应用缺陷,既往通过将α-CSH与壳聚糖、透明质酸、聚乳酸、羧甲基纤维素等高分子聚合物复合后,理化性质显著提高[2],其应用缺陷相应得到一定程度改善,但仍不能完全满足临床应用需求。纳米纤维素(nanocellulose,NC)作为一种自然来源的天然高分子纳米材料,不仅具有较好的生物安全性及组织兼容性[3],而且具有纳米材料比表面积大、长径比高、机械强度优异的性能,在生物医药领域尤其是骨科领域得到广泛应用[4]。作者前期研究中利用纳米纤维素增强α-CSH的结构稳定性,使α-CSH理化性质显著提高[5],本研究将进一步通过动物骨缺损模型检验α-CSH/NC复合植骨材料的骨缺损修复特性[6,7]。
1 材料和方法
1.1 植入材料的准备
α-CSH由Sigma公司生产提供,α-CSH/NC复合植骨材料由前期制备所得,利用自制单向轴压模具,分别制作直径6 mm,高度为8 mm的圆柱状植入物,放入37℃、100%湿度恒温恒湿箱中,待其凝固后从模具中取出,放入40℃鼓风干燥箱中烘干24 h,于本院消毒供应室采用环氧乙烷消毒灭菌,无菌包装密封待用。
1.2 动物及手术操作
封闭群新西兰白兔12只,雌雄不限,体重(3.12±0.25)kg,由济南鹏悦实验动物繁育有限公司提供[许可证:SCXK(鲁)2019-003]。随机将动物分为2组,每组6只。戊巴比妥钠30 mg/kg静脉麻醉,刮除股骨外髁处毛发,用碘伏消毒。每组动物右股骨髁设为空白对照,共12处,左股骨髁设为植入侧,α-CSH组以及α-CSH/NC组各6处。以股骨外髁最高点处为中心纵行切开长约2 cm手术切口,逐层分离至骨膜下,应用低速限深环钻于股骨外髁处钻取直径为6 mm,深度为8 mm的圆柱样骨缺损区域,生理盐水冲洗创口。α-CSH组以及α-CSH/NC组分别植入相应的材料后缝合创口;空白组给予生理盐水冲洗后,不植入任何材料,缝合创口。
所有动物均于术后3 d连续静脉注射青霉素80 IU/d预防感染。分别于术后4、12周通过静脉注射空气处死每组中的动物,并取股骨髁处标本,剥离周围软组织后放入4%的低聚甲醛溶液中浸泡固定,然后将标本依次放入70%、80%、90%、95%、100%浓度的乙醇中进行脱水。
1.3 Micro-CT扫描
将取材的兔子股骨髁标本行SCANCO Micro-CT扫描(扫描电压90 kV,电流88 mA,扫描层厚为50 μm),对术后4周处死动物标本中植入物的残留量进行分析,观察骨长入情况,对术后12周处死动物标本以植入物中轴线为中心,应用Micro-CT自带软件计算所获得的断层图像中心周缘3 mm范围内的骨表面积、骨体积、相对骨体积分数、骨小梁数目、骨小梁厚度、骨小梁分离度等骨小梁形态参数[8]。
1.4 硬组织切片
将获取的兔股骨髁标本应用T7200vlc光聚树脂包埋,包埋后自然硬化1周,应用Leica SM2500硬组织切片机进行硬组织切片,Van Gieson(VG)染色后进行成骨形态分析。
1.5 统计学方法
采用SPSS 18.0软件进行统计学分析。计量资料呈正态分布,以±s表示,采用单因素方差分析统计,两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
所有动物均能耐受手术,且术后48 h后可自由活动,术后2周1只α-CSH组实验动物、术后8周1只α-CSH/NC组实验动物因感染导致死亡退出实验,其余实验动物创口愈合良好,于4周及12周时间节点顺利取材。
2.2 Micro-CT扫描形态观察
术后4周所取股骨髁标本经Micro-CT扫描所得二维矢状切面图像及三维重建图像见图1a~1f,图示空白组钻孔处边缘清晰,未见明显新骨长入(图1a,1d),α-CSH组植入物少量残留,残留体积约为(5.54±0.45)%(图 1b,1e),而 α-CSH/NC 组植入物体积仍残留约(53.02±3.23)%(图1c,1f),两种不同植入物残存差异具有统计学意义(P<0.05),提示复合材料的体内代谢速率明显降低。
术后12周所取股骨髁标本经Micro-CT扫描所得二维矢状切面图像及三维重建图像见图1g~1l,术后12周两组植骨材料已经完全吸收,三组骨缺损区域均存在不同程度的新生骨,以α-CSH/NC组生成骨小梁最为致密(图1i)。三维重建图片可见空白组外口处骨缺损较多(图1j),α-CSH组外口未完全闭合,中央区域仍可见骨缺损(图1k),α-CSH/NC组外口处基本闭合,骨缺损区域不显著(图1l)。
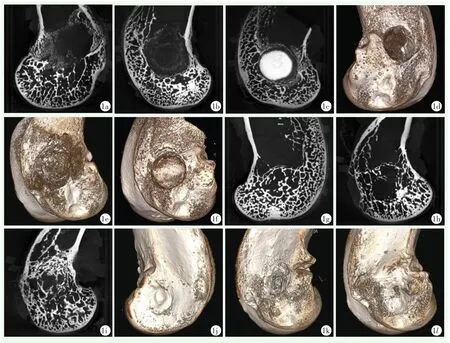
图1 兔股骨髁标本Micro-CT扫描形态所见 1a:术后4周空白组矢状切面,股骨髁骨洞处呈空洞状,骨洞中央未见新生骨 1b:术后4周α-CSH组矢状切面,股骨髁骨洞内可见少量植入物残留 1c:术后4周α-CSH/NC组矢状切面,股骨髁骨洞内可见明显植入物,植入物周缘处开始吸收 1d:术后4周空白组三维重建图像,可见股骨髁骨洞处呈空洞,周缘骨壁清晰 1e:术后4周α-CSH组三维重建图像,股骨髁骨洞内可见少量残留植入物,植入物外观不完整,大部分被吸收 1f:术后4周α-CSH/NC组三维重建图像,股骨髁骨洞内植入物清晰可见,同骨壁接触处可见明显缝隙,说明植入物部分被吸收1g:术12周空白组矢状切面,股骨髁骨洞处可见新骨生长,骨洞中央仍可见明显缺损 1h:术后12周α-CSH组矢状切面,可见股骨髁骨洞周缘少量新骨生长,骨洞中央无新生骨长入 1i:术后12周α-CSH/NC组矢状切面,可见股骨髁骨洞内充满新骨,中央处空洞需仔细分辨 1j:术12周空白组三维成像,股骨髁骨洞处变浅,外口处可见明显骨缺损,但外口已完全封闭 1k:术后12周α-CSH组三维重建图像,股骨髁骨洞残迹仍可见,外口处未封闭,可见内部骨缺损 1l:术后12周α-CSH/NC组三维重建图像,骨洞外口处完全闭合,无明显骨缺损,股骨髁骨洞已难分辨
2.3 Micro-CT形态计量结果
术后12周Micro-CT扫描图像采用CT自带软件对三组成骨情况进行分析[8],测量结果见表1。α-CSH/NC组的骨小梁形态参数除骨小梁厚度外明显优于其他两组,差异具有显著统计学意义(P<0.05)。
表1 Micro-CT骨形态计量结果(±s)与比较
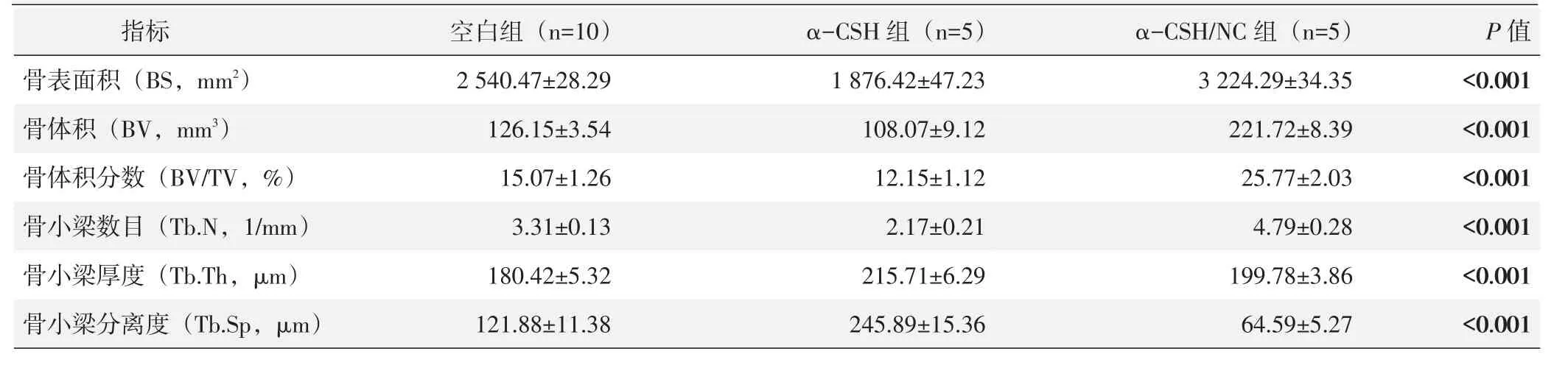
表1 Micro-CT骨形态计量结果(±s)与比较
指标骨表面积(B S,m m 2)骨体积(B V,m m 3)骨体积分数(B V/T V,%)骨小梁数目(T b.N,1/m m)骨小梁厚度(T b.T h,μ m)骨小梁分离度(T b.S p,μ m)空白组(n=1 0)2 5 4 0.4 7±2 8.2 9 1 2 6.1 5±3.5 4 1 5.0 7±1.2 6 3.3 1±0.1 3 1 8 0.4 2±5.3 2 1 2 1.8 8±1 1.3 8 α-C S H 组(n=5)1 8 7 6.4 2±4 7.2 3 1 0 8.0 7±9.1 2 1 2.1 5±1.1 2 2.1 7±0.2 1 2 1 5.7 1±6.2 9 2 4 5.8 9±1 5.3 6 α-C S H/N C 组(n=5)3 2 2 4.2 9±3 4.3 5 2 2 1.7 2±8.3 9 2 5.7 7±2.0 3 4.7 9±0.2 8 1 9 9.7 8±3.8 6 6 4.5 9±5.2 7 P值<0.0 0 1<0.0 0 1<0.0 0 1<0.0 0 1<0.0 0 1<0.0 0 1
2.4 硬组织切片结果
硬组织切片如图2所示,染色后骨小梁呈现粉红色,术后4周时可见三组股骨髁骨洞处边缘清晰,周缘处可见细小的新生骨小梁,除空白组考虑有少量残留骨屑导致钻孔中央区域出现少量染色外其余组中央区域均未见明显新骨生成,术后4周时α-CSH组已未见明显残留物,α-CSH/NC组中央区域仍可见明显植入物;术后12周时可见两组的植入物均完全吸收,三组骨洞周缘均有骨小梁长入,以α-CSH/NC组植骨骨洞处骨小梁最为密集,成果效应最好,上述切片所得成骨情况同Micro-CT扫描结果基本一致。
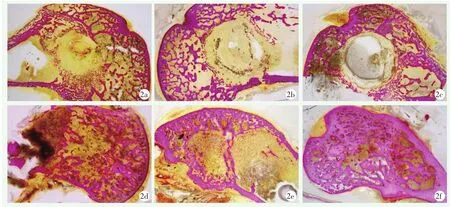
图2 兔股骨髁标本硬组织切片VG染色后图像 2a:术后4周空白组切片染色图像,可见骨洞边界清楚,边缘处骨小梁稀疏,中央处少量细小骨小梁,考虑为少量残留骨屑 2b:术后4周α-CSH组切片染色图像,骨洞周缘清晰,无明显骨小梁长入,中央处可见少量植入物残留 2c:术后4周α-CSH/NC组切片染色图像,骨洞边缘清晰,中央区域可见大块残留植入物,植入物吸收间隙未见明显骨小梁长入 2d:术后12周空白组切片染色图像,骨洞边缘不清,骨小梁长入,中央区域可见稀疏骨小梁长入 2e:术后12周α-CSH组切片染色图像,骨洞边缘可见骨小梁长入,局部骨小梁聚集,较为致密,骨洞形态不规则,中央区域内未见明显骨小梁长入,骨缺损明显 2f:术后12周α-CSH/NC组切片染色图像,可见骨洞边缘及中央处均有明显骨小梁长入,中央骨缺损面积小,成骨效应最佳
3 讨论
良好的骨缺损修复材料不仅可以为骨缺损修复过程提供结构和力学支撑,还应能够刺激相关成骨细胞的附着,增殖和分化。自1892年Dreesmann[1]首次报道应用煅烧硫酸钙修复骨缺损以来,硫酸钙便以其优良的骨传导性、可塑性及组织相容性等优点在骨缺损及药物缓释等领域备受关注,硫酸钙在骨缺损修复过程中除能够提供一定程度的力学支撑外,其释放的钙离子还能够促进成骨细胞的增殖和分化[2],本实验中α-CSH组虽然成骨效应差,但α-CSH代谢过程中释放大量钙离子,可为成骨提供充足的原材料,这可能是导致α-CSH组骨洞周缘处局部骨小梁厚度优于其他两组的原因。但是α-CSH吸收速率过快,其降解速度明显快于骨组织的再生速度,难以在骨再生的全过程中提供足够的机械支撑,因此在其完全降解后骨缺损区域可能出现空隙,明显削弱宿主骨的再生能力[9]。为降低α-CSH的代谢速率,本实验借鉴以往研究中通过将α-CSH与壳聚糖、透明质酸、聚乳酸、羧甲基纤维素等高分子聚合物复合,增强理化性质的经验,将α-CSH同NC通过乳化分散的方式相复合,使NC在α-CSH中形成三维网状结构,并且其丝状结构同硫酸钙晶体紧密结合,显著增强结构稳定性,不仅增加其抗压强度和韧性,而且可显著增加硫酸钙的抗溃散性[5],本实验中术后4周α-CSH/NC组残留物体积明显优于α-CSH组,差异具有显著统计学意义(P<0.05),进一步证明NC不仅能够增强α-CSH的力学性能,而且能够有效延缓α-CSH的代谢速率。
NC是木材、棉花、大麻等植物细胞壁的主要成分,同时也可以由特定的被囊动物、藻类、真菌和细菌合成,作为一种自然来源的天然高分子纳米材料兼具天然纤维素和纳米材料的特性[3,10],具有良好的可降解性及生物相容性,是目前生物医药领域重点研究的材料[4]。在本次实验中α-CSH/NC组并没有发生严重的炎症反应,周围组织没有坏死,进一步证实了NC良好的生物相容性。结果显示它可以有效的模拟细胞外基质环境,为细胞的附着及分化提供良好的环境[11],而且NC是由D-吡喃式葡萄糖基通过β-(1→4)-D-糖苷键联接而成的大分子,含有丰富的羧甲基等活性基团,能够有效鳌合钙离子,促进钙磷酸盐晶体均匀沉积,诱导间充质干细胞向成骨细胞分化[12],其促成骨作用明显优于明胶等其他高分子化合物[13],在骨缺损修复过程中,NC构成的三维网状结构填充于整个骨洞中,α-CSH的包裹也进一步降低了NC的生物降解,其网状结构起到一定生物支架的作用,诱导成骨细胞沿其纤维走行向骨洞中每个角落处附着,同时有效的鳌合α-CSH降解释放的钙离子,促进骨洞中央处骨小梁再生。
本研究通过动物实验进一步验证了α-CSH/NC复合植骨材料代谢速率低,生物相容性良好,骨缺损修复效应显著,未来将进一步对其进行改性研究,弥补其应用缺陷,使其成为优良的骨移植替代材料。

