优化肠内营养喂养流程在ICU重症患者中的应用效果
邓丽萍 罗翊珠 张钫华
(广州中医药大学顺德医院(广东佛山市顺德区中医院),广东 顺德 528300)
肠内营养通过利用胃肠道途径获得相应的营养支持,不但能够增强患者的营养质量,而且能够促使患者胃肠道黏膜屏障的完善及重建,改善肝、胆功能,利于肝脏蛋白质合成和代谢,改善机体免疫功能,继而改善患者的预后。美国重症医学会于2017年制订的《重症患者喂养指南》中明确指出,患者需在入住ICU后的24~48 h内实施肠内营养方案[1]。2019年,欧洲肠内外营养组委会明确指出:针对无法经口进食的成年危重患者实施早期肠内营养(≤48 h)的预后效果明显优于推迟肠内营养的患者,且早期肠内营养(≤48 h)的预后效果明显优于早期肠外营养[2]。2014年,欧洲危重病组委会明确了急性胃肠功能损伤(acute gastrointestinal injury,AGI)的分级要求,指出了AGI对危重患者预后带来的影响[3]。针对ICU患者实施AGI评估利于发现其脏器异常问题、自身病情特征及预后效果[4]。常规肠内营养流程不完善对患者胃肠功能及耐受性的量化评估,造成肠内营养过程中不断发生胃潴留、腹泻等问题,导致肠内营养中止,甚至因喂养不充分而影响患者的预后[5-7]。因此,提升重症患者的喂养有效率,对预防并发症的出现尤为重要。本研究旨在探讨优化肠内营养喂养流程在ICU重症患者中的应用效果。
1 资料与方法
1.1 一般资料 选取2019年1~12月ICU接收的重症患者120例,将2019年1~6月接收的60例患者设为对照组,2019年7~12月接收的60例患者设为观察组。纳入标准:①患者或家属了解此次研究目的及内容,且签署知情同意书。②ICU救治时间≥7 d,预计≥3 d无法经口进食。③不存在肠内营养禁忌证。两组的性别、年龄、慢性健康评分、急性生理等一般资料比较,差异无统计学意义(P>0.05),可对比。两组重症患者的一般资料见表1。
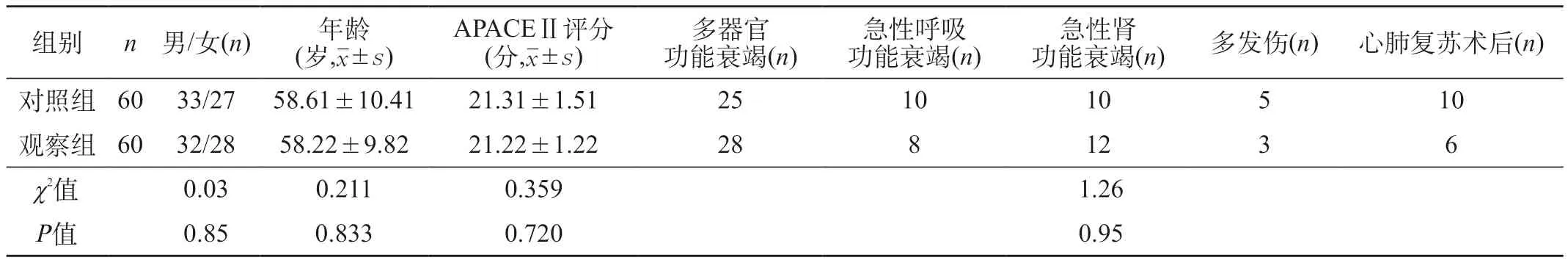
表1 两组重症患者的一般资料比较
1.2 方法 所有患者均实施常规治疗方案,内容包括机械通气、促使内环境稳定、改善电解质失衡状态、增强重要脏器功能、实施循环系统保护等。对照组选择常规营养治疗方案及临床干预。①医师结合患者实际情况或以往实践经验实施肠内营养支持方案,护理人员按照医嘱对其注射蛋白制剂,如短肽型营养制剂等,借助营养泵设置肠内营养制剂的注射初始速度是25~35 mL/h。②加强鼻胃肠管稳固,预防脱管的出现。③保障鼻胃肠管固定,预防阻塞。④每间隔4 h测定胃残余量,若>200 mL,则需中止鼻饲。⑤实时调整患者肠内营养制剂的温度、速度、剂量等,并认真记录相关数据。基于常规营养治疗、临床干预等前提下,观察组实施优化重症患者肠内营养喂养流程。①设立营养治疗干预小组,组员包括科室主任、护士长、主治医师、重症科护士等,总计12名组员。②明确重症患者肠内营养喂养具体流程。结合2014年欧洲重症组委会AGI分级要求、2018年危重症患者肠内营养指南等内容制订肠内营养流程化管理,包括营养风险评估、营养治疗时机、胃肠功能评估、营养支持途径、误吸风险评估、肠内营养耐受性评估、5~7 d逐渐达到目标喂养量等。在整个流程中基于营养风险评估表(NUTRIC评分)、肠内营养耐受性评分表、误吸风险评估表,制订肠内营养不耐受现象的处理流程。建立ICU营养管理核查清单,经过小组成员的认真探讨、临床试验等,由此明确优化重症患者肠内营养的喂养流程。③重症患者肠内营养喂养流程的相关内容包括:存在高营养风险或预计3 d以上不能经口饮食;血流动力学稳定,即血压平稳,平均动脉压>65 mm Hg,且血管活性药物在减量或撤除的过程。入科24 h根据AGI分级要求实施评估,对其功能正常或轻微受损者(AGI<I级),初始速度为25 mL/h,整蛋白肠内营养配方为瑞代、能全力等;胃肠功能中度受损者(AGI在Ⅱ~Ⅲ级),初始速度为10~15 mL/h,预消化肠内营养配方为白普力等短肽型营养制剂;胃肠功能重度受损者(AGI为Ⅳ级),需中止肠内营养,实施场外营养支持。④营养风险评估:10~12分为低度风险,13~18分中度风险,19~23分重度风险。误吸风险低者经胃管输注,误吸风险高者经鼻肠管输注。⑤在实施肠内营养期间,需评估患者肠内营养的耐受性[8]。此量表的评估内容包括腹痛、腹胀、恶心、反胃、腹泻5个部分。耐受性评分为0~2分,继续肠内营养,增加或维持原速度;3~4分,继续肠内营养,减慢速度,根据10 mL/h速度逐步递减,2 h后再次评估;如果≥5分,中止肠内营养或改变营养路径,并进行相应处置。每间隔4 h再次评估患者的耐受性,如果评分在3~4分,那么需延续肠内营养。每日坚持评估肠内营养耐受性,逐渐增量,目标热量为25~30 kcal/(kg·d),蛋白质为1.2~2.0 g/(kg·d)。若实际热量在7~10 d不能到达目标量的60%,需额外添加肠外营养。本研究使用的肠内营养制剂为百普力、能全力,规格500 mL,热量为1 kcal/mL,均为纽迪希亚制药(无锡)有限公司生产。
1.3 观察指标 ①营养状况:在患者住院第1、3、7日,抽取肘静脉血,对营养指标进行测定,包括血清白蛋白、血清总蛋白、血红蛋白。②统计两组胃肠道功能紊乱、院内感染发生情况。胃肠道功能紊乱一般是指在肠内营养过程中发生的胃潴留、腹泻等;院内感染是指在肠内营养过程中发生的呼吸机相关性肺炎、导管相关血流感染及导尿管相关尿路感染,其临床诊断标准必须要满足医院感染诊断要求。③结局指标包括营养达标时间、住院时间、病死率。
1.4 统计学方法 采用SPSS 25.0统计学软件对数据进行分析。计量资料采用()表示,组间比较行t检验;计数资料采用[n(%)]表示,组间比较行χ2检验;P<0.05表示差异有统计学意义。
2 结果
2.1 两组营养指标对比 在住院第1、3日,两组血红蛋白、血清白蛋白、血清总蛋白水平比较,差异无统计学意义(P>0.05);在住院第7日,观察组血红蛋白、血清白蛋白、血清总蛋白水平均优于对照组,组间差异有统计学意义(P<0.05)。见表2。
表2 两组营养指标对比(g/L,)
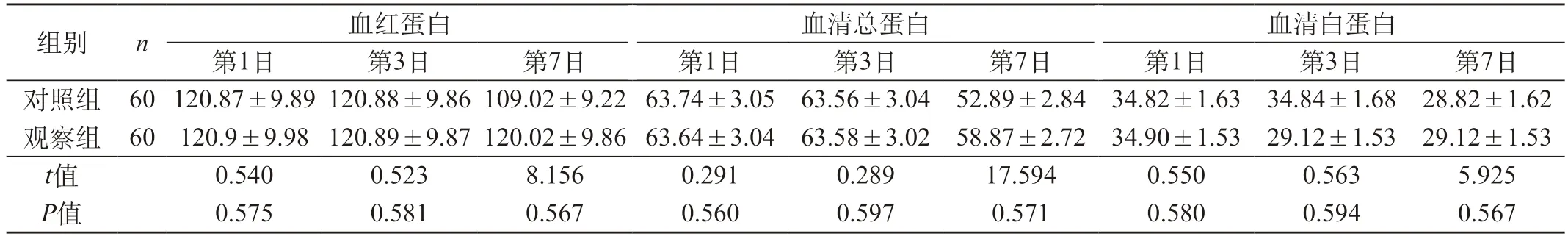
表2 两组营养指标对比(g/L,)
2.2 两组胃肠功能紊乱及院内感染的发生率对比 观察组患者胃潴留、腹泻等胃肠功能失调发生率低于对照组,住院时间短于对照组,组间差异有统计学意义(P<0.05)。观察组患者呼吸机相关性肺炎、导管相关性血流感染及尿管相关尿路感染的发生率均低于对照组,差异有统计学意义(P<0.05)。见表3。
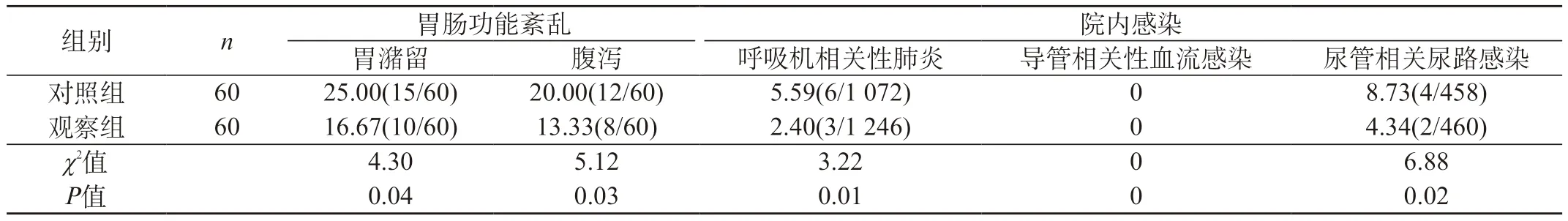
表3 两组胃肠功能紊乱及院内感染的发生率对比
2.3 两组结局指标比较 观察组营养达标时间、ICU住院时间均短于对照组,病死率低于对照组(P<0.05)。见表4。

表4 两组结局指标比较
3 讨 论
重症患者由于疾病因素及内分泌因素的影响,易在肠内营养喂养过程中出现腹胀、腹泻、胃潴留等消化道症状。重症患者长期处在高代谢状态下,如果无法及时接受充足的能量传输,则会导致内部器官遭到严重破坏,出现恶性循环[9-10]。经调查发现,ICU患者的营养情况和预后存在一定的关联性[11]。既往临床对重症患者实施肠内营养治疗期间,通常不会对其胃肠耐受性进行评估,喂养速度不会对肠内营养的运行状态造成影响,且整个操作流程缺乏规范性及有序性[12]。护理人员仅遵医嘱开展相关工作,临床疗效往往欠佳。优化肠内营养喂养流程主要内容有:评估患者的营养风险,对于高风险且血流动力学趋于稳定的患者早期开启肠内营养治疗;结合患者AGI分级设置肠内营养的原始速度、营养制剂类型等;按照误吸概率来创建营养路径;结合患者营养风险、营养达标时间来判断是否需要实施肠外营养,并动态评估患者肠内营养的耐受性。护理人员在执行肠内营养方案的过程中及时改变肠内营养的输液速度,利用量性评估、动态调整等方案,尽可能地降低肠内营养期间的并发症概率,确保重症患者能够顺利的达到喂养目标。本研究结果表明,重症患者采用优化肠内营养喂养流程能够明显增强患者的营养效果,预防重度营养不良问题的出现,减少蛋白质及热量的消耗。有效减少胃潴留、腹泻等并发症的发生,使患者获得有效的营养,缩短ICU住院时间,降低院内感染的发生率,改善患者的预后结局[12]。因此,在ICU中应以流程为中心基础,对肠内营养治疗进行科学,规范和流程化管理,提高喂养达标率。
综上所述,优化肠内营养喂养流程可有效减少重症患者肠内营养相关并发症的发生,确保患者在恢复早期获得有效营养,促进患者的康复。

