CD4+T细胞、NK细胞穿孔素异常表达对手足口病免疫状态评估及预后的指导价值
黄崇刚 陈静琳 喇海芹
青海省妇女儿童医院呼吸科(西宁810007)
手足口病(HFMD)是一种由肠道病毒感染引发的儿童传染病,病原体主要为肠道病毒71型(EV71)和柯萨奇病毒A16型(CA16)病毒[1]。HFMD大多预后良好,但部分病情较重者可在短时间内出现急性肺水肿、神经系统并发症甚至死亡。多项研究表明,免疫功能紊乱在HFMD的发生发展中起到重要作用,寻找到一种评估HFMD患儿免疫状态和病情严重程度的敏感指标,对指导临床治疗和改善预后具有重要意义[2]。有研究认为,EV71病毒蛋白表型A3可能是诱导CD4+T细胞活化的主要决定簇,在病毒后期蛋白加工过程A3重新修饰可能会影响CD4+T细胞的增殖状态,因此CD4+T细胞表达或许能反映HFMD的病情发展[3]。NK细胞穿孔素(PRF)能协助颗粒酶进入靶细胞清除病原体,有学者认为其表达能在一定程度上反映病毒感染程度和预测预后[4],但具体情况有待进一步研究。本研究通过分析143例EV71型HFMD患儿 体内CD4+T细 胞、NK细胞PRF表 达水平与免疫状态和预后关系,为探索HFMD发病机制及改善患儿预后提供一定参考依据。
1 资料与方法
1.1 一般资料选取2017年1月至2020年6月我院收治的143例EV71型HFMD患儿,纳入标准:(1)患儿确诊为HFMD,参考《手足口病诊疗指南(2018年版)》[5];(2)病程≤3 d;(3)临床资料完善;(4)患儿家长知情并签署同意书。排除标准:(1)合并慢肺阻、先天性心脏病、营养不良等基础疾病;(2)合并严重肾脏相关疾病;(3)外院转入或用药史不详患儿;(4)近期有使用过免疫抑制剂或注射免疫球蛋白者。入选患儿按照病情严重程度[6]分为普通型组(n=67)、重型组(n=45)和危重型组(n=31),同时按照性别、年龄匹配原则另选体检正常儿童35例作为对照组,且肠道病毒抗体阴性,无严重器质性疾病、代谢异常等。普通型组,男37例,女30例,年龄(1.82±0.92)岁,病程(1.63±0.25)d,其中27例EV71感染,22例CA16感染,18例通用病毒感染;重型组,男24例,女21例,年龄(1.77±0.86)岁,病程(1.72±0.33)d,其中25例EV71感染,13例CA16感染,7例通用病毒感染;危重型组,男17例,女14例,年龄(1.73±0.91)岁,病程(1.86±0.36)d,其中22例EV71感染,7例CA16感染,2例通用病毒感染;对照组,男20例,女15例,年龄(1.72±0.83)岁。各组患儿性别、年龄比较差异无统计学意义(P>0.05)。本研究经我院医学伦理委员会审核通过。
1.2 方法收集患儿一般临床资料,如性别、年龄、病程、感染病原体(经肛门拭子和咽拭子RT⁃PCR检测确定病毒类型)及各项生理指标参数。于入组第1天采集患儿空腹静脉血4 mL并置于加入EDTA的抗凝管中,采用全血法配置分析液,FACS Multi SET程序获得T淋巴细胞亚群(CD3+T、CD4+T、CD8+T)、CD14+单核细胞、CD19+B细胞、NK细胞的绝对计数。将全血采用免疫比浊法检测血清中疫球蛋白(IgA、IgG、IgM)及补体(C3、C4)水平。在分离出的单个核细胞中加入表面抗体anti⁃CD56⁃APC(CD3+CD8+CTL细胞和CD3⁃CD56+NK细胞)进行染色,固定、破膜。洗涤后加入PE标记的PRF或颗粒酶B(GrzB)抗体,避光孵育1 h,洗涤,上流式细胞仪(美国BD公司Facs CantoⅡ型)检测,以PRF或GrzB阳性细胞比率作为PRF或GrzB表达水平。采用小儿危重病例评分(PCIS)、小儿死亡危险评分(PRISMⅢ)评价患儿病情严重程度,PCIS评分包括患儿心率、血压、血气值、pH、血钠、血 钾、有 无 应激 性 溃疡 等 内容,总分100分[7];PRISMⅢ评分包括体温、心率、瞳孔反射、血压、血气值、血钾、血细胞计数等26个生理参数[8],两者均为分数越高病情越严重,死亡风险越高。将入院28 d内死亡作为预后不良,分析不同预后患儿CD4+T、NK细胞PRF表达差异。所有患儿均由我院2名副主任及以上级别医师进行疾病诊断和病情评估。
1.3 统计学方法采用SPSS 22.0软件包分析数据,符合正态分布的计量资料以均数±标准差表示,多组间比较用单因素方差分析,组间两两比较采用snk⁃q检验;计数资料以例(%)表示,组间比较采用χ2检验;相关性分析采用Pearson检验;P<0.05为差异有统计学意义。
2 结果
2.1 各组T细胞、单核细胞水平比较重症组、危重型组、普通型组患儿CD3+T、CD4+T、CD14+细胞数低于对照组,其中重症组、危重型组低于普通型组,差异具有统计学意义(P<0.05),重症组、危重型组、普通型组患儿CD8+T细胞数组间比较差异无统计学意义(P>0.05),见表1。
表1 各组免疫细胞水平比较Tab.1 Comparison of immune cell levels in each group ±s,cells/μL

表1 各组免疫细胞水平比较Tab.1 Comparison of immune cell levels in each group ±s,cells/μL
注:与对照组比较,*P<0.05;与普通型比较,#P<0.05
组别危重型组重型组普通型组对照组例数31 45 67 35 CD4+T 630.2±126.7*#1 026.7±163.8*#1 137.5±149.5*1 682.2±123.4 CD3+T 1 776.2±384.2*#2 169.4±391.5*#2 483.2±368.7*3 794.2±494.3 CD8+T 764.2±170.8*796.3±124.2*834.2±253.6*1 174.2±493.5 CD14+340.5±74.7*#426.2±68.2*#473.6±56.9*759.2±38.4
2.2 各组B细胞、IgA、IgG、IgM及补体水平比较各组体液免疫指标IgA、IgG、IgM及补体C3、C4水平差异无统计学意义(P>0.05),重症组、危重型组、普通型组患儿CD19+B细胞数低于对照组,其中重症组、危重型组低于普通型组,差异具有统计学意义(P<0.05),见表2。
表2 各组B细胞、IgA、IgG、IgM及补体水平比较Tab.2 Comparison of B cell,IgA,IgG,IgM and complement levels in each group ±s
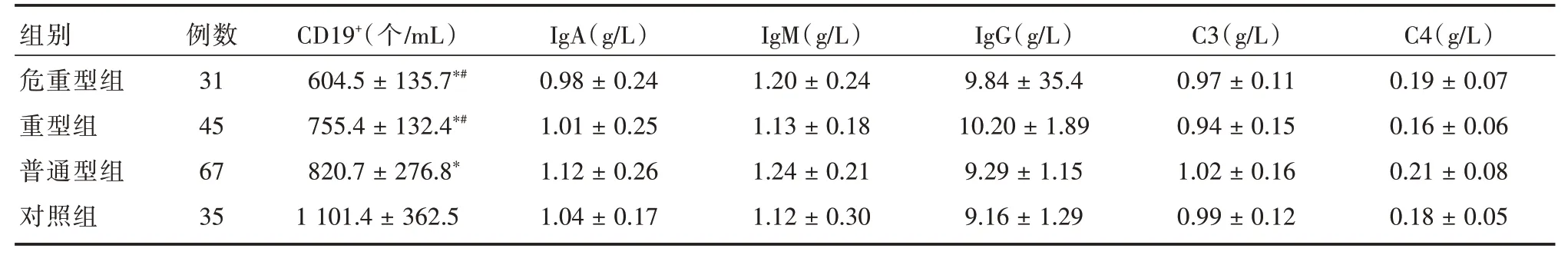
表2 各组B细胞、IgA、IgG、IgM及补体水平比较Tab.2 Comparison of B cell,IgA,IgG,IgM and complement levels in each group ±s
注:与对照组比较,*P<0.05;与普通型比较,#P<0.05
组别危重型组重型组普通型组对照组例数31 45 67 35 CD19+(个/mL)604.5±135.7*#755.4±132.4*#820.7±276.8*1 101.4±362.5 IgA(g/L)0.98±0.24 1.01±0.25 1.12±0.26 1.04±0.17 IgM(g/L)1.20±0.24 1.13±0.18 1.24±0.21 1.12±0.30 IgG(g/L)9.84±35.4 10.20±1.89 9.29±1.15 9.16±1.29 C3(g/L)0.97±0.11 0.94±0.15 1.02±0.16 0.99±0.12 C4(g/L)0.19±0.07 0.16±0.06 0.21±0.08 0.18±0.05
2.3 各组NK细胞及PRF、GrzB水平比较重症组、危重型组、普通型组患儿NK细胞数低于对照组,其中重症组、危重型组低于普通型组,PRF、GrzB反之,差异具有统计学意义(P<0.05),见表3。
表3 各组NK细胞及PRF、GrzB水平比较Tab.3 Comparison of NK cells,PRF and GrzB levels in each group ±s
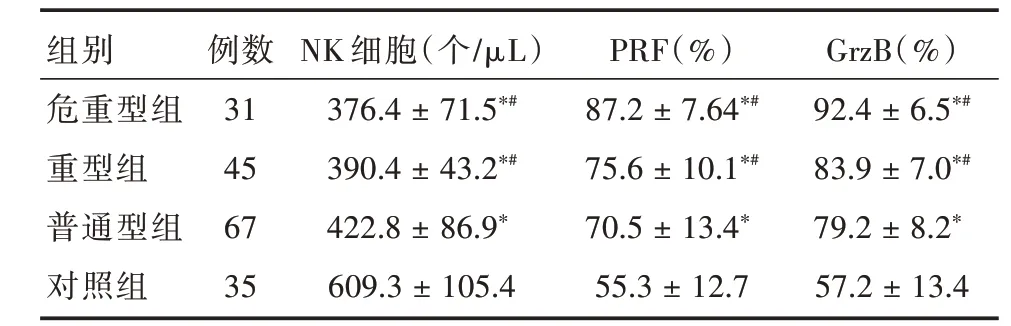
表3 各组NK细胞及PRF、GrzB水平比较Tab.3 Comparison of NK cells,PRF and GrzB levels in each group ±s
注:与对照组比较,*P<0.05;与普通型比较,#P<0.05
组别危重型组重型组普通型组对照组例数31 45 67 35 NK细胞(个/μL)376.4±71.5*#390.4±43.2*#422.8±86.9*609.3±105.4 PRF(%)87.2±7.64*#75.6±10.1*#70.5±13.4*55.3±12.7 GrzB(%)92.4±6.5*#83.9±7.0*#79.2±8.2*57.2±13.4
2.4 CD4+T细胞、PRF与PCIS评分、PRISMⅢ评分相关性分别评价重症和危重症患儿病情严重程度,其PCIS评分分别为(78.35±6.84)、(70.84±6.34)分,PRISMⅢ评分分别为(7.29±2.71)、(12.84±3.56)分。Pearson相关性分析显示,CD4+T细胞与PCIS评分呈正相关(r=0.665,P<0.05),与PRISMⅢ评分呈负相关(r=-0.757,P<0.05),PRF与PCIS评分呈负相关(r=-0.615,P<0.05),与PRISMⅢ评分呈正相关(r=0.596,P<0.05),见表4。
2.5 CD4+T细胞、PRF表达与临床预后预后良好患儿CD4+T细胞高于预后不良患儿,NK细胞PRF低于预后不良患儿,差异具有统计学意义(P<0.05),见表5。
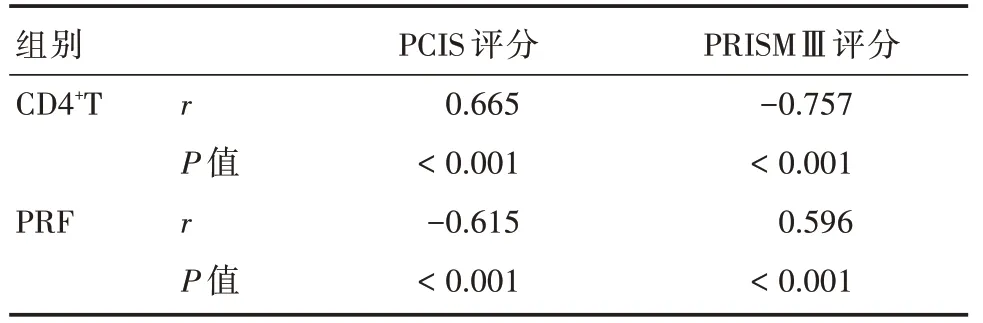
表4 CD4+T细胞、PRF与PCIS评分、PRISMⅢ评分相关性Tab.4 The correlation between CD4+T cells,PRF and PCIS score,PRISMⅢscore
表5 不同预后患儿CD4+T细胞、PRF表达Tab.5 CD4+T cell and PRF expression in children with different prognosis ±s
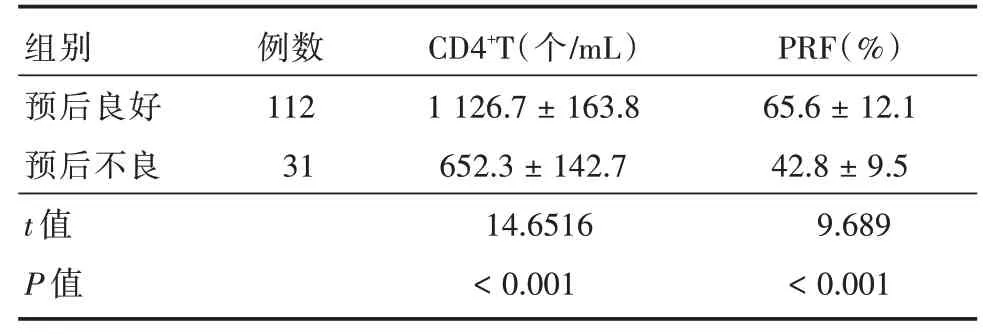
表5 不同预后患儿CD4+T细胞、PRF表达Tab.5 CD4+T cell and PRF expression in children with different prognosis ±s
组别预后良好预后不良t值P值例数112 31 CD4+T(个/mL)1 126.7±163.8 652.3±142.7 14.6516<0.001 PRF(%)65.6±12.1 42.8±9.5 9.689<0.001
3 讨论
HFMD是常见的儿童肠道病毒感染疾病,部分患儿病情发展严重可并发心肺衰竭、神经源性肺水肿等,引发患儿病死[9-10]。目前HFMD发病机制尚未明确,但已有多项研究证实细胞免疫在其中发挥作用。肠道病毒感染机体内,体内T细胞、B细胞、NK细胞等多种免疫细胞可迅速分化,从而释放大量炎性因子或炎性介质,而过度活化的免疫应答损伤患儿肺部、大脑、神经等组织或脏器,对患儿预后产生不利影响[11]。
相关研究发现,在肠道病毒感染早期机体内可出现细胞免疫紊乱、分泌细胞因子大量增加、代偿性抗炎反应强度增加,随着病情持续发展,免疫细胞和炎症介质逐渐消耗,患儿机体内免疫细胞数量开始减少,出现免疫抑制或免疫麻痹[12-13]。本次研究发现,HFMD患儿CD3+T、CD4+T、CD14+、CD19+B、NK细胞数及NK细胞PRF、GrzB均低于正常儿童,其中重症、危重型患儿以上指标均低于普通型患儿,提示HFMD患儿体内存在明显单核细胞、淋巴细胞数量的减少,且重型和危重型患儿减少更为明显。而不同病情严重程度患儿IgA、IgG、IgM及补体C3、C4水平无显著差异,提示随病情进展,患儿体内出现明显的细胞免疫功能抑制,因而可以说明细胞免疫异常也参与了HFMD的病情进展。CD4+T是机内常见免疫细胞,其绝对值与患儿年龄有关[14],本次选择各组患儿年龄无显著差异,发现不同病情患儿体内CD4+T细胞数具有显著差异,且重症、危重症患儿CD4+T细胞数目低于普通型患儿。一般来说,机体免疫细胞在病毒感染刺激下可迅速被激活,产生大量细胞因子来清除病毒[15],而本次结果提示病情越重,CD4+T细胞表达抑制越严重。推测原因可能是在肠道病毒复制的过程中,能被CD4+T细胞识别的表型被重新修饰而引发CD4+T细胞受刺激和表达减少[16]。有学者认为,CD4+T细胞对主要肠道感染病毒EV71和CA16感染并不敏感,因而CD4+T细胞并未随病情进展持续增加[17]。还有学者认为,病毒感染刺激后机体免疫系统可能出现偏倚,即CD4+T细胞作用降低的同时,机体其他免疫细胞(如NK细胞)对该病毒更为敏感,杀伤作用增强[18],但本次研究中其他淋巴细胞也减少,故此结论有待进一步研究和论证。NK细胞作为机体免疫系统的第一道防线,也在肠道病毒感染过程中发挥重要作用[19]。NK细胞对病毒杀伤机制主要有两点,一是调节T细胞表面抗原配体和Fas靶细胞表面抗原之间作用,二是细胞释放PRF后可与靶细胞膜结合,PRF嵌入膜内形成中空多聚体,损伤胞膜完整,外界水分子、离子及其他小分子物质进入靶细胞内,影响细胞渗透压从而破裂死亡[20-21]。PRF同时也协助颗粒酶通过颗粒胞吐作用进入靶细胞,并诱导细胞核caspases的非依赖性细胞死亡,因而PRF、GrzB表达升高有利于抗病毒作用[22]。而本研究中相对于重症患儿,普通型患儿PRF、GrzB表达升高,提示其介导的细胞杀伤和细胞毒性作用也相应增加。推测原因可能是重症患儿免疫功能不足,引发病毒大量复制和扩散,PRF、GrzB介导的细胞杀伤和细胞毒性作用增强,炎症因子释放引发组织损伤,从而进一步加重患儿病情[23]。相关性分析显示,CD4+T细胞与PCIS评分呈正相关,与PRISMⅢ评分呈负相关,PRF反之,提示CD4+T细胞与PRF均与患儿病情严重程度密切相关。根据入院28 d是否死亡将患儿分为预后良好和预后不良,发现预后良好患儿CD4+T细胞高于预后不良患儿,NK细胞PRF低于预后不良患儿,提示CD4+T细胞与PRF能在一定程度上反映HFMD患儿预后。
综上所述,手足口病患儿存在明显CD4+T细胞表达过低、NK细胞PRF表达过高,两者可用于重症患儿细胞免疫状况评估,且与患儿病情严重程度和预后不良有关。

