Dock2通过调节T细胞活性和抗原特异性IgG抗体的产生来控制肠道柠檬酸杆菌感染
孟凡 陈峻 刘雨霞 谢璐 李子俊 刘志平,
1赣南医学院第一附属医院消化内科(江西赣州341000);2赣南医学院2019级研究生(江西赣州341000),3赣南医学院心脑血管防治教育部重点实验室炎症与免疫中心(江西赣州341000);4赣南医学院基础医学院(江西赣州341000);5南方医科大学第二临床分委会,广东省人民医院(广州510000)
细胞分裂贡献者2(Dedicator of cytokinesis 2,Dock2)是鸟嘌呤核苷酸交换因子家族的成员,它可以激活小G蛋白Rac,调节细胞骨架重组[1-2]。Dock2似乎仅在造血细胞如嗜中性粒细胞,淋巴细胞和巨噬细胞中表达[3]。Dock2对于免疫细胞(包括T细胞、嗜中性粒细胞、B细胞、胸腺细胞和浆细胞样树突状细胞)的迁移至关重要[4-6]。Dock2⁃Rac通过影响突触的形成来控制NK细胞介导的细胞毒性[7]。Dock2还显示出通过下调IL⁃4Rα表面表达来抑制Th2谱系发育,从而抑制了由利什曼原虫感染引起的足垫肿胀[8]。Dock2可能是控制移植排斥和阿尔茨海默病的分子靶标[9-10]。此外,实验室前期研究表明,Dock2在抵抗鼠类柠檬酸杆菌(citrobacter rodentium)感染引起的早期结肠炎中发挥了关键作用[11]。
柠檬酸杆菌感染是一种常用于研究结肠炎形成的模型[12-13]。柠檬酸杆菌是肠道杆状菌革兰氏阴性菌,是黏附/擦拭(attaching and effacing,A/E)病原体家族的成员[14],因此也可用于研究临床上重要的人类病原体(例如引起大量腹泻的肠病原性和肠出血性大肠杆菌)的发病机制[15-16]。前期研究表明,Dock2-/-小鼠对柠檬酸杆菌感染比野生型(Wild⁃type,WT)小鼠更为易感。在感染后第14天,Dock2-/-小鼠具有更严重的死亡率、体质量损失、细菌负荷、结肠缩短和组织学损害等结肠炎相关指标。进一步研究表明Dock2的缺乏并不会导致感染早期保护性促炎细胞因子和抗菌肽的产生减少。在感染后14 d Dock2-/-小鼠肠道中的巨噬细胞和嗜中性粒细胞从粘膜下层迁移至黏膜层存在缺陷,这可能直接影响宿主对柠檬酸杆菌感染的易感性[11]。但是,在宿主对抗柠檬酸杆菌感染的适应性免疫中Dock2的功能仍然未知。研究柠檬酸杆菌感染后期淋巴细胞变化与细菌清除率之间的关系,并进一步探索可能影响宿主对柠檬酸杆菌敏感性的其他因素,将对结肠炎的治疗提供重要思路。
1 材料与方法
1.1 实验动物Dock2-/-小鼠由日本九州大学Yo⁃shinori Fukui博士提供。TCRa-/-小鼠购自The Jack⁃son Laboratory。C57BL/6小鼠用作WT对照。所有动物程序均遵循赣南医学院动物使用和伦理委员会批准的方案。
1.2 柠檬酸杆菌感染柠檬酸杆菌购于ATCC(ATCC#51459。挑取柠檬酸杆菌置于LB肉汤中37℃摇震荡培养8~9 h。小鼠感染前禁食8 h,然后以1×1010CFU/小鼠的浓度通过灌胃方式感染。为确定感染情况,将粪便,脾脏,肠系淋巴结(mesenter⁃ic lymph nodes,MLN)和肝脏匀浆,用1×PBS梯度稀释,种板于麦康凯琼脂平板上,37℃孵育24 h,计算各载菌量。
1.3 组织学分析取结肠组织固定、包埋、切片,H/E染色观察病理学变化;CD3、IgA、F4/80和Gr⁃1抗体分别对T细胞、B细胞、巨噬细胞和嗜中性粒细胞进行染色,观察结肠免疫细胞浸润。
1.4 促炎细胞因子分析利用含蛋白酶和磷酸酶抑制剂的RIPA缓冲液将结肠组织匀浆,ELISA检测结肠组织和血清中的细胞因子IFN⁃γ,TNF⁃α,KC,MCP⁃1,MIP⁃2,IL⁃6和IL⁃17的蛋白表达水平。
1.5 抗原特异Ig抗体分析利用ELISA法检测特异于柠檬酸杆菌的血清抗体产生[17]。将加热灭活的柠檬酸杆菌包被在ELISA板上,封闭后加入血清样本,室温下孵育2 h。检测血清中IgM,IgG,IgG1,IgG2b,IgG2c和IgG3的含量,用3,3′,5,5′′⁃四甲基联苯胺(TMB)显影并读取450 nm的OD值。
1.6 结肠固有层淋巴细胞(lamina propria lym⁃phocytes,LPL)的分离分离结肠LPL的方法如前所述[18]。用预冷PBS洗涤结肠并切成1 cm的小块。然后将结肠与5 mmol/L EDTA和10 mmol/L HEPES在37℃孵育10 min,放入含有DNase I和胶原酶D的1640培养基中于37℃消化1 h。
1.7 流式细胞仪分析取小鼠脾脏制成单细胞悬液。用CD11b、CD11c、Gr⁃1、CD4、CD19和CD8进行染色。利用不同颜色的抗CD4用作补偿对照。染色后,使用FACSCalibur(BD)上机,FlowJo 10软件分析细胞。
1.8 T细胞转移实验取WT和Dock2-/-小鼠的脾脏,碾磨成单细胞,通过磁珠分选富集分离出T淋巴细胞(CD3+),眼静脉注射入TCRa-/-小鼠(107/每个小鼠),分别用作TCRa-/-+WT组和TCRa-/-+Dock2-/-组。10 d后,TCRa-/-+WT和TCRa-/-+Dock2-/-小鼠分别灌胃感染1×1010CFU的柠檬酸杆菌,之后检测体重。在感染后14 d,处死小鼠,测量结肠长度和重量,取结肠做组织切片并HE染色。收集血清,通过ELISA检测的IgM,IgG,IgG1,IgG2b,IgG2c,IgG3和IgA3的水平。
1.9 血清抗体转移实验对Dock2-/-小鼠进行C.rodentium感染。在感染后第3、4和5天,静脉注射150 μL未感染的WT小鼠血清(D0血清)或者感染21 d的WT小鼠血清(D21血清)。检测Dock2-/-+D0血清和Dock2-/-+D21血清小鼠在感染后的生存率。
1.10 统计学处理数据表示为平均值±标准误(SEM)。使用studentt检验或单因素方差分析计算所有P值。P<0.05表示差异具有统计学意义。
2 结果
2.1 Dock2在柠檬酸杆菌感染后期宿主清除致病菌中起重要作用与WT小鼠相比,Dock2-/-小鼠的体质量下降明显(图1A)、结肠更短(图1C)。测量了粪便和结肠组织中的病原体负担,发现在感染后21 d,WT小鼠清除了肠道所有的柠檬酸杆菌但Dock2-/-小鼠粪便中却有107至108/g的细菌负荷(图1B)。感染后21 d,收集肝脏,脾脏和MLN,分析各组织的活菌负荷。结果表明,感染后第21天Dock2-/-小鼠具有更高的柠檬酸杆菌负荷,并且小鼠结肠,脾脏,MLN和肝脏中细菌负荷的趋势相似(图1D⁃G)。组织学分析还显示,在感染后14 d和21 d,Dock2-/-小鼠比WT小鼠具有更严重的组织学病变和更高的隐窝高度(图1H⁃J)。
2.2 感染晚期Dock2-/-小鼠中促炎细胞因子的过量产生感染21 d后,Dock2-/-小鼠的结肠组织和血清中细胞因子IFN⁃γ,TNF⁃α,KC,MCP⁃1,IL⁃6和IL⁃17的水平均显着升高(图1A⁃B;D⁃I;K⁃N)。MIP⁃2水平在Dock2-/-小鼠结肠组织中显著升高(图2C),但在血清中无明显变化(图2J)。
2.3 柠檬酸杆菌感染后期Dock2-/-小鼠的炎症细胞浸润在柠檬酸杆菌感染21 d后,与WT相比,Dock2-/-小鼠结肠中的巨噬细胞和嗜中性粒细胞浸润更多(图2A)。利用流式细胞术进行染色发现,经柠檬酸杆菌感 染21 d后,Dock2⁃/⁃小 鼠 的 结 肠和脾脏中树突状细胞(CD11b+CD11c+),髓样细胞(CD11b+)和嗜中性粒细胞(CD11b+Gr⁃1+)细胞数比例更高(图2B,C)。Ki67的免疫组织化学结果显示,与WT小鼠相比,Dock2-/-小鼠表现出更多的肠道上皮细胞增殖(图2A)。
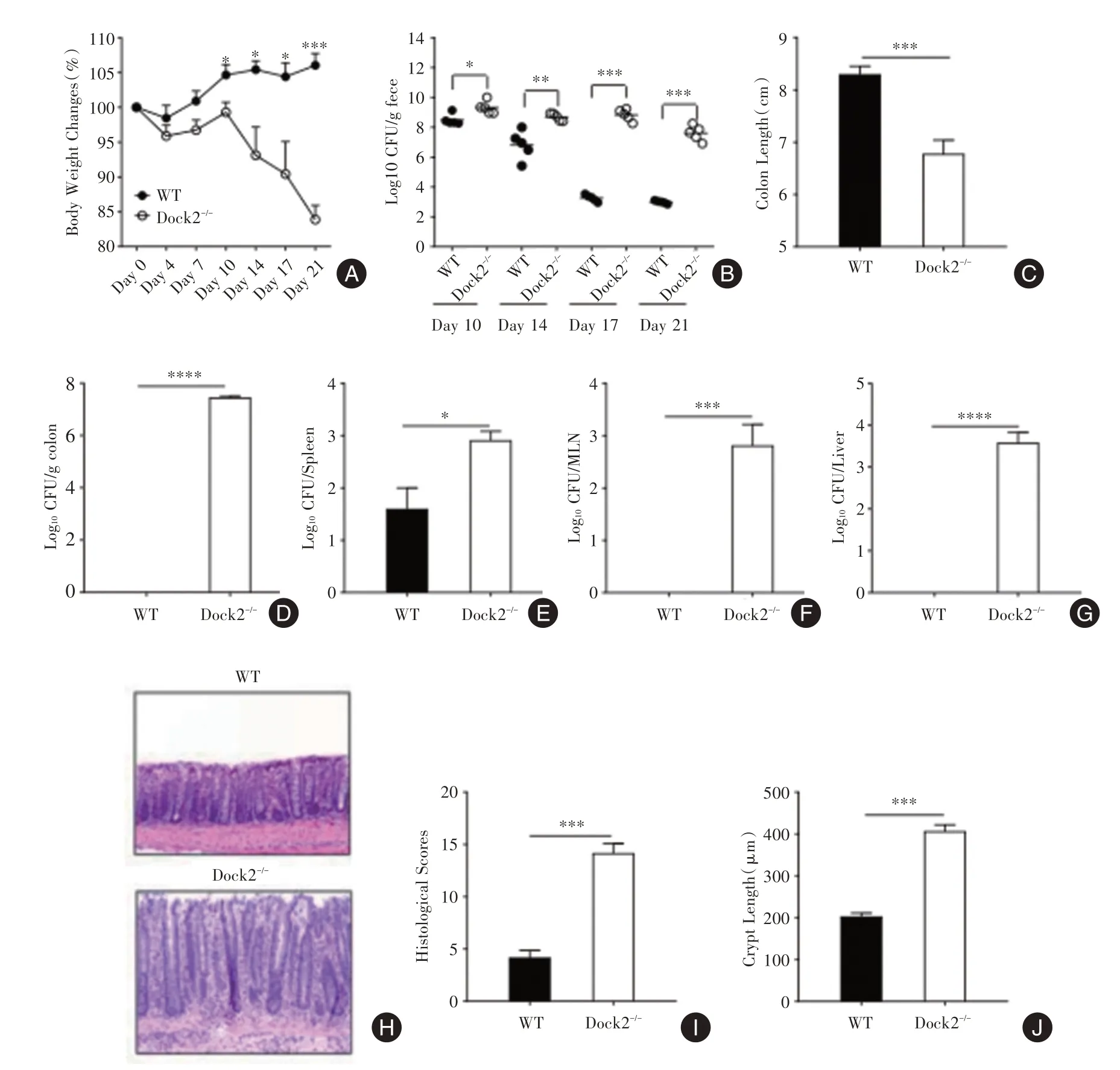
图1 Dock2在柠檬酸杆菌感染后期宿主清除致病菌中起重要作用Fig.1 Dock2 was required for host bacterial clearance after C.rodentium infection
2.4 Dock2-/-小鼠在感染柠檬酸杆菌期间有T细胞缺陷Dock2-/-小鼠在感染前及感染后第14天,第21天的脾脏CD4+和CD8+细胞数量均显着降低(图2A⁃B)。除了CD8+CD69+T细胞(图2H),感染后21 d Dock2-/-小鼠的脾脏中激活T细胞的数量少于WT小鼠(图2C⁃G)。
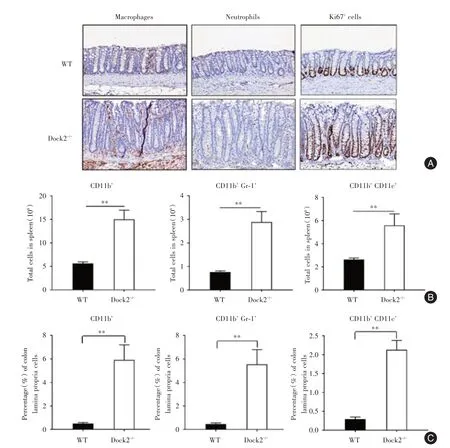
图2 柠檬酸杆菌感染后WT和Dock2-/-小鼠结肠中的炎症细胞浸润Fig.2 Inflammatory cell infiltration in Dock2-/-mice after C.rodentium infection
造血祖细胞在胸腺发育为成熟的T细胞。感染前,WT与Dock2-/-小鼠的胸腺大小相似,但Dock2-/-小鼠的胸腺中CD4+和CD8+细胞的百分比更低(图3A⁃B)。感染14 d后,Dock2-/-小鼠的胸腺明显缩小且细胞数较WT更少(图3A⁃C)。此时,胸腺细胞的组成急剧变化。与WT小鼠相比,Dock2-/-小鼠的CD4+和CD8+细胞的百分比略显著降低,但CD4+CD8-,CD4-CD8+和CD4-CD8-细胞的百分率有所升高(图3D⁃G)。在CD4-CD8-双阴性(double⁃negative,DN)细胞中,Dock2-/-小鼠的DN第4阶段(DN4)百分比显着高于WT小鼠(图3H),表明Dock2-/-胸腺细胞再生的缺陷可能始于DN4。
2.5 感染了柠檬酸杆菌的Dock2-/-小鼠相对对照有更少的B细胞和抗原特异性IgG抗体的产生感染后第14天,在WT结肠中可见到许多B细胞,但是,Dock2-/-小鼠的结肠中几乎没有B细胞(图4A⁃B),同时与WT相比Dock2-/-小鼠脾脏中的B细胞数量也明显更低(图4C)。这表明Dock2-/-小鼠感染部位的B细胞数量较少。
本研究检测了柠檬酸杆菌特异性血清抗体的产生,发现在感染后第14天及21天,Dock2-/-小鼠的血清中IgG水平均显着低于WT小鼠,而IgM的水平则无明显区别(图4D⁃E)。尽管在感染后第21天,Dock2-/-小鼠有更严重的细菌负担(图1 B,D),但IgG,IgG1,IgG2b,IgG2c和IgG3的水平仍比WT小鼠低(图4E⁃I)。
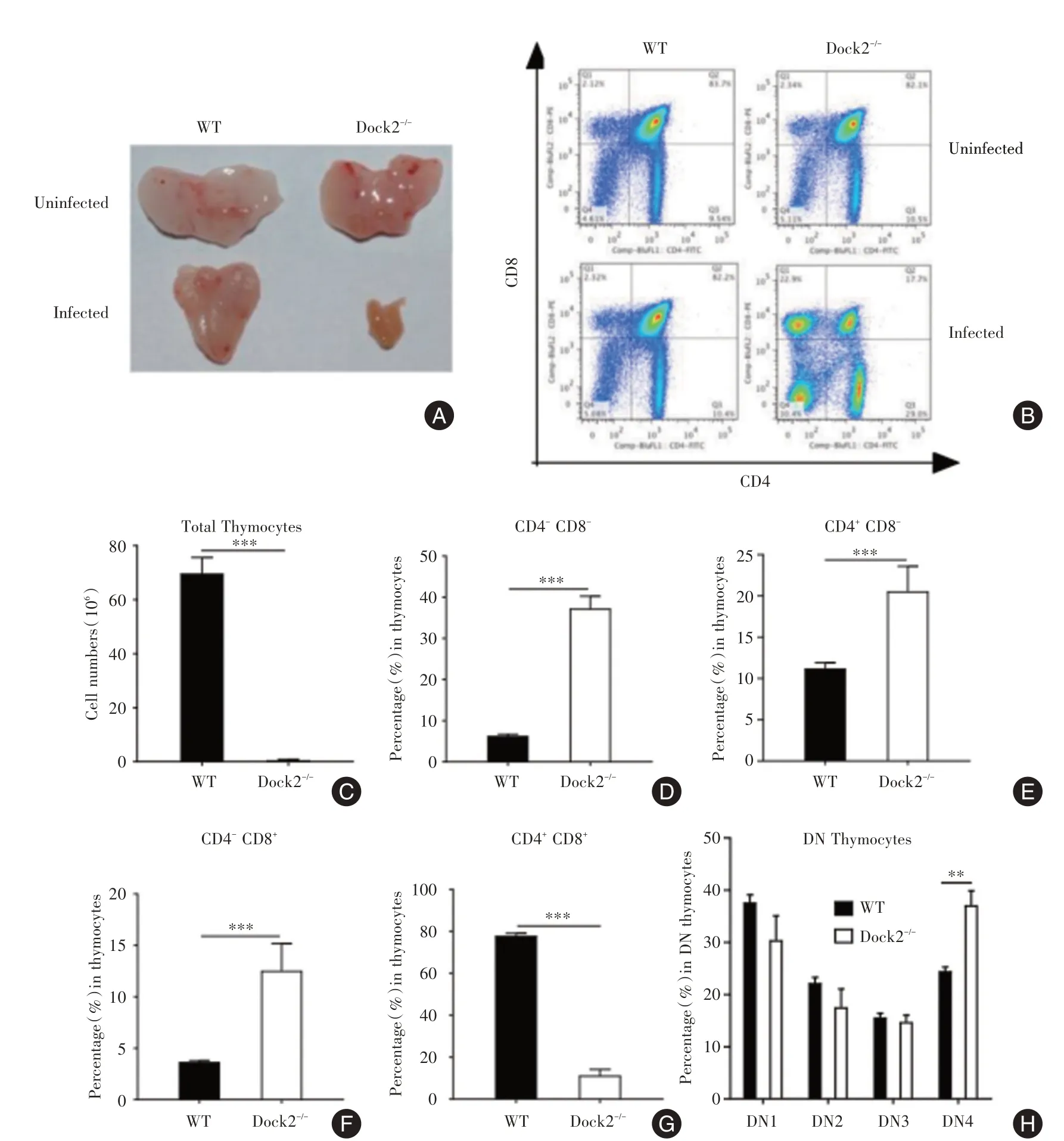
图3 柠檬酸杆菌感染后WT和Dock2-/-小鼠胸腺细胞概况Fig.3 Thymocyte profiles of WT and Dock2-/-mice after C.rodentium infection
2.6 血清转移和T细胞转移对柠檬酸杆菌诱导的结肠炎具有抑制作用Dock2-/-小鼠中的T细胞在柠檬酸杆菌感染过程中存在缺陷(图4A、B)。为了确定对Dock2-/-小鼠补充T细胞是否可以抑制柠檬酸杆菌诱导的结肠炎,分别将WT和Dock2-/-小鼠的T细胞注射到TCRa-/-小鼠体内。在感染柠檬酸杆菌14 d后,TCRa-/-+Dock2-/-小鼠比TCRa-/-+WT小鼠的体质量减轻更为严重(图5A)。结肠缩短也更严重(图5B),且具有更重的结肠重量(图5C)和更高的组织学损伤评分(图5D)。为确定补充性T细胞是否通过改变TCRa-/-小鼠血清中抗体的含量来抵抗柠檬酸杆菌感染所致结肠炎,测试了TCRa-/-+WT和TCRa-/-+Dock2-/-小鼠的IgG,IgG1,IgG2b,IgG2c,IgG3,IgA和IgM的水平。TCRa-/-+Dock2-/-小鼠中的IgG,IgG1,IgG2b,和IgG2c的水平低于TCRa⁃/⁃+WT小鼠的水平(图5E,补图3A⁃C)。IgG3,IgA和IgM的水平无显著差异(补图3D⁃F)。补充的T细胞可能部分通过增加IgG水平抑制结肠炎。
为了测试补充WT小鼠血清中的抗体是否可以改变Dock2-/-小鼠结肠炎的严重程度,将未感染的WT小鼠的血清(Dock2-/-+D0血清)和柠檬酸杆菌感染21 d后的WT小鼠血清(Dock2-/-+21 d血清),分别注入Dock2-/-小鼠体内。与Dock2-/-+D0血清小鼠相比,Dock2-/-+21 d血清小鼠的存活率明显提高(图5F),表明柠檬酸杆菌感染后WT小鼠血清中的抗体具有缓解Dock2-/-小鼠结肠炎的作用。
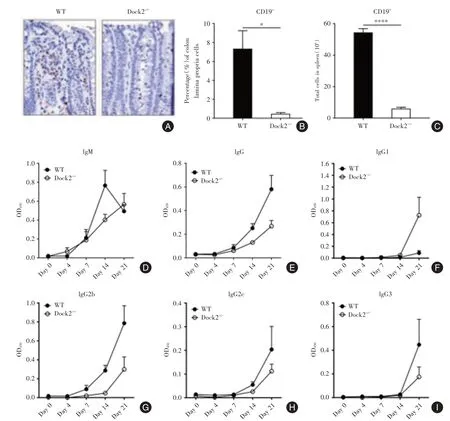
图4 感染了柠檬酸杆菌的Dock2-/-小鼠体内B细胞数量和抗体产生减少Fig.4 The decrease in B cells and antibody production in Dock2-/-mice infected with C.rodentium infection
3 讨论
先前研究表明,Dock2-/-小鼠在柠檬酸杆菌感染后第14天表现出感染体征[11]。但是,感染后期Dock2在宿主清除肠道病原菌中的作用尚不明确。本研究发现,Dock2参与到柠檬酸杆菌感染后宿主清除细菌中。柠檬酸杆菌感染第21天,Dock2-/-小鼠产生了更多的促炎细胞因子,表现出更高的死亡率。肠道也有更强的巨噬细胞/嗜中性粒细胞浸润。说明Dock2-/-小鼠的嗜中性粒细胞和巨噬细胞可以到达细菌病原体入侵的位置。但是,Dock2-/-小鼠在机体清除病原菌的过程中仍然存在严重缺陷。Dock2缺失引起的在柠檬酸杆菌感染中的细菌清除障碍的机制可能与Dock2-/-小鼠的T细胞缺陷、B细胞数量减少和特异性IgG抗体减少有关。且转移含Dock2的T细胞和血清对柠檬酸杆菌诱导的结肠炎有保护作用。
炎症性肠病(inflammatory bowel diseases,IBDs)包括克罗恩病和溃疡性结肠炎,是一种病因不明的肠道炎症,具有慢性、非特异性和复发性等特征[19]。IBDs是当前世界的主要健康问题之一,发病率居高不下[20]。在过去的20年中,IBD的患病率在中国迅速增加,已成为中国常见的消化系统疾病之一[21]。IBD的发病机制非常复杂,可能与遗传缺陷,免疫应答功能障碍和肠道菌群紊乱有关[19,22]。有研究表明,IBD的发病可能与某些肠道细菌的过度生长和肠上皮细胞中的宿主基因缺陷有关[23]。然而,IBD的发病机理目前尚不明确。本研究的结果提示,Dock2可能参与对结肠炎或者IBD的调控。
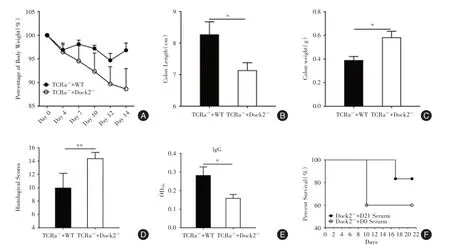
图5 T细胞和血清转移对结肠炎具有抑制作用Fig.5 T cell and serum transfer has inhibitory effects on colitis
对食管腺癌和大肠癌患者的癌组织进行全基因测序鉴定发现DOCK2基因发生高频突变[24-25],这提示Dock2可能在维持粘膜表面稳态中起重要作用。在5例合并免疫缺陷疾病的婴儿患者中也发现了DOCK2突变。在趋化因子刺激下,T细胞中的Rac1活化受到抑制,且突变个体患有T细胞,B细胞和NK细胞的迁移缺陷,并且NK细胞的变性也受到影响[26]。这些研究的结果和本研究结果一致,提示调控Dock2的表达对于研究机体肠道功能及抗感染有重要作用。
最近有研究表明,抑制Dock2可能抑制LPS诱导的巨噬细胞活化,并且Dock2可能是治疗内毒素血症相关性急性肺损伤的新靶标[27]。利用shR⁃NA下调Dock2的表达可导致B细胞淋巴瘤细胞增殖减弱,该机制可能与Dock2介导的Rac/ERK有关[28]。在前列腺癌细胞的增殖中,Dock2通过介导CXCL13/ERK/Akt信号通路起重要作用,这可能会成为治疗前列腺癌的新靶标[29]。本研究中确定了Dock2是宿主对抗柠檬酸杆菌感染的重要因子,并且对于肠道病原体感染后期的细菌清除至关重要,这与T细胞活性和抗原特异性IgG抗体产生的缺陷密切相关。但是Dock2-/-小鼠对柠檬酸杆菌感染的高敏感性是否与CXCL13/ERK/Akt信号通路激活或者肠道相关菌群失调密切相关,目前尚不清楚。下一步研究的方向需要确定Dock2在柠檬酸杆菌感染后炎症激活的信号通路的作用及维持肠道微生物群平衡中的作用机制。

