观察舌下免疫治疗阻断学龄前儿童过敏性咳嗽变异型哮喘发展为典型哮喘的作用
宋 颖 张胜红 锦州医科大学附属第一医院心血管实验室锦州121000
咳嗽变异型哮喘(cough variant asthma,CVA)是一种特殊类型的哮喘,主要以慢性咳嗽为主或以咳嗽为唯一的临床表现。CVA是慢性咳嗽的主要病因之一,国内研究表明超过40%的儿童慢性咳嗽由CVA引起[1]。国外研究表明,CVA为典型哮喘(classic asthma,CA)的先驱表现,有相当部分的儿童CVA最终出现喘鸣,进而发展为CA[2]。变应原特异性免疫治疗(allergen specific immunotherapy,ASIT)是唯一可能改变过敏性疾病自然进程的治疗措施,可以预防疾病加重[3]。舌下特异性免疫治疗(sublingual immunotherapy,SLIT)作为一种更为有效、安全、方便的免疫治疗新型给药途径,近年来广泛应用于变应性鼻炎、过敏性哮喘的治疗,但将SLIT应用于CVA的研究国内外报道并不多见[4]。因此,本研究分析了96例过敏性CVA患儿的随访数据,观察SLIT治疗的预防作用、作用机制及临床疗效。
1 资料与方法
1.1 资料
1.1.1 研究对象 回顾性分析2014年1月至2018年12月期间到我院诊治的过敏性CVA患儿的临床资料。96例4~6岁学龄前患儿根据其及家属意愿分为SLIT组(42例)和对照组(54例)。SLIT组中男性24例,女性18例,平均年龄(4.69±0.78)岁;对照组中男性29例,女性25例,平均年龄(4.72±0.83)岁,两组患儿在性别(χ2=0.11,P>0.05)和年龄(t=0.09,P>0.05)上均无显著性差异,具有可比性。所有入组患儿的诊治均参照中国儿童慢性咳嗽诊断与治疗指南(2013年修订)中CVA标准[5]:①咳嗽持续>4周,常在夜间和(或)清晨发作或加重,以干咳为主;②临床上无感染征象或经过较长时间抗菌药物治疗无效;③支气管舒张剂等抗哮喘药物诊断性治疗有效;④排除其他原因引起的慢性咳嗽;⑤支气管激发试验阳性提示气道高反应性;⑥PEF每日变异率(连续监测2周)≥13%;⑦血清过敏原检查粉尘螨为阳性,合并或不合并其他过敏原,粉尘螨是主要过敏原且与临床症状具有相关性。所有患儿及家属均签知情同意书。
1.1.2 药物试剂与仪器 布地奈德气雾剂(阿斯利康制药,批号:WS-458(X-406)-2001);孟鲁司特钠片(默沙东,批号:J20130047);沙美特罗替卡松粉吸入剂(默沙东,批号:JX20150018);粉尘螨滴剂1~4号(浙江我武生物科技股份有限公司,国药准字:S20060012);ELISA试剂盒(美国BD公司)。多功能酶标仪购自赛默飞世尔科技(中国)有限公司。
1.2 方法
1.2.1 治疗方案 对照组CVA患儿初始治疗方案:低剂量布地奈德气雾剂+及孟鲁司特钠片治疗8周以上。之后每2~6个月复诊1次,根据患儿症状和控制水平进行评估,按照儿童哮喘的阶梯方案进行降级或者升级治疗:如患儿控制良好且能维持稳定则进行降级治疗;如果不能有效控制症状,则采用双倍低剂量的布地奈德气雾剂。而对于已经发展为CA,尤其是持续性哮喘患儿,增加使用沙美特罗替卡松粉吸入剂。SLIT组CVA患儿治疗方案:在对照组基础上给予SLIT治疗,采用粉尘螨滴剂1~4号第1、2、3周分别使用粉尘螨滴剂1、2、3号,第1~7天分别按1、2、3、4、6、8、10滴顺序递增,从第4周开始持续使用粉尘螨滴剂4号,3滴/次,1次/d,直到疗程结束。
1.2.2 评估指标 典型哮喘诊断标准:参照中国过敏性哮喘诊治指南(第一版,2019年)中CA标准统计病例数,并评估哮喘严重程度:间歇性、轻度持续性、中度持续性和重度持续性哮喘[6]。血清白IL-17、IL-33和IL-35水平检测采用酶联免疫吸附试验法测定患儿治疗前后的血清IL-17、IL-33和IL-35水平。
CVA咳嗽症状评分:日间咳嗽症状积分(daytime cough symptom score,DCSS):无咳嗽计0分;偶有短暂咳嗽计1分;频繁咳嗽,轻度影响日常活动计2分;频繁咳嗽,严重影响日常活动计3分。夜间咳嗽症状积分(night cough symptom score,NCSS):无咳嗽计0分;入睡时短暂咳嗽或偶有夜间咳嗽计1分;因咳嗽轻度影响夜间睡眠计2分;因咳嗽严重影响夜间睡眠计3分[5]。
呼气峰流速(PEF):使用科卡公司的峰速仪测定患儿的PEF%。
药物评分标准如下:局部固醇类糖皮质激素为2分;抗白三烯药物为1分;支气管扩张药计1分。累计总分即为药物评分(TMS)[7]。
视觉模拟量表(visual analogue scale,VAS):使用一把10 cm长的移动标尺,一面标有10个刻度,两端分别为“0”分和“10”分,0分代表无任何症状,10分代表最大程度的症状和不适。使用时将有刻度的一面背向受试者,让受试者或患儿家长在标尺上指出代表自己症状程度的相应位置,医师根据其指出的位置评出分数。
1.3 统计学分析 采用SPSS21.0软件进行数据统计分析。计数资料采用χ2检验。计量资料符合正态分布以描述,组间比较采用独立样本t检验。不符合正态分布的计量资料采用M[Q1;Q2]描述,组内比较均采用多个相关样本的Firedman非参数检验,组内的两两比较采用q检验;组间比较采用独立样本Wilcoxon秩和检验或者非参数检验Mann-Whitnet U。P<0.05代表差异具有统计学意义。
2 结果
2.1 SLIT阻断CVA发展为CA的作用分析 96例CVA患儿在3年治疗期间有23例(23.96%)发展为CA,其中SLIT组4例(9.52%),对照组19例(35.19%),组间差异有统计学意义(χ2=8.54,P<0.05)。SLIT组中的3例CA患儿为间歇性哮喘,对照组为12例,差异有统计学意义(χ2=4.07,P<0.05);两组患儿在轻度和中度持续性哮喘上差异无统计学意义(P>0.05)。见表1。
2.2 两组患儿血清IL-17、IL-33和IL-35水平 与基线相比,治疗3年后两组患儿的血清IL-17、IL-33水平降低,IL-35水平显著升高,差异有统计学意义(P<0.05)。基线时,两组间血清IL-17、IL-33和IL-35水平差异无统计学意义(P>0.05),经过3年治疗后,SLIT组血清IL-17、IL-33水平低于对照组,血清IL-35水平高于对照组,差异有统计学意义(P<0.05)。见表2。
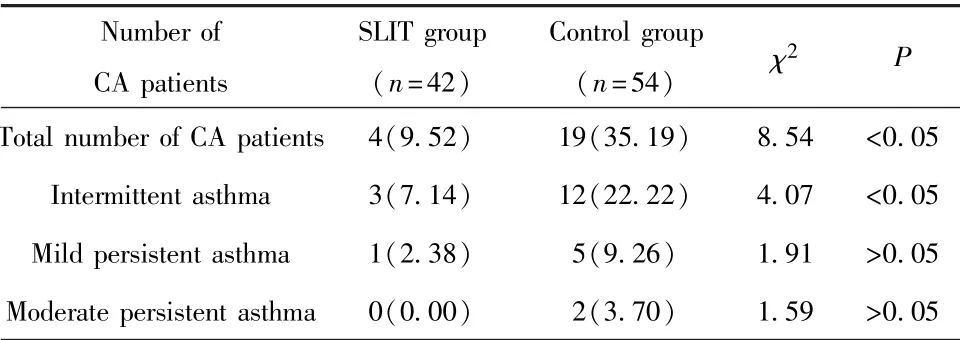
表1 两组患儿转化为CA的例数及百分比[例(%)]Tab.1 Number and percentage of children patients converted to CA in both groups[n(%)]
2.3 两组患儿症状评分比较 与基线相比,治疗1、2和3年后两组患儿DCSS和NCSS均下降,差异有统计学意义(P<0.05)。基线时,两组间DCSS和NCSS差异无统计学意义(P>0.05),在治疗1、2和3年时,SLIT组DCSS和NCSS均低于对照组,差异有统计学意义(P<0.05)。见表3。
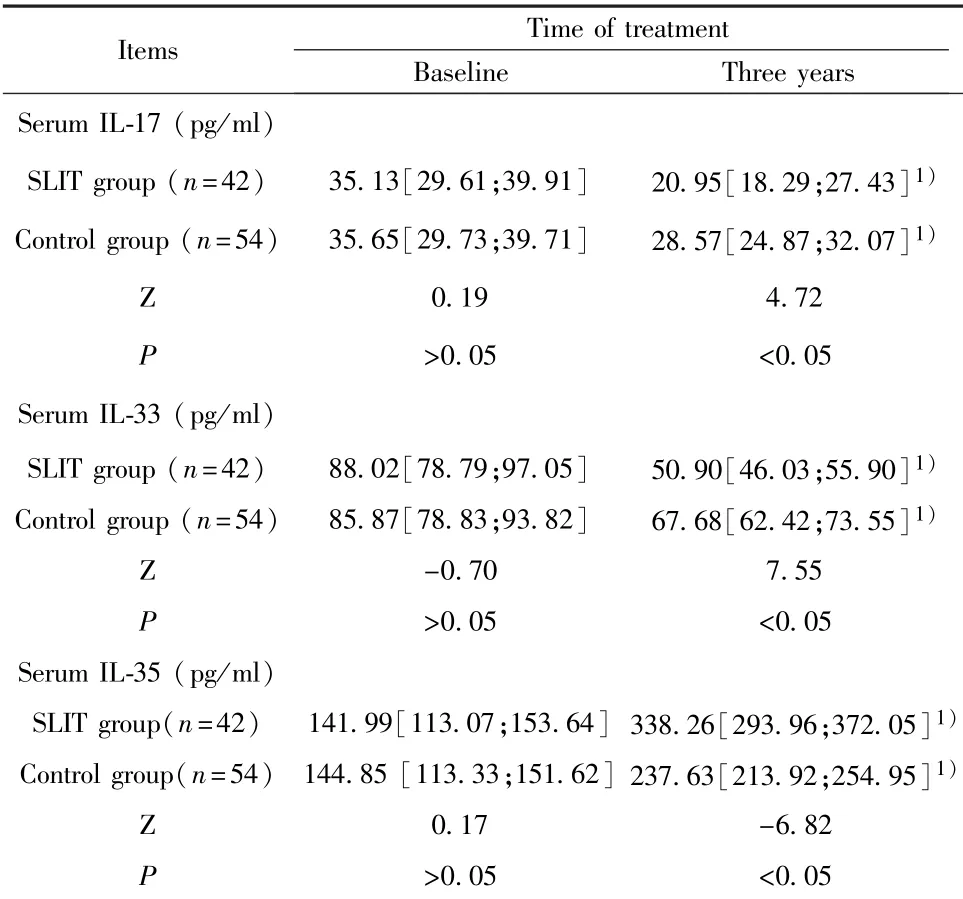
表2 两组血清IL-17、IL-33和IL-35水平比较(M[Q1;Q2])Tab.2 Comparison of levels of serum Il-17,Il-33 and Il-35 between two groups(M[Q1;Q2])
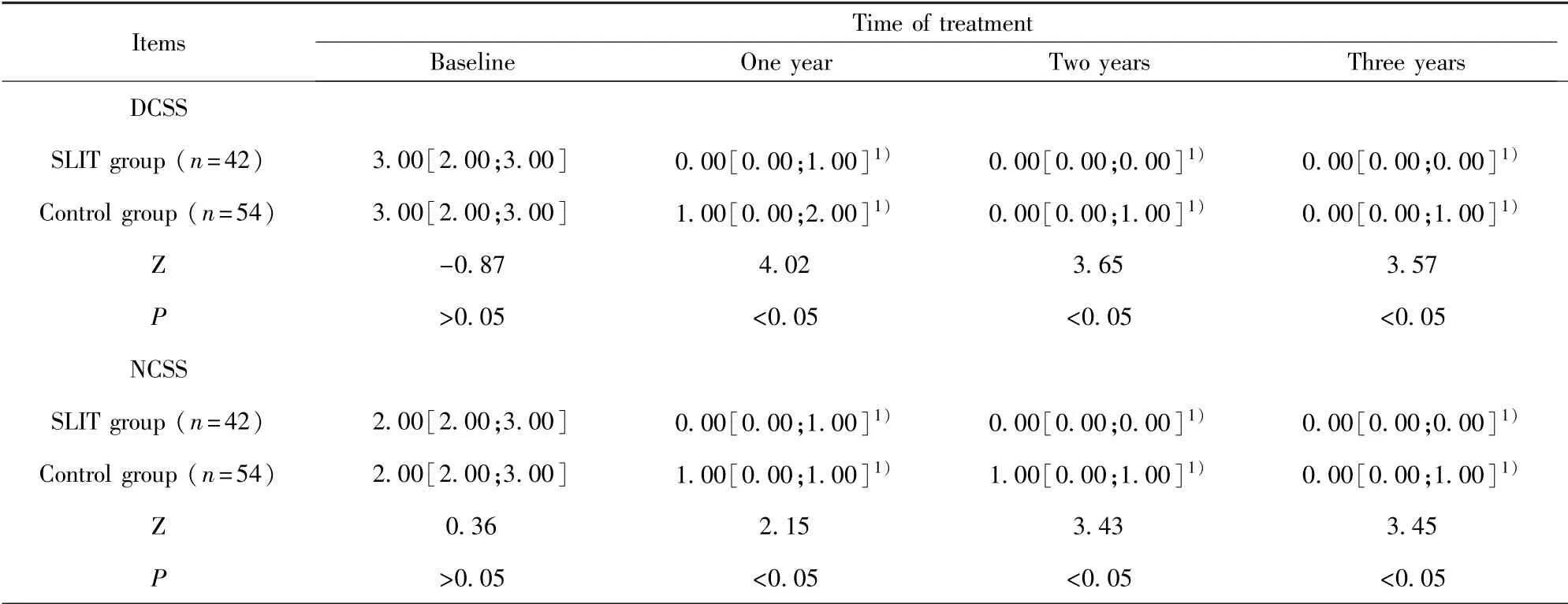
表3 两组治疗前后症状评分比较(M[Q1;Q2])Tab.3 Comparison of symptom scores before and after treatment between two groups(M[Q1;Q2])

表4 两组治疗前后PEF%比较(M[Q1;Q2])Tab.4 Comparison of PEF%before and after treatment betweentwo groups(M[Q1;Q2])
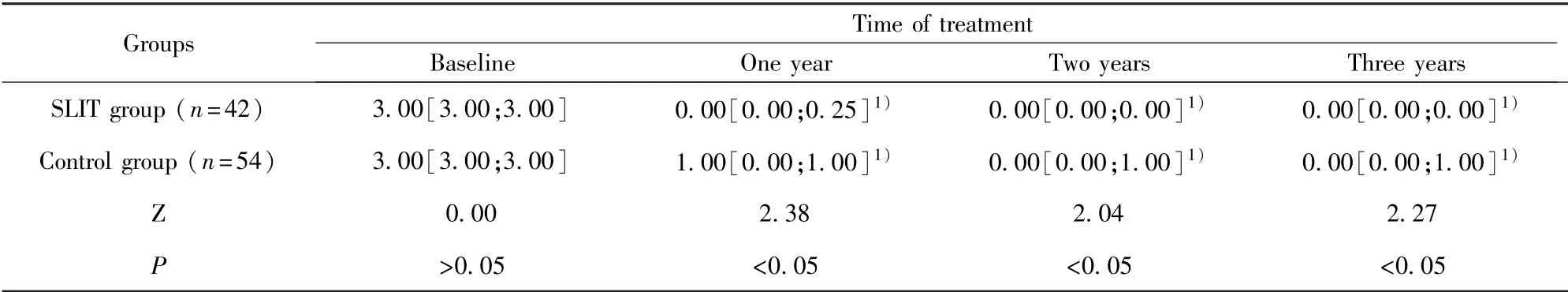
表5 两组治疗前后TMS比较(M[Q1;Q2])Tab.5 Comparison of TMS before and after treatment between two groups(M[Q1;Q2])

表6 两组治疗前后VAS评分比较(M[Q1;Q2])Tab.6 Comparison of VASscores before and after treatment between two groups(M[Q1;Q2])
2.4 两组患儿PEF%比较 与基线相比,治疗1、2和3年后两组患儿PEF%均明显改善,差异有统计学意义(P<0.05);与治疗1年相比,SLIT组PEF%在治疗2年和3年后进一步改善,差异有统计学意义(q分别为-2.70、-2.74,P<0.05),对照组无显著变化(P>0.05)。基线时,两组间的PEF%差异无统计学意义(P>0.05),在治疗1、2和3年时,SLIT组的PEF%均显著优于对照组(P<0.05)。见表4。
2.5 两组患儿药物积分比较 与基线相比,治疗1、2和3年后两组患儿TMS均降低,差异有统计学意义(P<0.05)。基线时,两组间的TMS差异无统计学意义(P>0.05),在治疗1、2和3年时,SLIT组TMS均低于对照组,差异有统计学意义(P<0.05)。见表5。
2.6 两组患儿VAS评分比较 与基线相比,治疗1、2和3年后两组患儿的VAS评分均降低(P<0.05);与治疗1年相比,SLIT的VAS评分在治疗3年后进一步显著改善,差异有统计学意义(q=3.17,P<0.05)。基线时,两组间的VAS评分差异无统计学意义(P>0.05),在治疗1、2和3年时,SLIT组的VAS评分均低于对照组,差异有统计学意义(P<0.05)。见表6。
3 讨论
哮喘是气道的慢性炎症性疾病,研究显示,气道重塑始于哮喘早期。因此,目前强调儿童哮喘必须予以早期干预治疗,以期有效减轻阻断气道重塑过程,防止迁延进展为成人持续性哮喘并出现不可逆的肺功能损害。国外研究表明,CVA为典型哮喘的先驱表现,有相当部分的儿童CVA最终出现喘鸣[8]。儿童CVA 6~96个月的随访结果显示,有9%~75%的患者发生喘息,平均约30%的CVA儿童最终进展为CA,但有关CVA转化为典型哮喘的相关危险因素目前尚不明确[2,9]。CVA患儿多系过敏体质,目前认为其本质与哮喘相同,包括气道壁嗜酸性粒细胞为主的炎症细胞浸润、气道高反应性及气道重塑等[10]。因此其治疗上与CA的治疗原则相同,主要通过环境控制以避免过敏原、药物治疗、免疫治疗和患者教育。SLIT治疗是一种对因疗法,作用于人体的免疫机制进而诱导产生免疫耐受。SLIT治疗可诱导前体细胞Th0向Th1和Treg偏移,而Treg细胞也具有促进Th0向Th1细胞分化和抑制Th0向Th2细胞分化的作用,从而调节Th1/Th2的平衡[11]。同时,大量募集的Treg细胞能够产生IL-10和TGF-β这两种细胞因子,可促进sIgG4等阻断性抗体产生,最终产生免疫耐受[12-13]。
过敏性疾病的发生发展遵循一定规律,通常被称作“过敏性疾病的自然进程”,即这类疾病通常在婴幼儿时期开始,表现为湿疹或者食物过敏等。一般到3岁左右,这些症状会自动缓解,但在其后续的童年或者青少年时期患呼吸道过敏性疾病的风险会有所增加,过敏性鼻炎患儿合并哮喘的风险尤其高。SLIT可通过防止产生新的过敏原和/或减少哮喘的风险因子,从而改变呼吸道过敏性疾病的自然进程[14]。NOVEMBRE等[15]的研究将113例5~14岁花粉症患儿随机分为SLIT组和药物治疗组,患者疗程为3年,对照组44例鼻炎患者中有18例发展为哮喘,舌下免疫治疗组中45例有8例发展为哮喘,提示舌下特异性免疫治疗对哮喘的发生有预防效应。本研究发现,对照组54例CVA患儿中有19例发展为CA,其中12例为间歇性哮喘,轻度和中度持续性哮喘分别为5例和2例;而SLIT组仅有4例发展为CA,3例为间歇性哮喘,1例为轻度持续性哮喘,提示SLIT能够预防儿童CVA向CA发展。
哮喘发病机制复杂,涉及多种炎症因子及细胞平衡,特别是Th1/Th2细胞失衡在其中发挥重要作用。近年来,随着Treg细胞和辅助性T细胞(Th17)的发现,显示其相关细胞因子IL-17、IL-33、IL-35与哮喘的发生发展密切相关[16-17]。IL-17是由Th17细胞分泌的细胞因子,能够促使气道内分泌过量黏液,促进中性粒细胞在气道内聚集,在气道高反应形成的过程中发挥重要作用[18]。IL-33是由Th2细胞分泌的炎症因子,能够通过聚集和活化Th2细胞、肥大细胞及嗜酸性细胞等促进其释放趋化因子和炎症因子,从而引起哮喘[19]。IL-35是由Treg细胞分泌的细胞因子,能够促进Treg细胞扩增、抑制Th17细胞产生并促进Th1细胞分化[20]。本研究发现,SLIT组CVA患儿在治疗3年后血清IL-17、IL-33水平显著升高,IL-35水平显著下降(P<0.05),同时SLIT组血清IL-17、IL-33水平显著低于对照组,血清IL-35水平明显高于对照组。
目前国内外将SLIT应用于CVA治疗的报道并不多。一项针对78例17~71岁CVA患者的回顾性研究发现,与单纯药物治疗组相比,SLIT组患者的症状评分、症状改善时间方面明显减少,肺功能指标明显升高,另外IFN-γ的表达水平也明显增加[21]。郑伯强等[22]的一项针对106例4~14岁CVA患儿的随机对照研究发现,治疗25周后,SLIT组的症状降低值、PEF升高幅度及血EOS比例下降程度均显著高于常规药物治疗组。本研究同样发现,SLIT联合药物治疗能够减轻咳嗽症状,减少抗过敏药物使用,改善患儿的肺功能,同时效果要明显优于单纯对症药。现有的文献报道初步显示了SLIT对于CVA的疗效,然而其有效率、预防作用、长期疗效、危险因素等方面的基础研究资料相当匮乏,仍需要进一步大样本、更为严谨的临床试验来证实。

